枳壳挥发油对炎症相关结肠癌小鼠作用研究
2021-08-19罗曦李帅男包永睿王帅李天娇孟宪生
罗曦,李帅男,包永睿,3,4,王帅,3,4,李天娇,3,4,孟宪生,3,4
(1.辽宁中医药大学药学院,辽宁 大连 116600;2.沈阳市第二中医院,辽宁 沈阳 110101;3.辽宁省中药多维分析专业技术创新中心,辽宁 大连 116600;4.辽宁省现代中药研究工程实验室,辽宁 大连 116600)
近年来,结肠癌发病率持续增长,现已位居消化道恶性肿瘤第2位[1-2]。手术结合放化疗是治疗结肠癌的临床主要手段,但其副作用大、患者易复发[3]。机体免疫系统在调节肿瘤免疫应答,改变肿瘤微环境中发挥重要作用,而大多数肿瘤细胞因机体免疫功能低下会逃逸免疫监控,表现出“免疫逃逸”的现象是导致放化疗后肿瘤复发的主要原因[4]。肿瘤炎症微环境属中医微观辨证的范畴,应在中医传统辨证理论的指导下,注重“温补通滞”治法对肿瘤炎症微环境的免疫调节作用[5]。枳壳为芸香科植物酸橙(CitrusaurantiumL.)及其栽培变种的干燥未成熟果实,归脾、胃经,具有理气宽中、行滞消胀的功效[6],具有抗炎、抗氧化、抗肿瘤等多种药理活性[7],作为理气药常出现于中医临床治疗结肠癌的处方中[8-10]。枳壳挥发油为中药枳壳的主要药效成分之一,是其理气健脾作用的基础[11]。现代研究表明,具有健脾功效的中药,大多具有免疫调节作用[12-14],然而,枳壳挥发油是否通过调控机体肿瘤炎症微环境及免疫调节功能而发挥治疗作用,目前未有报道。本研究采用氧化偶氮甲烷/葡聚糖硫酸钠(AOM/DSS)建立小鼠炎症相关结肠癌模型,探究枳壳挥发油对炎症相关结肠癌小鼠肿瘤生长、免疫调节的影响及其可能机制,以期为枳壳挥发油的临床应用提供更多的药效研究基础。
1 实验材料
1.1 实验动物与饲养条件 BALB/c小鼠均为雌性,体重(20±2)g,4 周龄,购自辽宁长生生物技术有限公司。实验动物生产许可证号:SCXK(辽)2020-0001;实验单位使用许可证号:SYXK(辽)2013-0009。动物实验室室温22 ℃,湿度(50%±20%),12 h/12 h明暗周期的环境下分笼饲养,自由摄食饮水,适应1周后用于实验。
1.2 药品与试剂 枳壳药材(亳州市康美中药有限公司,批号:20200716,经辽宁中医药大学许亮教授鉴定为芸香科植物酸橙(CitrusaurantiumL.)及其栽培变种的干燥未成熟果实);氧化偶氮甲烷(Aladdin公司,批号:A1908142,纯度95%);葡聚糖硫酸钠(Meilunbio公司,批号:S0925A);TransZol Up,Trans-Script One-Step gDNA Removal and cDNA Synthesis Super Mix,2×TransStart Top/Tip Green qPCR SuperMix(北京全式金生物技术有限公司)。
1.3 实验仪器 Thermal Cycler 5100实时荧光定量PCR仪(Thermo Fisher)。
2 实验方法
2.1 枳壳挥发油药液的制备 取枳壳药材粉末(过2号筛)100 g,加水800 mL,保持微沸5 h,至测定器中挥发油量不再增加,停止加热,放置1 h以上[6]。取挥发油适量,加2 % 吐温-80溶液制成浓度为18.45 μL·mL-1的溶液,备用。
2.2 动物分组与模型制备 实验动物随机分成空白对照组、模型组、枳壳挥发油组,每组8只。除空白对照组外,其余组小鼠均按10 mg·kg-1的剂量腹腔注射AOM,每周1次,连续3周[15];7 d后给予2.5% DSS的水溶液连续饮用3 d,之后给予三级水连续饮用5 d,8 d为1个周期,重复上述步骤4次。空白对照组采用等体积0.9%氯化钠注射液。从第1次DSS诱导时开始按照分组进行药物干预,按体重10 mL·kg-1给予制备好的灌胃用药液,空白对照组和模型组给予等量0.9%氯化钠注射液,连续4周,每天1次。
2.3 指标检测 观察各组小鼠的营养状况、体质量和大便性状等。实验结束后,禁食24 h,以颈椎脱臼处死动物,取盲肠至直肠末端的全结肠组织。将结肠组织纵向剖开,冲洗内容物,黏膜面朝上平铺,观察记录有无肿瘤发生及发生数目、大小和位置,计算肿瘤发生率。取结肠组织,经4%多聚甲醛固定24 h后,常规石蜡包埋,切片,HE染色,镜下观察。
2.4 定量聚合酶链式反应
2.4.1 引物设计 GAPDH的上游引物:5′-GCCACCCAGAAGACTGTGGAT-3′,下游引物:5′- GGAAGGCCATGCCAGTGA-3′;Jagged-1的上游引物:5′-TGAAATACACGTGGCCATCTCT-3′,下游引物:5′- ACGCCTCTGAACTCTGACTTCTG-3′;Notch-1的上游引物:5′-ACTTGGCAGATGAACTTGCTCTT-3′,下游引物 5′- TGACCAGCTTGGAGTTTGCA-3′;Hes-1的上游引物:5′-TCCAAGCTAGAGAAGGCAGACAT-3′,下游引物:5′-GGGTCACCTCGTTCATGCA-3′;NF-κB-1的上游引物:5′-GCTCAGCTT GTGAGGGATCTG-3′,下游引物:5′- CCCAACCCTCAGCAAATCCT-3′;IL-1a的上游引物:5′-GATGAAGCTCGTCAGGCAGAA-3′,下游引物:5′-CCTCCCGACGAGTAGTAGGCATA-3′;PD-L1的上游引物:5′-GCGAATCACGCTGAAAGTCA-3′,下游引物:5′-ACGGGTTGGTGGTCACTGTT-3′;PD-1的上游引物:5′-TTCACCTGCAGCTTGTCCAA-3′,下游引物:5′-GGGCAGCTGTATGATCTGGAA-3′(Invitrogen生物试剂公司)。
2.4.2 各组小鼠结肠组织总RNA的提取
2.4.2.1 RNA 沉淀 称取0.1 g组织加入1 mL Trizol up裂解液,在冰上研磨至无明显颗粒,吸出转移至1.5 mL EP管中,静置10 min后,2 000 r·min-1,离心5 min;取上清液加入200 μL 氯仿,涡旋30 s ,静置 5 min,12 000 r·min-1,4 ℃离心10 min。小心吸取顶层上清液转移至另一EP管中,加入等体积的异丙醇,混匀,室温静置10 min,12 000 r·min-1离心10 min。
2.4.2.2 RNA洗涤 离心后弃去异丙醇,加入预冷的75% 乙醇(DEPC水配制)洗涤RNA,静置5 min,7 500 r·min-1,4 ℃离心5 min,离心后弃去乙醇,7 500 r·min-1,4 ℃离心5 min,小心吸出上一步残留的乙醇,室温干燥RNA。
2.4.2.3 总RNA纯度及浓度测定 待RNA变为透明时,加入适量DEPC水溶解。测定A260/280,在1.6~2.0范围内,说明提取的总RNA纯度较高,可以进行后续实验。测定RNA浓度,并将其稀释调整到50 ng·μL-1的浓度,RNA样品放-80 ℃保存。
2.4.3 RNA的逆转录 按照试剂盒说明书将总RNA逆转录成,cDNA反应体系20 μL,包括:Oligo(dT)18Primer(0.5 μg·μL-1):1 μL,2 × TS Reaction Mix:10 μL,TransScript TM RT/RI Enzyme Mix:1 μL,gDNA Remover:1 μL。总RNA:4 μL,加入RNase Free Water至20 μL。反应条件:25 ℃孵育15 min使引物和模板充分结合,42 ℃孵育15 min使逆转录酶发挥逆转录活性,85 ℃加热5 s失活后置入4 ℃保存[16]。
2.4.4 Q-PCR 过程 使用实时荧光定量Thermal Cycler 5100 实时荧光定量PCR 仪,反应体系为20 μL,低温操作上述逆转录出的cDNA为模板进行目的基因扩增[17]。扩增程序为:94 ℃ 30 s,(94 ℃ 5 s,60 ℃ 30 s)×40个循环。RealTime 反应体系为:2×TransStart Top/Tip Green qPCR SuperMix:10 μL,上游引物(10 μmol·L-1):0.4 μL,上游引物(10 μmol·L-1):0.4 μL。cDNA 模板:1.6 μL,加入Nuclease-free Water至20 μL。每个样品设置5个复孔,结果经内参均一化处理后,通过相对Ct值法计算Jagged-1、Notch-1、Hes-1、NF-κB-1、IL-1a、PD-L1和 PD-1 mRNA 相对表达水平,以GAPDH 为内参基因,模型组的2-(ΔΔCt)定义为 1,其中 ΔCt=Ct目的基因- Ct内参基因[18]。
2.5 统计学处理 使用SPSS 19.0软件进行数据分析,计量资料采用独立t检验进行分析,认为P<0.05认为差异有统计学意义。
3 实验结果
3.1 枳壳挥发油对小鼠体重的影响 与空白对照组对比,模型组小鼠在造模之后体重出现显著下降(P<0.01),枳壳挥发油组与模型组相比体重下降情况有所缓解(见图1)。
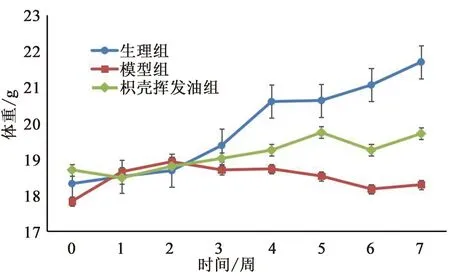
图1 各组小鼠体重变化趋势
3.2 枳壳挥发油对小鼠空白对照状态的影响 实验末期,模型组小鼠出现厌食、脱毛、血便等表现,其中有2只小鼠伴有腹水(见图2),有一只小鼠死亡。枳壳挥发油组小鼠一般情况和营养状况优于模型组小鼠,没有腹水情况。

图2 AOM/DSS诱导的模型组小鼠血便(A)及腹水(B)发生情况
3.3 枳壳挥发油对结肠肿瘤个数影响 空白对照组小鼠肠黏膜表面光滑,其余各组均出现不同程度的增厚。肿瘤发生在小肠内壁的黏膜上,主要分布在距肛门6 cm以内肠段,3 cm以内较为密集。呈蕈伞样向肠内腔突起(见图3)。各组小鼠肿瘤发生数量(见表1)。与模型组相比,枳壳挥发油可显著减少由AOM/DSS诱导的结肠肿瘤发生数量(P<0.01)。
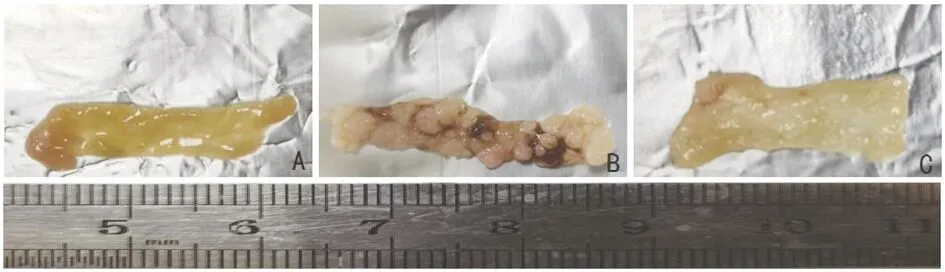
A.空白对照组;B.模型组;C.枳壳挥发油组
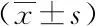
表1 各组小鼠结肠肿瘤发生数量
3.4 结肠组织HE染色病理切片 各组小鼠结肠组织病理切片(见图4)。模型组小鼠结肠组织中细胞排列紊乱,腺管结构消失,核增大;空白对照组小鼠结肠组织细胞排列整齐,腺管清晰,核质比正常;枳壳挥发油组结肠组织相对于模型组细胞紊乱程度呈现不同程度的减轻,腺管逐渐清晰,核质比逐渐趋于正常,接近于空白对照组小鼠结肠组织。
A.空白对照组;B.模型组;C.枳壳挥发油组
3.5 各组小鼠结肠组织中的mRNA相对表达水平 各组小鼠结肠组织样品中Jagged-1、Notch-1、Hes-1、NF-κB-1、IL-1a、PD-L1和 PD-1 mRNA的相对表达量结果见图5。枳壳挥发油组小鼠结肠组织,Jagged-1、Notch-1、Hes-1、NF-κB-1、IL-1a、PD-L1和 PD-1 mRNA水平较模型组显著降低(P<0.01)。
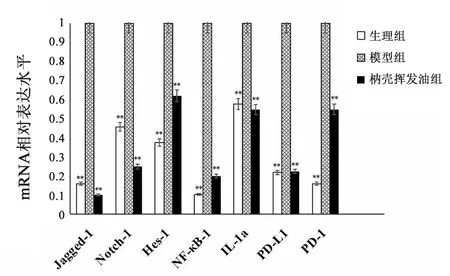
图5 各组小鼠结肠组织中的mRNA相对表达
4 讨论
近年来大量研究表明,Jagged 1/Notch信号通路在结直肠癌组织中表达异常。Jagged 1是Notch受体的配体,其异常表达与肿瘤的发生发展密切相关,且增加肿瘤复发和转移的可能性[19]。Notch与Jagged 1发生受体配体结合后,Notch 信号通路即被激活[20]。Notch信号转导途径参与调节肠发育和肠上皮更新,其异常激活与结直肠癌的发生有关[21]。
Notch与肿瘤的关系最早是在T细胞急性淋巴细胞白血病中被发现,并被鉴定为致癌基因。在结肠癌相关研究中,发现Notch信号通路中的Notch l受体在转导增强肿瘤发生的信号中是必需的。Hes 1为Notch 信号途径的重要受体及下游靶基因,激活 Notch 信号,在结肠癌组织中的表达远高于癌旁组织[22]。在Notch信号通路中的众多靶标中,NF-κB是最重要的一个[23],NF-κB家族的转录因子可以通过结合启动子和增强子中不连续的DNA序列来诱导或抑制基因表达,参与细胞凋亡、周期等过程导致癌症的发生[24]。NF-κB转录因子在结直肠癌组织中存在异常激活[25],是参与结肠癌起始、进展和转移的关键介质。NF-κB在免疫、炎症和癌症进展等方面具有重要作用,在PD-L1启动子的近端区域存在两个NF-κB的结合位点,NF-κB的激活增加,伴有PD-L1和促炎细胞因子IL-1表达的增加[26-29]。IL-1具免疫调节作用,可刺激多种免疫和炎症应答细胞[30];程序性死亡受体1(PD-1)及其配体(PD-L1)与肿瘤细胞免疫“逃逸”相关,结肠癌组织中的 PD-L1表达明显高于癌旁正常组织[31]。
本研究结果显示,枳壳挥发油可显著下调炎症相关结肠癌小鼠结肠组织中 Jagged-1、Notch-1、Hes-1、NF-κB-1、IL-1a、PD-L1和 PD-1 mRNA水平,提示,枳壳挥发油具有调节炎症相关结肠癌小鼠肿瘤炎症微环境及免疫调节的作用,其作用机制可能与Jagged 1-Notch/NF-κB/PD-L1信号通路有关(见图6)。然而,枳壳挥发油具有多种药理作用,其是否还通过其他途径发挥治疗炎症相关结肠肿瘤的作用还需进一步深入研究。
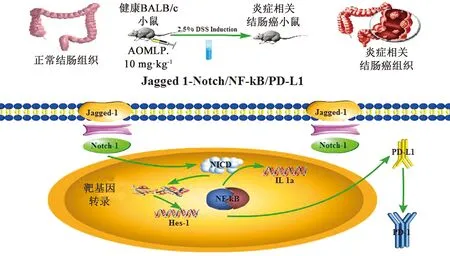
图6 枳壳挥发油调节炎症相关结肠癌小鼠Jagged 1-Notch/NF-κB/PD-L1信号通路
