曲克芦丁片的质量风险监测与评价
2021-08-19于玮洁刘明鹭
于玮洁,刘明鹭
(青岛市食品药品检验研究院,山东 青岛 266071)
曲克芦丁,又名维脑路通或维生素P4,目前曲克芦丁是以芦丁与环氧乙烷为原料,以甲醇与水为介质,在碱催化剂存在下合成的,以三羟乙基芦丁为主,同时含有一羟乙基芦丁、二羟乙基芦丁和四羟乙基芦丁等组分的多组分混合物。曲克芦丁是临床治疗心脑血管疾病的基本药物。我国曲克芦丁制剂于1979 年批准上市,但因其含有较多工艺杂质,很难进一步纯化,造成其在临床使用中的一些风险。不良反应主要有恶心、呕吐、腹痛等消化系统,胸闷、憋气、呼吸困难、呼吸急促等呼吸系统,寒战、发热、水肿、过敏反应、过敏性休克等全身性反应等[1-5]。经国家局网站查询,曲克芦丁片共238个批准文号,涉及232家生产企业,非国家基本药物。国内现行标准为《中国药典》2015年版(二部),EP和BP收载原料药,USP和JP均未收载。
本次为2018年山东省质量风险监测工作,共抽样30批次,覆盖全省4个市,规格均为60 mg,涉及批准文号9个,占总批准文号的3.8%,涉及生产企业9家,占总生产企业的3.9%,抽自生产企业2批,经营企业24批,医疗机构4批。我们按照法定标准进行了检验并进行了统计分析,根据药品质量风险点进行了探索性研究,以期为该品种的质量标准提高与质量监管提供技术支持。
1 法定标准检验
依据《中国药典》2015年版(二部)[6]检验30批次曲克芦丁片,所有项目均符合规定,合格率为100%。
1.1 性状 30批样品合格率为100%。2批次为薄膜衣片,出去包衣后显黄绿色。28批次为糖衣片,除去包衣后显黄绿色。
1.2 鉴别 包括紫外光谱鉴别和液相色谱鉴别两项,30批次样品鉴别结果均符合规定。
1.3 其他组分 按峰面积归一化法计算,除曲克芦丁峰外,单个最大组分峰面积不得大于总峰面积的10.0%,其他单个组分峰面积不得大于总峰面积的5.0%,各组分峰面积的和不得大于总峰面积的20.0%。30批次样品的检验结果均符合规定,合格率100%,30批次样品单个最大组分分布于2.29~6.31%之间,平均值为4.26,极差为4.02;其他单个最大组分检验结果分布于2.01~3.91%之间,平均值为2.87,极差为1.90;各组分的和检验结果分布于10.94~14.46%之间,平均值为13.05,极差为3.52。详见图1。各个生产企业单个最大组分差异较大,根据数据分析单个最大组分为四羟乙基衍生物或二羟乙基衍生物,对抽样量最大的两个生产企业的数据进行了比较,结果两家生产企业批间离散程度均较大,提示企业应重视产品质量的稳定性。
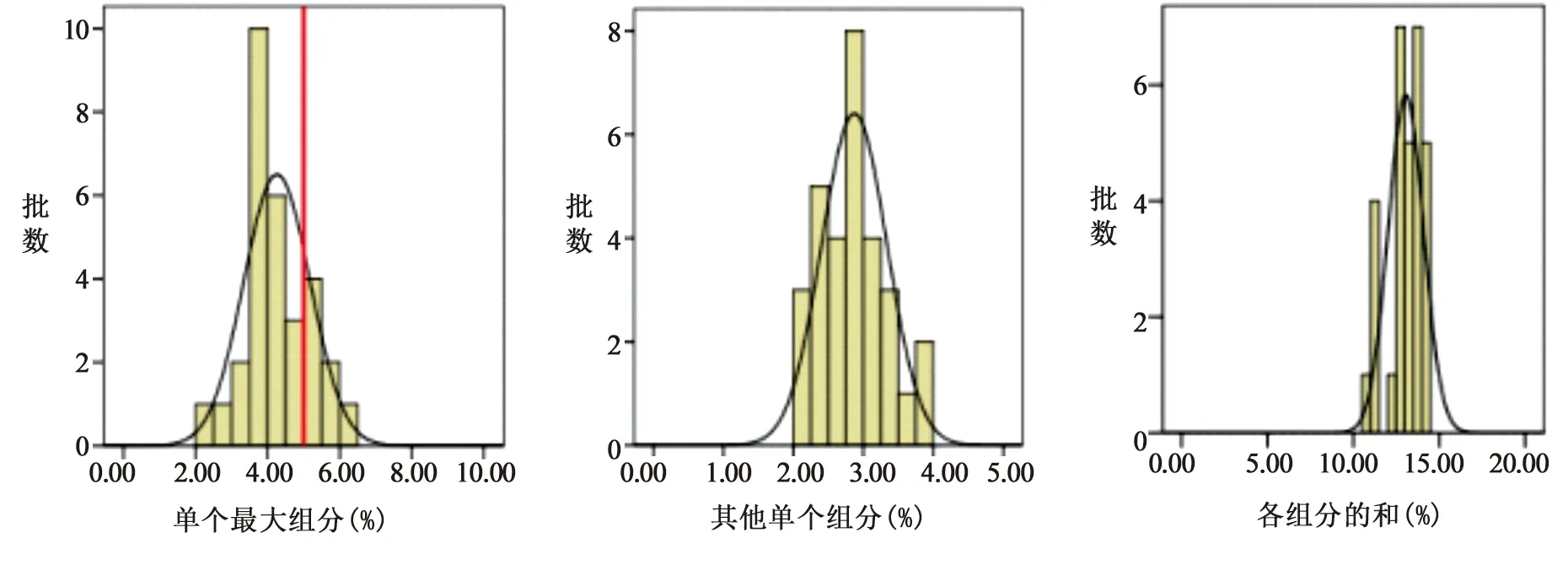
图1 曲克芦丁片其他组分检测结果直方图
1.4 溶出度 现行标准为溶出度与释放度测定法第二法桨法,75 r·min-1,45 min取样,标准规定限度为80%。30批样品溶出度的检验结果均符合规定,合格率100%。详见图2,30批曲克芦丁片溶出度检测结果散点图。虽然结果均符合药典规定,但从图中可以看出,有些厂家和批次6片之间溶出度数据离散程度大,不均匀,且有的低于或者接近80%的限度规定。
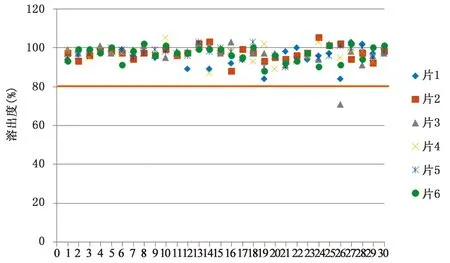
图2 30批曲克芦丁片溶出度检测结果散点图
1.5 重量差异 2批薄膜衣样品重量差异均符合规定,合格率为100%。
1.6 含量测定 含量限度为标示量的90.0%~110.0%。30批样品的含量测定结果均符合规定,合格率100%。详见图3,含量最大值105.1%,最小值96.0%,均值100.09%,呈正态分布(P>0.05)。
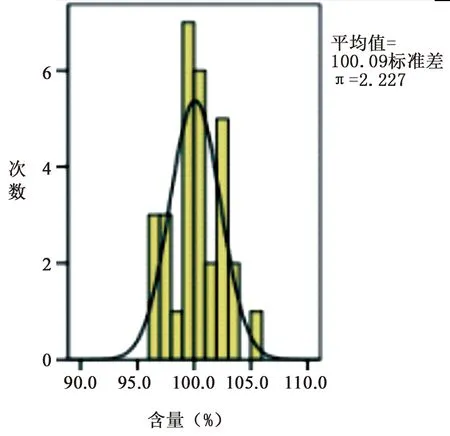
图3 含量测定结果直方图
法定标准检验分析发现存在以下问题:①曲克芦丁片其他组分含量均>10%,检出包括其他组分在内的20多个色谱峰,有关物质是药物安全性的一个重要指标,而现行标准中缺少对有关物质的控制,有待进一步的研究;②溶出度测定中45 min时有的生产企业药物溶出不完全,接近限度,甚至有的未达到限度,为保证药物的疗效,对该品种的溶出行为应进一步的研究。
2 探索性研究
结合法定标准检验的结果和调研情况,针对两个风险点进行了以下探索性研究。
不同放置条件和贮藏条件下草莓裸根苗的生理变化………………………………… 付崇毅,姜 伟,杜金伟,白红梅,薛国萍(99)
2.1 有关物质的研究
2.1.1 试验条件 色谱柱:Agela Venusil MP C18柱(250 mm×4.6 mm,5 μm);检测波长254 nm;流速:0.5 mL·min-1;流动相A:磷酸盐缓冲液(0.1 mol·L-1磷酸二氢钠溶液,用磷酸调pH至4.4);流动相B:乙腈,按表1进行洗脱。
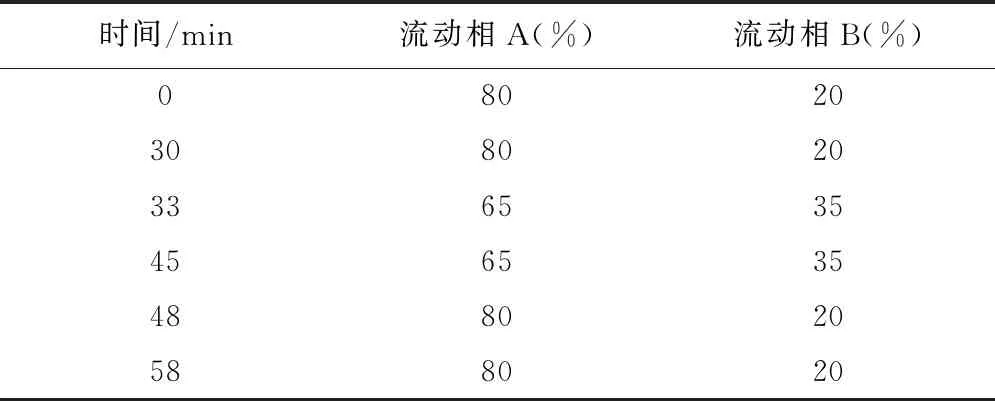
表1 洗脱流程
2.1.2 溶液的配制 供试品溶液:取供试品细粉适量,精密称定,加流动相溶解并稀释制成1 mg·mL-1的溶液。取曲克芦丁系统适用性对照品适量,加流动相溶解并定量稀释制成0.05 mg·mL-1的溶液,作为系统适用性试验溶液。精密量取系统适用性试验溶液10 μL注入液相色谱仪,记录色谱图,结果见图4,曲克芦丁峰的保留时间约为18 min,四羟乙基芦丁峰、一羟乙基芦丁峰、芦丁峰、曲克芦丁峰和二羟乙基芦丁峰的相保留时间分别约为0.5、0.8、0.9、1.0和1.1,上述各峰之间的分离度均符合要求。
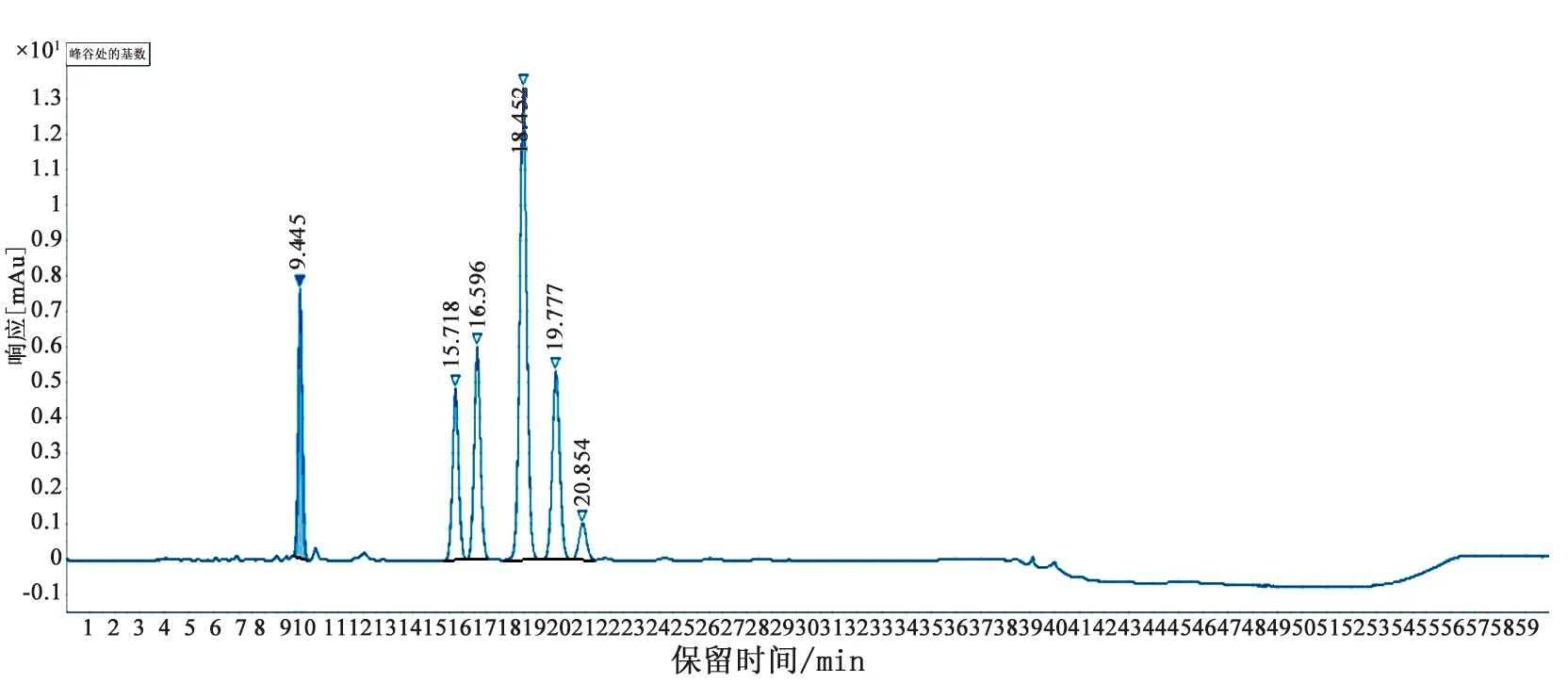
图4 曲克芦丁片有关物质系统适用性图谱
2.1.3 杂质来源的分析与破坏试验 结合相关文献、厂家提供的原料药合成路线以及破坏试验,分析各种杂质的来源及药物的降解途径。曲克芦丁的杂质可分为两种,一是工艺杂质,二是降解杂质。
工艺杂质分析:曲克芦丁原料的合成是以芦丁和环氧乙烷为合成起始物,经过多步反应生成的三羟乙基芦丁。其中间产物有一羟乙基芦丁、二羟乙基芦丁,反应过量会生成四羟乙基芦丁。在合成过程中用到了甲醇、水作为溶剂,以氢氧化钠或三乙胺为催化剂。反应温度和反应时间的控制、原料芦丁的纯度会直接影响最终产品的收率,也直接影响有关物质的生成。分析在该合成反应中可能产生的工艺杂质有芦丁、一羟乙基芦丁、二羟乙基芦丁和四羟乙基芦丁。
降解杂质分析:分别取曲克芦丁原料和样品,精密称定5份,进行酸破坏(加1 mol·L-1盐酸溶液2 mL,室温放置2 h,用1 mol·L-1氢氧化钠溶液2 mL中和)、碱破坏(加1 mol·L-1氢氧化钠溶液2 mL,室温放置2 h,用1 mol·L-1盐酸溶液2 mL中和)、氧化破坏(加30%过氧化氢溶液2 mL,室温放置4 h)、高温破坏(120 ℃放置6 h)、光照破坏(光照放置24 h)。破坏结束后,加流动相制成1 mg·mL-1的供试品溶液。按“2.1.1”项下色谱条件测定。结果曲克芦丁片在酸、碱、氧化、光照、加热等条件下,没有明显的新杂质生成,但各杂质有所增大,各杂质的总和明显增加。酸破坏、光照破坏和加热破坏均导致四羟乙基芦丁增加。
2.1.4 检测限与定量限 取供试品溶液,用流动相稀释至0.5 μg·mL-1的溶液作为灵敏度溶液,计算曲克芦丁的检测限为27 ng·mL-1,定量限为89 ng·mL-1。
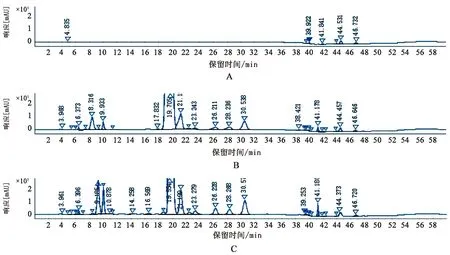
A.空白辅料;B.原料;C.片剂
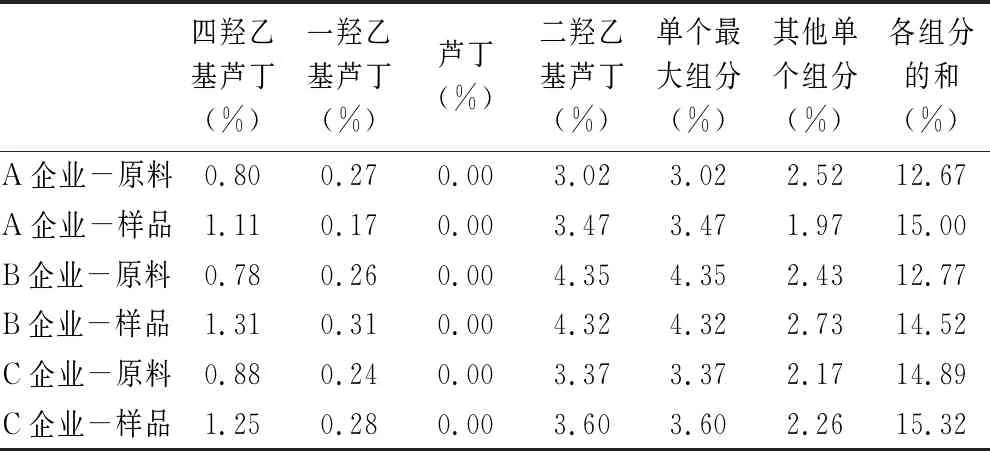
表2 曲克芦丁原料和样品有关物质结果
由典型图谱和表中的结果可见羟乙基芦丁峰主要来源于原料,除三羟乙基芦丁外,其他的羟乙基芦丁的药理活性和毒性目前没有文献报道,且除羟乙基芦丁外,仍有多个较明显杂质,且曲克芦丁片大部分的杂质来源于原料。因此原料质量的好坏直接影响到制剂的质量。曲克芦丁片按照归一化法,其他组分含量均大于10%,检出包括其他组分在内的20多个色谱峰,曲克芦丁的原料是由芦丁与环氧乙烷合成制得,而芦丁为中药提取物,芦丁中杂质的多少直接影响曲克芦丁中杂质的含量,芦丁中多含有槲皮素杂质,在合成曲克芦丁时,槲皮素易与环氧乙烷生成羟乙基槲皮素杂质。因此应从源头控制原料的质量。
2.2 溶出度的研究
2.2.1 试验条件 采用现行标准溶出度的实验方法测定9家生产企业样品在水中的溶出曲线,初步进行曲克芦丁片溶出行为的研究[7-8],评价企业间溶出曲线差异,考察处方及工艺对溶出曲线的影响,更好的评价本品的质量。具体试验条件如下:溶出介质:水900 mL;转速:75 r·min-1;取样时间点:5、10、15、20、30、40、45、60 min。供试品溶液:取续滤液作为供试品溶液;对照品溶液:取曲克芦丁对照品约33 mg,置50 mL量瓶中,加水振摇使溶解,加水稀释至刻度,精密量取5 mL置50 mL量瓶中,用水稀释至刻度,摇匀。
2.2.2 试验结果及分析 本次抽验的曲克芦丁片剂有糖衣和薄膜衣,选取9个生产企业的一批样品,按照上述方法绘制6片平均溶出量的溶出曲线,详见图7和图8。薄膜衣片在20 min 时已基本溶出完全,而糖衣片由于包衣层的崩解过程影响了片芯的溶出,在前10 min 均有明显的溶出时滞,由于各个厂家包衣处方和厚度的不同导致包衣层崩解的速度也不同,从而溶出曲线有较大差异。
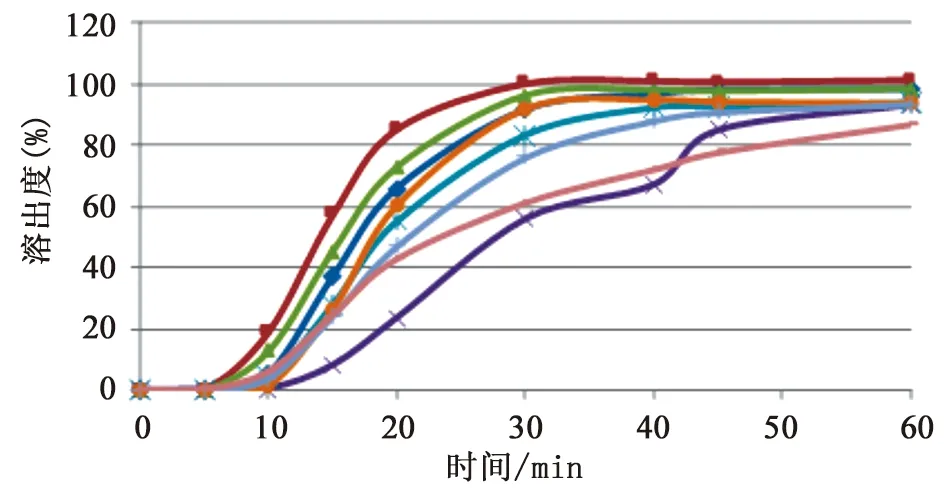
图7 糖衣片样品不同企业平均溶出曲线图

图8 薄膜衣片样品企业平均溶出曲线图
糖衣片样品包衣材料溶解缓慢,造成片芯溶出迟滞。9家生产企业样品在水中的溶出曲线差异较大,有的属于“突释”,有的属于“缓释”,还有介于两者之间。试验中发现溶出均匀性差并不是个别现象,有两家生产企业的曲克芦丁片存在包衣溶解不佳的情况,影响药物的溶出。因此将这两个企业所抽样品均进行了溶出曲线的考察,详见图9和图10。两家生产企业不同批号的样品溶出曲线差距较大,其中观察D企业样品的溶出过程,发现1批样品的糖衣在15 min时仍未溶解,只是从中间裂开,片芯由中间裂开的缝中溶解,直至60 min,仍有大片的包衣,严重影响了片芯的溶出,但另一批号样品的溶出过程未发现此现象,怀疑包衣的处方或工艺有所更改;C企业不同批号样品的溶出曲线差距较大,提示企业生产工艺中存在不合理因素,影响药物的溶出均匀性,生产企业应关注制粒工艺、片剂的硬度等各项参数的合理性,进一步提升企业产品质量,保证药物疗效稳定性。
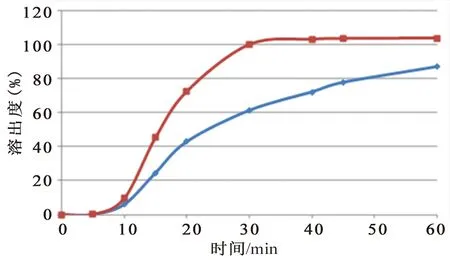
图9 D企业样品的溶出曲线
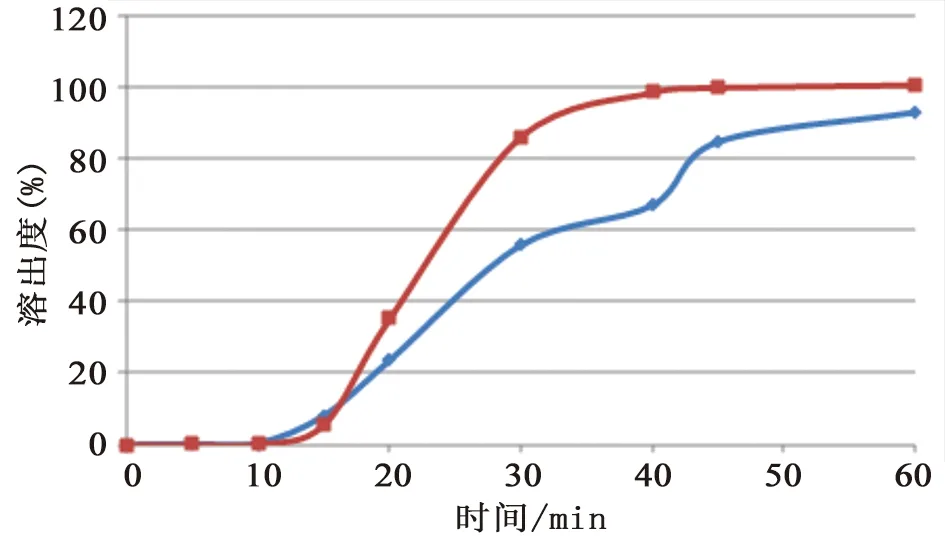
图10 C企业样品的溶出曲线
3 影响本品质量主要因素分析
3.1 曲克芦丁原料质量的好坏直接关系到制剂的质量。应从源头控制原料的选择。
3.2 不同企业糖衣的处方和厚度也各不相同,糖衣溶解的快慢直接影响到片芯的溶出。
3.3 生产工艺中存在不稳定因素,导致了药物的溶出均一性差。
4 分析及建议
风险点1:曲克芦丁片在同一溶出度标准下,制剂质量差异较大,同一生产企业药物的溶出均匀性差,影响临床有效性。建议对该品种进行溶出度一致性评价,淘汰质量低劣的产品。
风险点2:曲克芦丁原料中的未知杂质及其他羟乙基芦丁的含量,直接影响曲克芦丁制剂的有关物质,因此,建议生产企业精选原料曲克芦丁,或者通过反应时间以及催化剂的选择等因素来改进原料的合成工艺,从而降低原料及制剂中的杂质。
