白藜芦醇对乌头碱诱发大鼠心律失常的预防作用及其可能机制▲
2021-08-18李志坤王希柱宋巧凤
李志坤 王希柱 宋巧凤
(河北省唐山市人民医院心电图室,唐山市 063000,电子邮箱:mia55462@163.com)
心律失常是临床常见病和高发病,心肌缺血及缺血后再灌注等多种心脏疾病均可引起心律失常,主要表现为期前收缩、房颤、心动过速等[1]。心律失常可增加疾病治疗难度,尤其是发生恶性心律失常的患者,心源性猝死风险明显增加[2-3]。因此,寻找有效药物对抗心律失常并探讨其调控机制,对心律失常的防治有重要临床意义。白藜芦醇(resveratrol,Res)属于多酚类化合物,广泛存在于葡萄皮和花生中,具有抗炎、抗动脉粥样硬化等多种生物学作用,临床常用于防治血脂异常、冠心病等疾病[4-5]。Res在心血管疾病的防治中有潜在应用价值,但关于其对心律失常的防治作用鲜有研究报道。鉴于此,本研究通过建立乌头碱诱发的心律失常大鼠模型,观察Res对大鼠心律失常及心电图的影响,并进一步探讨其影响机制,为临床防治心律失常提供参考。
1 材料与方法
1.1 材料
1.1.1 实验动物:80只无特定病原体级雄性Wistar大鼠,7周龄,体质量180~220 g,购自北京维通利华实验动物技术有限公司,生产许可证号:SCXK(京)2016-0011。大鼠自由进食和饮水,饲养于(25±1)℃、60%相对湿度、12 h明暗交替环境。
1.1.2 主要试剂和仪器:乌头碱、Res(美国Sigma公司),沉默信息调节因子2相关酶1(silent information regulator 2 related enzyme 1,SIRT1)特异性抑制剂EX-527(英国Tocris Bioscience公司),二喹啉甲酸蛋白定量分析试剂盒(美国Thermo Fisher Scientific公司),兔抗大鼠SIRT1、腺苷酸活化蛋白激酶(adenosine monophosphate-activated protein kinase,AMPK)、磷酸化AMPK(phosphorylated AMPK,p-AMPK)、过氧化物酶体增殖物激活受体γ辅助激活因子1α(peroxisome proliferator-activated receptor γ coactivator 1α,PGC-1α)、β-肌动蛋白(β-actin)一抗(美国Abcam公司,货号ab8277、ab273598、ab32112、ab54481、ab8227),辣根过氧化物酶标记的山羊抗兔IgG二抗(北京索莱宝科技有限公司,货号SA134)。XD-7100型心电图仪(上海医用电子仪器厂),CheniDoc XRS化学发光成像分析系统(Bio-Rad公司)。
1.2 分组及干预 按体重大小连续编号,采用随机数字表法将80只大鼠分为模型组、模型+Res组、模型+Res+EX-527组、对照组,每组各20只。干预方法:(1)模型+Res组,按照100 mg/kg给予Res灌胃(Res溶于5%羧甲基纤维素钠,Res的最终浓度为10 mg/mL),1次/d,连续2周;末次灌胃30 min后,使用乌头碱诱发心律失常。(2)模型+Res+EX-527组,按照100 mg/kg给予Res灌胃,30 min后给予EX-527 10 mg/kg体质量腹腔注射给药,1次/d,连续2周;末次灌胃30 min后,使用乌头碱诱发心律失常。(3)模型组:按照10 mL/kg给予5%羧甲基纤维素钠灌胃,1次/d,连续2周;末次灌胃后,使用乌头碱诱发心律失常。(4)对照组:按照10 mL/kg给予5%羧甲基纤维素钠灌胃,1次/d,连续2周;末次灌胃后,按1 mL/kg体质量舌下静脉注射生理盐水。
1.3 乌头碱诱发大鼠心律失常模型的建立及鉴定 腹腔注射1%戊巴比妥钠(6 mL/kg)麻醉大鼠后,取仰卧位固定,连接心电图仪,将针状电极插入四肢末端及剑突皮下,麻醉后连续监测心电图5 min,模型组、模型+Res组、模型+Res+EX-527组大鼠按1 mL/kg体质量舌下静脉注射质量分数为0.002%的乌头碱(对照组舌下注射等量生理盐水),4 min内标准Ⅱ导联检测心电图出现室性心动过速、心室颤动等波形时,判定为模型制备成功。60只舌下注射乌头碱的大鼠中,共死亡14只,予以剔除,最终模型组14只、模型+Res组17只、模型+Res+EX-527组15只进行后续实验,对照组20只全部存活,进入后续实验。
1.4 心电图监测及心律失常评分 (1)心电图监测:记录发生心律失常的大鼠数量,心律失常开始时间(即舌下静脉注射后至出现心律失常异常波形的时间);记录完成舌下注射乌头碱后4 min内标准Ⅱ导联检测心电图中的Q-T间期、P-R间期、QRS波群时间;记录麻醉前、造模后即刻(完成舌下注射乌头碱后)以及造模后15 min、30 min、60 min时各组大鼠心率。(2)心律失常评分[6]:根据舌下注射乌头碱后4 min内标准Ⅱ导联检测的心电图情况进行评分。0分为无心律失常;1分为室性心动过速或心室颤动等心律失常异常波持续时间短于10 s;2分为心律失常异常波持续时间11~30 s;3分为心律失常异常波持续时间31~90 s;4分为心律失常异常波持续时间91~180 s和可逆心室颤动波持续时间短于10 s;5分为心律失常异常波持续时间长于180 s和可逆心室颤动波持续时间长于10 s;6分为出现不可逆性心室颤动波。
1.5 组织取材及保存 造模60 min后,处死各组大鼠,剖开胸腔暴露心脏,各组采用随机数字表法取7只,采用预冷生理盐水灌注心脏,灌注液清亮后,用4%多聚甲醛继续灌注,结束后立即取心脏组织,保存于4%多聚甲醛中备用。各组另取7只仅灌注生理盐水,取心肌组织保存于-80℃备用。
1.6 心肌组织病理学观察 取固定于4%多聚甲醛中的心肌组织,经脱水、透明后,常规石蜡包埋,制备厚度为5 μm的连续切片;切片经脱蜡、梯度乙醇水化后,进行常规苏木精-伊红(hematoxylin-eosin,HE)染色,最后中性树胶封片,于光学显微镜下观察心肌组织病理学变化。
1.7 心肌组织中SIRT1、AMPK、p-AMPK、PGC1α蛋白的检测 取保存于-80℃的心肌组织75 mg,加入液氮制成冻干粉,加入1 mL蛋白裂解液,4℃静置孵育20 min,4℃预冷离心机12 000 r/min离心15 min(离心半径12 cm),取上清液,采用二喹啉甲酸法进行蛋白定量。取30 μg蛋白样品与等量上样缓冲液混匀,沸水浴变性8~10 min,12 000 r/min离心15 min(离心半径12 cm),取上清液,进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(10%分离胶、5%浓缩胶),湿转法将分离蛋白转移至硝酸纤维素膜上,TBST洗膜后封闭液封闭2 h;加入稀释一抗[SIRT1、AMPK、p-AMPK(1 ∶500),PGC1α、β-actin(1 ∶1 000)],4℃孵育过夜;TBST洗涤后加入稀释二抗(1 ∶5 000),常温孵育2 h,暗室中曝光显影。以目的条带平均光密度值与β-actin光密度值的比值表示蛋白相对表达量。
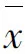
2 结 果
2.1 3个模型组大鼠心律失常发生情况及心律失常评分的比较 与模型组比较,模型+Res组室性心动过速、心室颤动的发生率降低,室性心动过速、心室颤动开始时间延迟,心律失常评分降低(均P<0.05);与模型+Res组比较,模型+Res+EX-527组室性心动过速、心室颤动开始时间提前,心律失常评分升高(均P<0.05)。见表1。
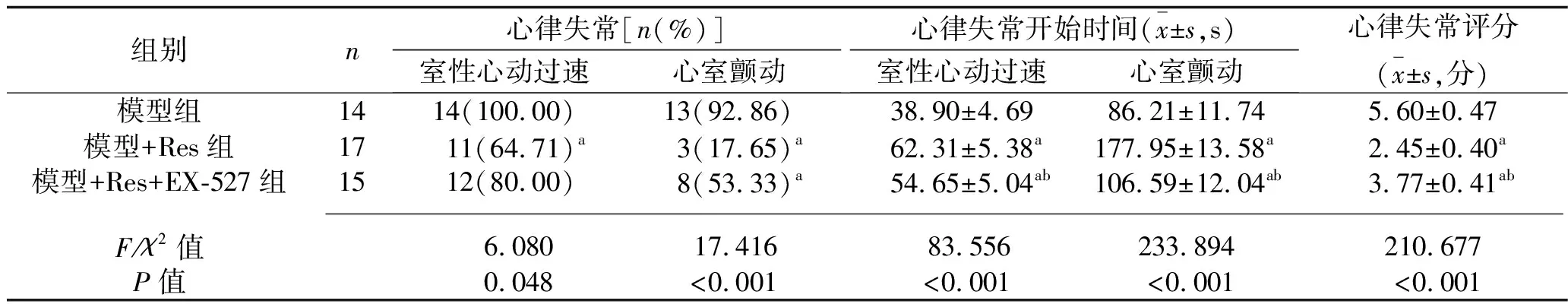
表1 心律失常发生率、开始时间及心律失常评分的比较
2.2 4组大鼠心电图监测指标变化 与对照组比较,其他3组Q-T间期、P-R间期延长,QRS波群增宽(P<0.05);与模型组比较,模型+Res组Q-T间期、P-R间期缩短,QRS波群缩窄(P<0.05);与模型+Res组比较,模型+Res+EX-527组Q-T间期、P-R间期延长,QRS波群增宽(P<0.05)。见表2。
表2 4组大鼠心电图监测指标的比较(±s,ms)
2.3 4组大鼠干预期间心率变化 4组间心率差异有统计学意义(F组间=11.200,P组间<0.001),其中与对照组比较,其他3组造模后即刻、造模后15 min、30 min、60 min心率均升高(均P<0.05);模型+Res组造模后15 min、30 min、60 min心率均低于模型组(均P<0.05);模型+Res+EX-527组造模15 min、30 min、60 min心率均高于模型+Res组(均P<0.05)。心率有随时间变化的趋势(F时间=56.137,P时间<0.001),其中模型组、模型+Res组、模型+Res+EX-527组造模各时间点心率均高于麻醉前的心率(均P<0.05);随造模时间的延长,模型+Res组心率逐渐降低(P<0.05),而模型组、模型+Res+EX-527组无明显变化(P>0.05)。组间与时间存在交互效应(F交互=40.216,P交互<0.001)。见表3。
表3 4组大鼠干预期间心率变化(±s,次/min)
2.4 4组大鼠心肌组织病理学改变 HE染色结果显示,对照组心肌结构清晰,横纹排列整齐,细胞核完整;模型组可见片状心肌嗜伊红染色增强,且呈波浪样变,偶见间质出血;模型+Res组心肌呈波浪样变,少量点状心肌嗜伊红染色增强;模型+Res+EX-527组心肌组织病变较模型+Res组加重。见图1。
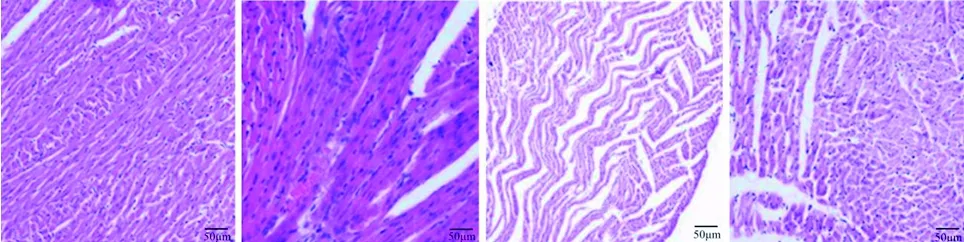
对照组 模型组 模型+Res组 模型+Res+EX-527组
2.5 4组大鼠心肌组织中SIRT1、AMPK、p-AMPK、PGC1α蛋白表达量的比较 4组AMPK蛋白相对表达量差异无统计学意义(P>0.05)。与对照组比较,其他3组SIRT1、p-AMPK、PGC1α蛋白相对表达量均降低(P<0.05);与模型组比较,模型+Res组SIRT1、p-AMPK、PGC1α蛋白相对表达量均升高(P<0.05);与模型+Res组比较,模型+Res+EX-527组SIRT1、p-AMPK、PGC1α蛋白相对表达量均降低(均P<0.05)。见图2、表4。

图2 4组大鼠心肌组织各蛋白的表达情况
表4 4组大鼠SIRT1、AMPK、p-AMPK、PGC1α蛋白相对表达量的比较(±s)
3 讨 论
心律失常发生机制十分复杂,多源于心脏自律异常或激动传导障碍,可单独发病也可伴发其他心血管疾病,该病患者心肌受损严重,且心源性猝死发生率明显增高,生命健康受到严重影响[7]。目前,临床尚缺乏有效的抗心律失常西药,且西药副作用多,临床应用的局限性强[8]。研究显示,室性心律失常发病机制与多种离子通道功能障碍有关,乌头碱中毒引发的心律失常可促进心肌细胞钠离子内流及膜去极化,同时可诱发多源性异位节律点,从而诱发心律失常的发生[9]。有关抗心律失常的研究表明,中药具有改善多离子通道功能异常的作用[10],故寻找有效中药对抗心律失常有重要意义。
心电图是临床诊断心律失常的主要方法,本研究应用舌下注射乌头碱法诱发大鼠心律失常,心电图显示模型组室性心动过速发生率为100%,心室颤动发生率高于90%,造模后心率明显升高,Q-T间期、P-R间期延长,QRS波群增宽,造模60 min后HE染色提示片状心肌嗜伊红染色增强,且呈波浪样变,偶见间质出血,说明成功建立心律失常大鼠模型。Res是从自然界植物中提取的天然活性成分,在自然界中分布广泛,具有潜在药用价值。近年有研究显示,Res与心脏疾病、炎症、糖脂代谢异常及肿瘤等多种疾病的防治均有密切联系[11]。姜晓晓等[12]在研究Res对心肌梗死大鼠心脏神经重塑过程中发现,Res可有效预防室性心律失常及心源性猝死,与王光宇等[13]针对Res对心肌梗死后心律失常影响的研究结果相似。本研究应用Res干预后再采用乌头碱诱发心律失常,结果显示,与模型组比较,模型+Res组室性心动过速、心室颤动发生率降低,室性心动过速、心室颤动开始时间延迟,心律失常评分降低,造模15 min及以后心率降低,Q-T间期、P-R间期缩短,QRS波群缩窄,HE染色提示心肌组织病变减轻,这提示Res具有对抗乌头碱诱发心律失常的作用。
SIRT1是在哺乳动物体内发现的烟酰胺腺嘌呤二核苷酸依赖的脱乙酰化酶,与细胞能量代谢、细胞衰老、基因转录等多种生物学过程关系紧密[14]。AMPK是细胞能量代谢的关键因子,可通过调控细胞凋亡、蛋白降解等过程维持细胞能量供需平衡。在能量限制或运动等应激状态下,AMPK激活SIRT1,延长细胞衰老过程[15]。PGC1α是SIRT1去乙酰化底物,应激状态下细胞的能量代谢异常可使SIRT1去乙酰化水平改变,从而导致PGC1α转录活性相应地发生改变[16]。Kim等[17]的研究显示,斑马鱼SIRT1基因敲除后,由于缺乏完整能量代谢系统导致斑马鱼对环境适应能力降低,寿命缩短。Ma等[18]研究发现,SIRT1基因敲除的小鼠可表现出糖尿病性心肌病症状,机体线粒体能量代谢功能异常,应用Res可激活SIRT1-AMPK-PGC1α信号通路,改善心肌损伤。上述研究均说明SIRT1-AMPK-PGC1α信号通路在心肌组织能量代谢途径中发挥重要的调节作用,但目前尚无研究证实Res是否通过该信号通路发挥心律失常保护作用。本研究应用Res预防性干预后,SIRT1、p-AMPK、PGC1α蛋白相对表达量均升高,提示Res可激活SIRT1-AMPK-PGC1α信号通路;进一步应用SIRT1特异性抑制剂干预后,SIRT1-AMPK-PGC1α信号通路相关蛋白表达下调,且大鼠心率、心电图监测指标及心肌组织病变均较模型+Res组变差,说明Res可能通过激活SIRT1-AMPK-PGC1α信号通路发挥对抗乌头碱诱发的大鼠心律失常的作用。
综上所述,Res可明显对抗乌头碱诱发的大鼠心律失常,其机制可能与激活SIRT1-AMPK-PGC1α信号通路有关。本研究的结果或可为Res相关药物的研发和应用提供参考,同时为心律失常的临床防治提供新的治疗靶点。在下一步的研究中应深入探讨Res对SIRT1-AMPK-PGC1α信号通路的直接调控机制及下游作用靶点,以提供更充分的证据支持本研究结论。
