异功散对哮喘小鼠气道炎症反应和肠道菌群的影响
2021-08-11梁燕妮欧阳学认廖永州
梁燕妮 欧阳学认 廖永州
摘要 目的:研究异功散对支气管哮喘小鼠气道炎症反应的抑制及其对肠道菌群结构的调节作用。方法:将无特定病原体(SPF)级雄性小鼠随机分为空白对照组、模型组、异功散组和西药组,每组10只。通过抗生素诱导、致敏和雾化激发建立肠道菌群紊乱的哮喘小鼠模型。观察小鼠一般情况、肺组织病理变化,对各组小鼠粪便进行16S rRNA测序并分析治疗前后肠道菌群的变化。结果:1)异功散组和西药组的哮喘小鼠的生理状态、哮喘症状较模型组明显好转;2)与模型组比较,异功散组和西药组小鼠肺组织炎症反应得到明显改善;3)与空白对照组比较,模型组的Chao1指數显著降低(P<0.01);与模型组比较,异功散组和西药组的Chao1指数明显回升(P<0.05)。与模型组比较,异功散组的拟普雷沃菌属和普雷沃菌属的比例明显回升,而乳杆菌属和拟杆菌属的比例下降。结论:异功散改善哮喘小鼠的症状和气道炎症反应的作用可能与其恢复肠道菌群的丰富度和多样性以及调节菌群结构的平衡有关。
关键词 异功散;哮喘;脾胃虚弱;气道;炎症反应;肠道菌群;16S rRNA测序
Abstract Objective:To study the inhibitory effect of Yi Gong Powder on airway inflammation in bronchial asthma mice and its regulation on the structure of intestinal flora.Methods:SPF grade male mice were randomly divided into a blank control group,a model group,a Yi Gong Powder group and a Western medicine group,with 10 in each group.A mouse model of asthma with intestinal flora disorder was established through antibiotic induction,sensitization and nebulization.The general condition of mice and the pathological changes of lung tissues were observed.The feces of each group of mice were sequenced by 16S rRNA and the changes of intestinal flora before and after treatment were analyzed.Results:1)The physiological status and asthma symptoms of asthma mice in Yi Gong Powder group(Y)and Western medicine group were better than those in model group.2)Compared with the model group,the lung tissue inflammation of the Yi Gong Powder group and the Western medicine group was significantly improved.3)16S rRNA sequencing results showed that:compared with the blank control group,the Chao1 index of the model group was significantly reduced(P<0.01); compared with the model group,the Chao1 index of the Yi Gong Powder group increased significantly(P<0.05).At the genus level of the bacterial group structure,compared with the model group(M),the proportion of Alloprevotella and Prevotella in the Yi Gong Powder group increased significantly,but there was a certain gap from blank control group,while the proportion of Lactobacillus and Bacteroides has declined.Conclusion:The effects of Yi Gong Powder on improving the symptoms and airway inflammation in asthmatic mice may be related to restoring the richness and diversity of intestinal flora and regulating the balance of flora structure.
Keywords Yi Gong Powder; Asthmatic; Spleen and stomach weakness; Airway; Inflammatory reaction; Intestinal flora; 16S rRNA sequencing
中图分类号:R256.12;R562.2+5文献标识码:Adoi:10.3969/j.issn.1673-7202.2021.10.007
支气管哮喘(以下简称哮喘)是一种以慢性气道炎症反应和气道高反应性为特征的异质性疾病[1]。近20年来我国儿童哮喘的患病率呈显著上升趋势,且总体上以学龄前儿童最高[2]。哮喘对儿童的生活、学习甚至生命带来严重的危害,如何更有效的防治哮喘一直是亟待解决的问题。有证据表明,微生物群在宿主的肠黏膜和免疫系统的发育中发挥着不可或缺的作用[3],而大量服用抗生素的婴幼儿在菌群结构遭到破坏的同时也增加了患哮喘疾病的风险[4]。近年来,肠道菌群与哮喘等过敏性疾病的关系成为研究热点。
从中医“整体观念”的角度出发,肠道微生态的组成、结构多样性和菌群代谢状态的平衡与稳定是维持“脾主运化”正常功能状态的重要因素[5-6]。在某种情况下这种平衡和稳定一旦被破坏,就会出现脾胃功能的失调,如脾胃虚弱导致“脾主运化”功能减弱,津液疏布失常而酿生痰浊。中医认为哮病以宿痰伏于肺为主因,而脾胃虚弱则是贯穿哮喘病发作期与缓解期总病程的核心病机[7],故中医对哮喘的治疗应注意培补中焦,而异功散是健脾益气的代表方剂之一。本实验拟探讨异功散对哮喘小鼠气道炎症反应的抑制及肠道菌群的调节作用,为中医药防治哮喘提供理论和实验依据。
1 材料与方法
1.1 材料
1.1.1 动物 选取无特定病原体(SPF)级健康雄性BALB/C小鼠40只,3周龄,体质量(13±3)g,由广东省医学实验动物中心提供,许可证号:SCXK(粤)2018-0002。本实验对动物的处理符合动物伦理学要求(伦理审批号:20190611028)。喂养于广州中医药大学第一附属医院动物实验中心,温度为22~23 ℃,湿度为60%~70%,每天光照与黑夜各12 h交替。
1.1.2 药物 异功散按《小儿药证直诀》所载原方比例:人参、茯苓、白术、陈皮、甘草各10 g。中药均由广州中医药大学第一附属医院中药房提供,制成水煎剂,并配成含生药约1 g/mL的溶液,充分搅匀,贮于4 ℃冰箱备用[8]。卵清蛋白(OVA)(上海麦克林生化科技有限公司,生产批号:A800616),Al(OH)3(上海麦克林生化科技有限公司,生产批号:A800852),常乐康胶囊(酪酸梭菌二联活菌散)(山东科兴生物制品有限公司,国药准字S20020015),头孢哌酮坦盐钠(上海麦克林生化科技有限公司,国药准字S838445)。
1.1.3 试剂与仪器 电子天平称(杭州万特衡器有限公司,型号:WT型);冰冻切片机(Thermo Scientific公司,美国,型号:CryoStar NX50);生物显微镜(Nikon公司,日本,型号:55i);彩色图像分析系统(Media Cybernetics公司,美国,型号:Image-Pro Plus7);超低温冰箱(海尔公司,型号:DW-86L626);小动物超声雾化器[欧姆龙自动化(中国)有限公司,型号:NE-C28P]。
1.2 方法
1.2.1 分组与模型制备 采用简单随机分配法,将小鼠分为空白对照组、模型组、异功散组和西药组,每组10只。哮喘小鼠模型的建立[9]:适应性喂养3 d结束后(第0天),给予BALB/C小鼠0.5 g/L的头孢哌酮水溶液,自由饮用,连续5 d。第6天将头孢哌酮水换成无菌水。分别于第0天和第7天在小鼠双侧胸部、腹股沟4部位各皮下注射0.15 mL配置好的卵清蛋白(OVA)凝胶致敏剂(将OVA 1 mg和氢氧化铝200 mg溶于生理盐水1 mL中配制而成),同时腹腔注射0.4 mL,共计1 mL进行致敏。第14天开始将小鼠置于25 cm×20 cm×20 cm有机玻璃盒内,超声雾化吸入1%OVA诱发哮喘,1次/d,30 min/次,连续5 d。当小鼠出现呛咳、呼吸困难、躁动不安、活动量下降等症状时表示哮喘激发成功。
1.2.2 给药方法 第20天开始给药干预,异功散组以每次10 mL/kg的给药量经口灌服;西药组灌服常乐康0.4 mL[10],同时给予布地奈德2 mL+生理盐水2 mL雾化15 min;模型组及空白对照组均灌服生理盐水。以上各组给药均为1次/d,连续1周,疗程结束24 h后处死小鼠取材。
1.2.3 标本采集 采用颈椎脱臼法处死小鼠,沿正中线由下而上剪开胸腔,逐层游离、暴露肺组织。摘取左肺组织,将其放入4%多聚甲醛溶液。同时每组随机挑选5只小鼠的結肠粪便,收集至无菌EP管,并于液氮中保存。
1.2.4 指标检测与方法 1)观察各组小鼠的精神状态、纳食、大小便、呼吸、毛发形体、姿态、活动及体质量等一般情况。2)肺和支气管组织形态学变化:左肺组织用4%多聚甲醛固定,石蜡包埋并切片,进行苏木精-伊红染色(HE染色),镜下观察各组小鼠支气管形态和平滑肌损伤情况,炎性细胞浸润情况以及管腔内是否有渗出物等。3)16S rRNA测序:小鼠粪便样本由上海锐翌生物科技有限公司进行肠道菌群检测。提取20个粪便样本的DNA,并进行质检。16S rRNA扩增选择区域为V3-V4区,使用的通用引物为341F和806R。在通用引物的5′端加上适合Illumina Miseq PE250测序的index序列和接头序列,完成特异性引物的设计。forward primer(5′-3′):CCTACGGGRSGCAGCAG(341F)reverse primer(5′-3′):GGACTACVVGGGTATCTAATC(806R)。对样本中的DNA进行PCR扩增和产物纯化、PCR产物定量和均一化,最后使用Illumina Miseq PE250进行上机测序。
1.3 统计学方法
采用SPSS 25.0统计软件进行数据分析,所有数据以均数±标准差(±s)表示,数据符合正态分布且方差齐时采用单因素方差分析,否则用秩和检验,以P<0.05为差异有统计学意义。
2 结果
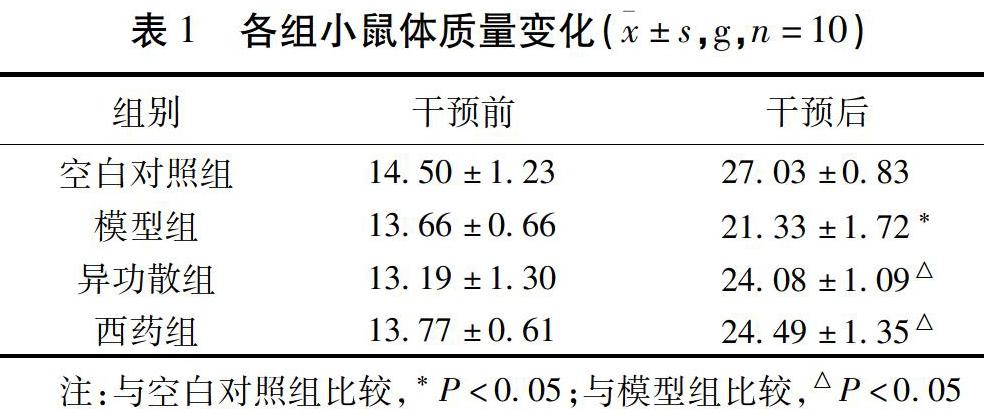
2.1 各组小鼠体质量变化及一般状况
造模前,各组小鼠反应正常。除空白对照组外,其余组小鼠在造模过程中,给予OVA雾化激发后小鼠出现呼吸急促,躁动不安,弓背,蜷缩,搔抓面部,纳食、活动减少,毛发无光泽及体质量下降等情况。与模型组比较,给予异功散和西药干预后,小鼠精神较前好转,毛发相对更有光泽,纳食、活动增多,体质量也明显增加,差异有统计学意义(P<0.05)。
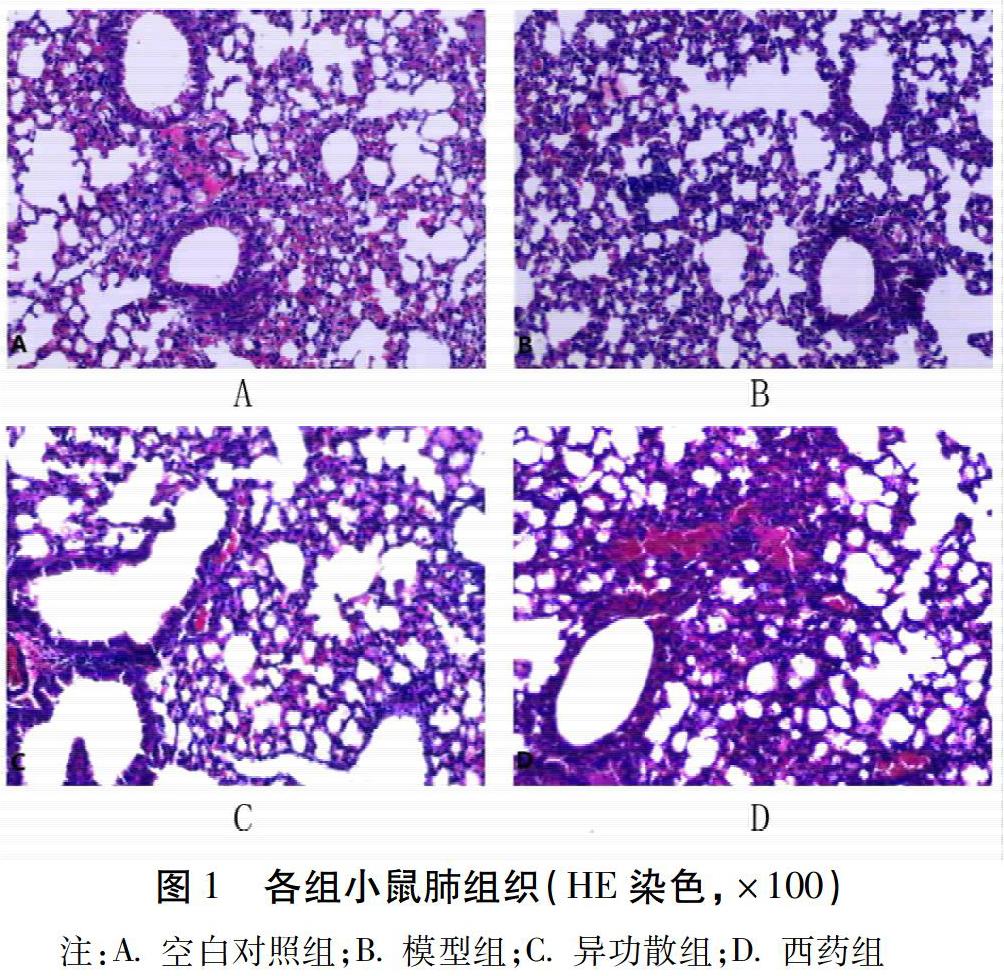
2.2 肺部病理学指标
空白对照组小鼠的肺组织支气管、肺泡结构清晰,未见炎症反应细胞;模型组小鼠支气管周围灶状慢性炎症细胞浸润、支气管上皮细胞鳞状化生,偶见上皮细胞脱落,肺泡间隔中度增厚,增厚程度为正常厚度的3~5倍;异功散组和西药组支气管周围未见明显炎症细胞浸润,支气管上皮细胞未见鳞状化生及脱落,大部分区域肺泡间隔未见增厚,局部肺泡间隔轻度增厚,肺泡腔内未见巨噬细胞。见图1。
2.3 异功散对小鼠肠道菌群结构的影响
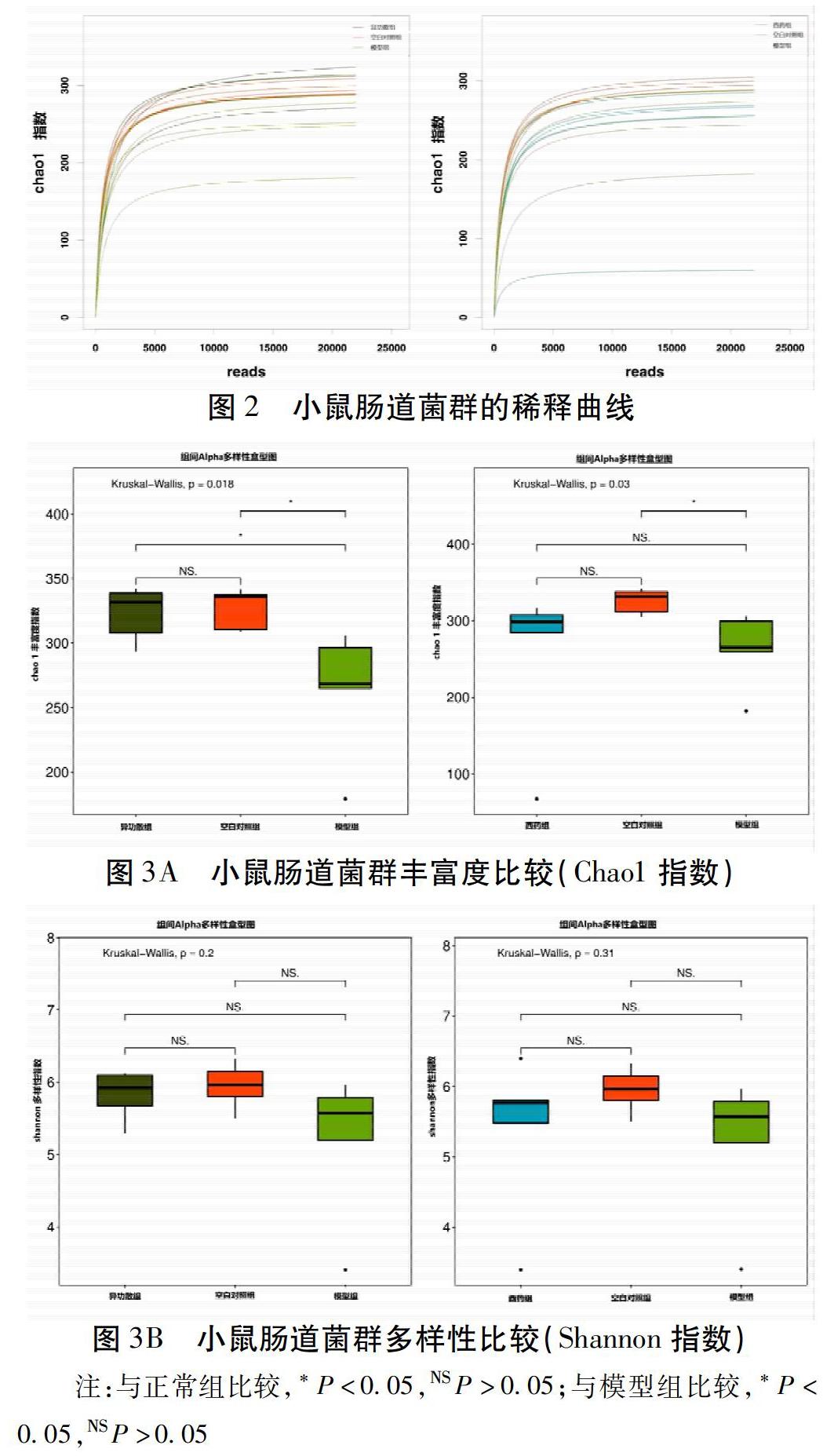
2.3.1 物种Alpha多样性指数分析 本实验收集了空白对照组、模型组、异功散组和西药组各5只小鼠的粪便标本。根据16S rRNA测序结果绘制稀释曲线如图2,曲线趋向于平坦,表明测序量基本覆盖样品中所有物种,测序深度达到要求,可满足分析需求。根据小鼠肠道菌群的Chao1丰富度指数和Shannon多样性指数绘制图3A、3B。图中显示:1)与空白对照组比较,模型组的Chao1指数显著降低,差异有统计学意义(P<0.01);给予异功散和西药干预之后Chao1指数明显回升,且异功散组与模型组比较差异有统计学意义(P<0.05)。2)与空白对照组比较,模型组的Shannon指数有所下降,给予异功散和西药干预后Shannon指数有一定程度的上升,但4组的差异无统计学意义。
2.3.2 物种Beta多样性指数分析 各组小鼠肠道菌群的差异可通过绘制PCoA主成分分析图(图4)表示,其中相同颜色的点的距离越近说明其菌群的构成越相似。空白对照组、模型组与异功散组的样品距离远,各组的菌群构成存在明显差异;而西药组与空白对照组和模型组的距离较近,其群落差异较小。
2.3.3 物种菌群结构分析 从图5中可发现,与空白对照组比较,模型组的拟普雷沃菌属(Alloprevotella)的比例显著降低,普雷沃菌属(Prevotella)的比例也有所下降,而乳杆菌属(Lactobacillus)和拟杆菌属(Bacteroides)的比例明显上升。与模型组比较,给予药物干预后,异功散组的拟普雷沃菌属(Alloprevotella)和普雷沃菌属(Prevotella)的比例明显回升,但与正常组有一定差距,而乳杆菌属(Lactobacillus)和拟杆菌属(Bacteroides)的比例下降;西药组的乳杆菌属(Lactobacillus)和嗜黏蛋白-艾克曼菌属(Akkermansia)的比例明显增加。
3 讨论
目前,儿童支气管哮喘的研究取得了一定的进展,虽然其发病机制尚未完全清楚,但可以肯定的是哮喘的发生发展与免疫有关。Russell等[11]发现围产期及新生小鼠经抗生素处理后其过敏性哮喘的检测指标增加的同时,肠道细菌菌群的组成也发生了显著变化,说明小鼠发生哮喘的危险性增加可能与抗生素的使用改变了其肠道菌群结构有关。这与Ahmadizar等[12]的研究结果相似,即生命早期接触抗生素会增加成长后期出现过敏性哮喘的风险。而有研究证实,肠道黏膜远端部位的微生物群可以调节宿主的全身性免疫反应,从而有助于减少致敏和过敏性炎症反应[13-14]。
本实验在造模前期选用抗生素头孢哌酮诱导小鼠肠道菌群紊乱,并通过卵清蛋白(OVA)致敏、雾化激发,使小鼠出现呼吸急促,躁动不安,弓背,蜷缩,纳食、活动减少等哮喘发作症状,根据模型组小鼠的肺组织病理和肠道菌群与空白对照组的差异有统计学意义,判定肠道菌群紊乱的哮喘小鼠模型成功建立。给予药物干预后,与模型组比较,异功散组和西药组小鼠的哮喘症状明显缓解,体质量明显增加(P<0.05),并且肺组织炎症反应得到明显改善,表明异功散在哮喘的治疗中有较好的疗效,这与既往的研究结果相一致[8]。
肠道微生态的结构变化不仅可以反映机体健康状况,而且与哮喘等过敏性疾病的发生发展有一定的关系。李春燕等[15]以哮喘急性发作期患者开展病例对照研究,结果提示,哮喘患者的肠道菌群发生了明显改变,表现为多样性明显降低,结构改变、失衡。在本实验中,与空白对照组比较,模型组小鼠肠道菌群的Chao1丰富度指数显著降低,Shannon多样性指数也有所下降,并且在Beta多样性分析中,其与空白对照组差异有统计学意义。说明哮喘模型小鼠的肠道菌群的确发生了改变,表现在丰富度和多样性的降低,国外学者Arrieta等[16]的研究同样也表明了哮喘小鼠肠道菌群的這种变化。药物干预后,与模型组比较,异功散组的Chao1丰富度指数明显升高,并且与空白对照组比较,差异无统计学意义,Shannon多样性指数也有所上升。表明异功散可以使哮喘小鼠肠道菌群的丰富度恢复到正常水平,并在一定程度上增加其多样性。
在菌群结构分析中,本实验发现,与空白对照组比较,模型组小鼠的肠道菌群在菌属水平上,表现为乳杆菌属和拟杆菌属的比例明显升高,普雷沃菌属和拟普雷沃菌属的比例下降。国外研究者Ling等[17]、Chen等[18]同样也发现过敏患儿的肠道菌群中乳杆菌属、拟杆菌属明显增加,而普雷沃菌属明显减少,这与本实验结果相一致。实验中,给予药物干预后,比较于模型组,异功散组的乳杆菌属和拟杆菌属比例明显下降,而普雷沃菌属和拟普雷沃菌属的比例则增加,且优势菌属所占的比例更接近于正常组。这与王铁柱[19]、乡世健等[20]对哮喘模型动物给予药物干预后菌属的变化结果相吻合。
中医认为,脾虚是哮喘发病的关键[21-22]。熊英等[23]发现脾虚所致的肠道菌群紊乱可能是加重儿童哮喘和导致哮喘慢性炎症反应状态的重要病机之一,所以对哮喘的治疗离不开健脾补中之法,而异功散则是此法的代表方剂之一。研究证实,健脾中药复方有助于调节肠道菌群,维持肠道微生态的平衡[24]。本实验研究结果显示哮喘小鼠的肠道菌群丰富度和多样性及菌群结构的确发生了改变,而这种改变在异功散的干预下得到了一定程度上的恢复,表明异功散可能通过恢复哮喘小鼠肠道菌群的平衡,从而实现改善哮喘症状和气道炎症反应的作用。本实验为中医药从肠道微生态角度防治哮喘提供了新的思路,其具体作用机制有待于进一步研究。
参考文献
[1]中华医学会儿科学分会呼吸学组,《中华儿科杂志》编辑委员会.儿童支气管哮喘诊断与防治指南(2016年版)[J].中华儿科杂志,2016,54(3):167-181.
[2]刘传合,洪建国,尚云晓,等.中国16城市儿童哮喘患病率20年对比研究[J].中国实用儿科杂志,2015,30(8):596-600.
[3]Macpherson AJ,Harris NL.Interactions between commensal intestinal bacteria and the immune system[J].Nat Rev Immunol,2004,4(6):478-485.
[4]Couzin-Frankel J.Bacteria and asthma:untangling the links[J].Science,2010,330(6008):1168-1169.
[5]邵铁娟,李海昌,谢志军,等.基于脾主运化理论探讨脾虚湿困与肠道菌群紊乱的关系[J].中华中医药杂志,2014,29(12):3762-3765.
[6]张玉佩,杨钦河,邓远军,等.中焦湿热证与胃肠道微生态关系刍议[J].中医杂志,2016,57(24):2094-2096.
[7]刘自力,张庆荣,吴兆利.论脾虚为哮喘宿根[J].中医药学刊,2006,24(2)294-295.
[8]刘华,欧阳学认,张雪丽,等.异功散早期干预对支气管哮喘幼年小鼠气道炎症的影响[J].环球中医药,2017,10(10):1167-1169.
[9]张睦涵,朱振刚.哮喘动物模型建立的研究进展[J].实验动物科学,2018,35(4):83-86.
[10]刘晨菁.婴泻颗粒治疗抗生素相关性腹泻的临床和实验研究[D].郑州:河南中医学院,2015.
[11]Russell SL,Gold MJ,Hartmann M,et al.Early life antibiotic-driven changes in microbiota enhance susceptibility to allergic asthma[J].EMBO Rep,2012,13(5):440-447.
[12]Ahmadizar F,Vijverberg S,Arets H,et al.Early-life antibiotic exposure increases the risk of developing allergic symptoms later in life:A meta-analysis[J].Allergy,2018,73(5):971-986.
[13]Hooper LV,Littman DR,Macpherson AJ.Interactions between the microbiota and the immune system[J].Science 2012,336(6086):1268-1273.
[14]Mennini M,Dahdah L,Artesani MC,et al.Probiotics in Asthma and Allergy Prevention[J].Front Pediatr,2017,5:165.
[15]李春燕,李俊红,张海员,等.支气管哮喘患者肠道菌群多样性变化[J].科技导报,2012,30(30):63-67.
[16]Arrieta MC,Stiemsma LT,Dimitriu PA,et al.Early infancy microbial and metabolic alterations affect risk of childhood asthma[J].Sci Transl Med,2015,7(307):307ra152.
[17]Ling Z,Li Z,Liu X,et al.Altered Fecal Microbiota Composition Associated with Food Allergy in Infants[J].Appl Environ Microbiol,2014,80(8):2546-2554.
[18]Chen CC,Chen KJ,Kong MS,et al.Alterations in the gut microbiotas of children with food sensitization in early life[J].Pediatr Allergy Immunol,2016,27(3):254-262.
[19]王铁柱.从肠道菌群角度探讨温通方对过敏性哮喘大鼠的治疗作用[D].北京:北京中医药大学,2017.
[20]乡世健,盛华芳,吕亚梅,等.冬病夏治方穴位贴敷对哮喘豚鼠气道炎症及肠道菌群的影响[J].中国实验方剂学杂志,2018,24(9):95-102.
[21]夏永良,王彩霞,李德新.哮喘缓解期从脾论治机理的研究[J].中医药学刊,2003,21(7):1194-1196,1199.
[22]蔡润清,吴伟平.支气管哮喘缓解期从脾论治80例臨床探讨[J].贵阳中医学院学报,2007,29(2):29-30.
[23]熊英,沈楚楚,樊璞,等.捏脊法对脾虚哮喘大鼠肠道菌群和肺部炎症的影响[J].中医杂志,2018,59(1):61-65.
[24]马祥雪,王凤云,符竣杰,等.基于肠道菌群的中医健脾方剂作用机制的研究现状与思考[J].中国实验方剂学杂志,2017,23(5):210-215.
(2020-08-27收稿 责任编辑:徐颖)
