PM2.5对哮喘大鼠IL-17/IL-23炎症介质的影响及人参皂苷Rg1干预研究
2021-08-11周亚兵蒋思韵王利维华丽
周亚兵 蒋思韵 王利维 华丽


摘要 目的:基于气道IL-17/IL-23炎症介质轴,探讨人参皂苷Rg1对PM2.5哮喘大鼠肺损伤保护机制。方法:采集并分离交通相关大气细颗粒物PM2.5,利用卵白蛋白致敏和激发建立幼龄哮喘大鼠模型,再给予PM2.5气管滴注建立PM2.5哮喘肺损伤模型,采用酶联免疫吸附试验(ELISA)法测定血清和肺泡灌洗液IL-17a、IL-6、IL-23、TGF-β1含量,RT-PCR检测RORγt mRNA表达,并行肺组织病理和电镜分析。结果:成功建立PM2.5气管滴注哮喘大鼠模型;哮喘大鼠模型血清和肺泡灌洗液IL-17a、IL-6、IL-23、TGF-β1表达量增大(P<0.01),肺组织RORγt mRNA表达量增加(P<0.01);经PM2.5气管滴注后,模型组大鼠血清和肺泡灌洗液IL-17a、IL-6、IL-23、TGF-β1含量进一步增加,RORγt mRNA表达量进一步上升(P<0.01);经皂苷Rg1干预后,呈现剂量依赖性下调血清和肺泡灌洗液IL-17a、IL-6、IL-23、TGF-β1水平,下调RORγt mRNA表达量。结论:人参皂苷Rg1呈剂量依赖性改善PM2.5致哮喘大鼠肺气道炎症反应、改善肺损伤。
关键词 哮喘;大气颗粒物2.5;辅助性T细胞17;白细胞介素-17;白细胞介素-23;维A酸相关孤儿受体γt;人参皂苷Rg1
Abstract Objective:Based on the airway IL-17/IL-23 inflammatory factor axis,to explore the protective mechanism of Ginsenoside Rg1 on lung injury in PM2.5 asthmatic rats.Methods:PM2.5 was isolated and sensitized by ovalbumin,and then PM2.5 was intratracheal instilled to establish PM2.5 asthmatic lung injury model.The levels of IL-17a,IL-6,IL-23 and TGF-β1 in serum and BALF were measured by ELISA.The expression of RORγt mRNA was detected by RT-PCR,and the lung tissue pathology and electron microscopy were analyzed.Results:The asthmatic rat model of PM2.5 was established successfully; The expression of IL-17a,IL-6,IL-23 and TGF-β1 in serum and BALF of asthmatic rats increased(P<0.01),and the expression of RORγt mRNA in lung tissue increased(P<0.01); After PM2.5 intratracheal instillation,the contents of IL-17a,IL-6,IL-23 and TGF-β1 in serum and BALF of model group were further increased,and the expression of RORγt mRNA was further increased(P<0.01);After intervention with saponin Rg1,IL-17a,IL-6,IL-23,TGF-β1 in serum and BALF were decreased in a dose-dependent manner,and RORγt mRNA expression was down regulated.Conclusion:Ginsenoside Rg1 can improve airway inflammation and lung injury induced by PM2.5 in a concentration dependent manner.
Keywords Asthma; atmospheric particulate matter 2.5; helper T cell 17; IL-17;IL-23;retinoic acid related orphan receptor γt; ginsenoside Rg1
中圖分类号:R285.5文献标识码:Adoi:10.3969/j.issn.1673-7202.2021.10.004
大气颗粒物PM2.5(Particulate Matter 2.5),因其粒径小、比表面积大、组成复杂,易富集有毒有害物质,随呼吸可进入肺泡深部,甚至透过呼吸膜进入循环系统[1]。研究已证实PM2.5与呼吸、心脑血管及免疫系统的疾病关系密切,儿童机体发育尚未完善,更易受到PM2.5的危害[2-4],导致肺组织结构损伤和功能缺陷,影响肺功能,导致儿童哮喘患病率和症状严重程度增加[5-7]。Th17作为重要炎症细胞,在多种炎症反应疾病中发挥重要作用;IL-23具有激活记忆T细胞向Th17细胞转化的功能;维A酸相关孤儿受体γt(Retinoid Acid-related Orphan Receptor Gamma t,RORγt)是Th17细胞分化的关键核因子及Th17细胞谱系特异性转录激活因子,可诱导调控IL-17高水平分泌,诱导多种细胞释放炎症介质而导致过度炎症反应,从而促进哮喘发病[8]。人参皂苷Rgl(Ginsenoside-Rgl,G-Rgl)具有抗氧化应激、抗炎症反应、抗纤维化和神经保护作用[9],对脓毒症肺损伤有修复作用[10],那么,皂苷Rg1对PM2.5损伤哮喘大鼠肺气道是否有修复保护作用?本实验成功建立PM2.5气管滴注亚急性损伤哮喘大鼠模型,以TH17细胞的分化和调节为主轴,探讨人参皂苷Rg1对PM2.5哮喘大鼠肺损伤保护机制,以期寻找药物作用靶点。
1 材料与方法
1.1 材料
1.1.1 动物
雄性2周龄无特定病原体(SPF)级Wistar大鼠100只,体质量(50±5)g,由上海斯莱克实验动物有限公司提供[合格证号SYXK(沪)2012-0002],飼养于新华医院清洁级动物中心[SYXK(沪)2013-0031],所有操作均严格按照中国伦理委员会有关动物研究指导原则进行。饲养于温度(22±2)℃、湿度光照12 h/12 h明暗交替环境。
1.1.2 药物 人参皂苷Rg1(Sigma公司,美国,货号:18826)。
1.1.3 试剂与仪器
鸡卵白蛋白(Sigma公司,美国,货号:A21772);酶联免疫吸附试验(ELISA)试剂盒,大鼠IL-17a(货号:BMS635)、IL-6(货号:ERA31RB)、IL-23(货号:ERA28RB)、IL-22(货号:ERA27RB)、转化生长因子-β1(TGF-β1)(货号:BMS623-3)、TRIzol试剂盒(货号:15596018),以上试剂盒均购自美国Invitrogen 公司。兔抗鼠抗体RORγt多克隆抗体(Takara公司,日本,货号:RR037A);定量PCR仪及配套分析软件(Roche公司,美国,型号:96LightCycler);大气颗粒物大流量采样器(型号:Anderson G-2.5)、酶标仪(型号:MultiskanTM FC),以上购自美国Thermo公司。
1.2 方法
1.2.1 模型制备与分组
1.2.1.1 大气颗粒物PM2.5制备 在市区某建筑物楼顶(高度10 m,周围无明显污染源),大流量采样器采集大气颗粒物,将吸附细颗粒物的滤膜裁剪为1 cm×3 cm大小,浸入去离子水中,超声振荡30 min×3次,洗脱细颗粒物,振荡液用6层纱布过滤,滤液在低温离心机4 ℃下10 000 r/min,离心半径8 cm,离心20 min,将浓缩上清液及底层颗粒物合并冷冻真空干燥,低温冰箱保存备用。
1.2.1.2 二步法建立PM2.5亚急性损伤哮喘大鼠模型
第1步:建立大鼠哮喘模型:雄性2周龄Wistar大鼠,适应性喂养3 d后,在第1天和第7天腹腔注射卵清蛋白(OVA)(1 mg)和氢氧化铝凝胶(50 mg)混合液共1 mL致敏;在第14天置于半透明雾化吸入箱中,超声雾化吸入1%OVA激发,30 min/次,隔天1次,连续7 d。最后1次激发24 h内记录各组模型鼠发病情况,以大鼠出现咳嗽、呼吸急促、腹肌抽搐、口唇发绀为模型成功标准。
第2步:气管滴注法建立PM2.5再损伤哮喘大鼠模型:符合哮喘标准大鼠按照随机数字表法分为4组,共72只,采用气管滴注法将PM2.5混悬液注射到支气管深部染毒,PM2.5滴注剂量为5 mg/(kg·bw),用前超声振荡5 min混匀,隔天气管滴注染毒1次,维持21 d。另设生理盐水滴注哮喘大鼠作为对照(A组)。
1.2.1.3 分组方法 将PM2.5亚急性损伤哮喘大鼠分为3组:PM2.5亚急性损伤哮喘组(A+PM组)、人参皂苷Rg1低剂量组(L-Rg组)、高剂量组(H-Rg组)。另设同龄正常对照组(N组)、哮喘组(A组),各组8只。
1.2.2 给药方法
Rg1低剂量组(PM+Rg-L组)、高剂量组(PM+Rg-H组),分别按照10 mg/kg、20 mg/kg标准连续腹腔内注射;PM2.5亚急性损伤哮喘对照组(PM+A组)、正常对照组(N组)、哮喘组(A组)予以等体积生理盐水腹腔内注射。1次/d,连续给药14 d,第15天处死采集标本。
1.2.3 检测指标与方法
1.2.3.1 肺组织病理学及电子显微镜观察
最后一次给药后,水合氯醛[10%,3 mL/(kg·bw)]麻醉大鼠,取各组大鼠右肺上叶,多聚甲醛固定24 h,常规石蜡包埋、切片,切片厚度4~6 μm,HE染色,中性树胶封固,光镜下观察支气管、肺泡及肺泡隔炎性细胞浸润情况。另取标本用于电子显微镜观察气道上皮,肺泡Ⅰ型和Ⅱ型上皮细胞、肺泡间质变化。
1.2.3.2 血清TGF-β1、IL-6、IL-17a、IL-23水平测定
分离血清,采用双抗体夹心ELISA法测定,按照连续倍比稀释标准品,混捕获微球,制备细胞因子检测抗体,然后将样本与检测抗体混匀,室温避光孵育1 h,洗涤后全自动酶标仪450 nm波长处测定吸光度值(A450)并绘制标准曲线。
1.2.3.3 肺泡灌洗液IL-6、IL-17a、IL-23水平测定
左肺行肺泡灌洗液,暴露气管,剪一斜口,插入带有聚乙烯管的肺灌洗针头,结扎固定;磷酸缓冲液(PBS)按35 mL/(kg·bw)。总肺容量×0.6(右肺占总肺容量的60%)的灌洗量进行肺灌洗;同时轻轻按压胸腔,缓慢抽出气管内PBS再重新缓慢注入,如此反复灌洗3次,回抽率>85%,得到支气管肺泡灌洗液。用双抗体夹心ELISA法测定,按照连续倍比稀释标准品,然后将样本与检测抗体混匀,室温避光孵育1 h,洗涤后全自动酶标仪450 nm波长处,测定吸光度值(A450)并绘制标准曲线。
1.2.3.4 RT-PCR检测肺组织RORγt mRNA表达
右下肺组织置于冻存管中,液氮中速冻后转入-80 ℃冰箱保存,采用TRIZOL法提取肺组织总RNA,取5 μL逆转录合成cDNA,以2.5 μL cDNA为模板,分别应用各组上下游引物行PCR扩增,引物序列:RORγt上游5′-AGTGTAATGTGGCC-3′,下游5′-GCTGCTGTTGCAGTTGTTTCT-3′,以相对表达量2-△△Ct法计算目的基因相对表达量,采用Roche软件分析RT-PCR条带平均灰度值。
1.3 统计学方法
采用SPSS 18.0统计软件进行数据分析,计量资料使用均数±标准差(±s),多组间比较采用方差分析(方差齐性),多组间两两比较采用LSD检验,以P<0.05为差异有统计学意义。
2 结果
2.1 一般情况
经卵蛋白致敏激发后,哮喘组(A组)大鼠均出现喘息、呼吸急促、点头呼吸、弓背、前肢缩抬等哮喘症状。经PM 2.5气道滴注后,PM+A组喘息、呼吸急促、点头呼吸、弓背、前肢缩抬等症状更加明显。经人参皂苷Rg1干预后,人参皂苷Rg1低、高剂量组(PM+Rg-L组、PM+Rg-H组)症状均改善。
2.2 人参皂苷Rg1对PM2.5哮喘大鼠肺组织病理的影响
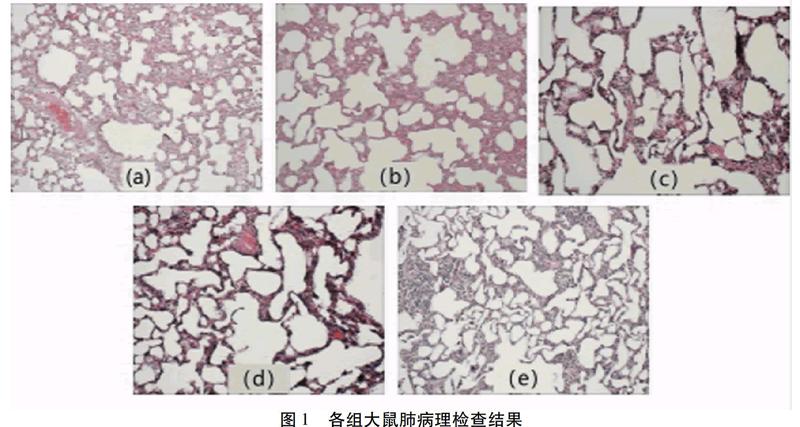
N组大鼠气管黏膜上皮结构完整,纤毛排列整齐,肺泡结构正常,无明显渗出,未见明显炎性细胞浸润(图1-a)。哮喘组支气管管腔变窄,管壁增厚,黏膜脱落,平滑肌增生,炎性细胞明显浸润,呈团块状聚集,肺泡扩张(图1-b)。经PM2.5损伤哮喘组管壁明显增厚,管腔变窄,肺泡塌陷,部分肺泡破裂融合,肺间质反应性增生明显,巨噬细胞、淋巴细胞等炎性细胞明显增多(图1-c)。经人参皂苷Rg1干预后,大鼠管壁变薄,吞噬细胞、淋巴细胞数量减少(图1-d、e)。
2.3 PM2.5亚急性损伤哮喘大鼠肺电镜结果
N组肺组织電镜结构气管管腔完整,肺泡结构常,无明显渗出物,未见明显炎性细胞浸润(图2-a)。A组管腔变窄,管壁增厚,平滑肌增生,炎性细胞明显浸润,呈团块状聚集(图2-b)。经PM2.5损伤哮喘组可见大气颗粒物沉积于管腔和肺泡,部分肺泡破裂融合,肺间质反应性增生明显,巨噬细胞、淋巴细胞等炎性细胞明显增多(图2-c)。经人参皂苷干预后,大鼠管壁变薄,吞噬细胞、淋巴细胞数量减少(图2-d、e)。
2.4 人参皂苷Rg1对PM2.5哮喘大鼠血清IL-17a、IL-6、IL-23、TGF-β1的影响
与N组比较,经卵蛋白激发诱导后,A组血清IL-17a、IL-6、IL-23、TGF-β1的表达量增大(P<0.01);经PM2.5气管滴注后,PM+A组大鼠血清IL-17a、IL-6、IL-23、TGF-β1进一步增加(P<0.01);经人参皂苷Rg1干预后,可明显下调血清IL-17a、IL-6、IL-23、TGF-β1水平,PM+Rg-H组下降更为显著(P<0.01)。见表1。
2.5 人参皂苷Rg1对肺泡灌洗液IL-17a、IL-6、IL-23的影响
与N组比较,经卵蛋白激发诱导后,A组肺泡灌洗液IL-17a、IL-6、IL-23表达量增高(P<0.01);经PM2.5气管滴注后,PM+A组大鼠肺泡灌洗液IL-17a、IL-6、IL-23水平进一步增加(P<0.01);经人参皂苷Rg1干预后,可明显下调IL-17a、IL-6、IL-23水平,PM+Rg-H组下降更为明显(P<0.01)。见表2。
2.6 人参皂苷Rg1对肺组织RORγt mRNA表达的影响
RORγt是Th17细胞分化的关键因素,TGF-β、IL-6通过诱导RORγt表达,启动RORγt信号转导通路,进而促进Th17细胞的分化。A组大鼠经卵蛋白激发后,肺组织RORγt mRNA表达量增加(P<0.01);经PM2.5气管滴注14 d后,RORγt mRNA表达量进一步上升,差异有统计学意义(P<0.01)。经人参皂苷Rg1干预后,RORγt mRNA表达量下调,PM+Rg-H组下降更为明显(P<0.01)。见表3。
3 讨论
我国PM2.5主要来源于燃煤、机动车尾气、土壤沙尘、建筑尘、冶炼尘等,其中机动车尾气已经超越燃煤成为城市PM2.5主要来源[11]。北京、上海、深圳机动车尾气PM2.5分别占到31.1%、29.2%和41%[12]。PM2.5颗粒直径小,会以更高的速率穿透呼吸道并沉积在肺泡中,其所包裹的毒性物质如有机物(OM)、硫酸盐(SO42-)、硝酸盐(NO3-)、铵盐(NH4+)和矿尘等,可致应激、炎症反应及过敏反应[13]。Meta分析我国1989—2014年文献显示PM2.5每增加10 μg/m3,呼吸系统疾病死亡率增加0.50%[14]。欧洲空气污染影响队列研究(ESCAPE)证实住宅附近PM2.5每增加5 μg/m3,儿童FEV1降低1.77%[15]。居住地距离主干道越近儿童,FVC降低越明显[16]。
Th17细胞是一种不同于Thl和Th2的CD4+调节性T细胞。TGF-β、IL-6作为诱导初始CD4+T细胞向Th17细胞分化的关键细胞因子,通过激活STAT3(Signal Transducer and Activator of Tranions 3)信号通路,活化Th17细胞分化关键核因子RORγt,促进Th17细胞分化和IL-17分泌[17-21],进而诱导更多细胞释放炎症介质,促进气道内炎性细胞募集和激活,导致哮喘发病[22]。IL-17共6个亚型,其中IL-17a是重要的炎症介质,能引起组织坏死、器官衰竭,与哮喘气道炎症反应的急性加重正相关[23]。IL-23是由活化的树突状细胞、巨噬细胞及单核细胞等产生的炎症介质,促进活化的Th17细胞生长和增殖,缺乏IL-23的小鼠体内几乎检测不到Thl7细胞存在[24],IL-23能保持Th17细胞稳定分泌IL-17a、IL-17f和IL-22等炎症介质[8,25]。
本研究显示卵白蛋白激发哮喘大鼠血清和肺泡灌洗液IL-17a、IL-23、TGF-β1、IL-6增加;经PM2.5气管滴注后哮喘大鼠血清和肺泡灌洗液IL-17a、IL-23、TGF-β1、IL-6进一步增加;肺组织RORγt mRNA表达量上升。推测PM2.5及其有毒成分通过刺激TGF-β1、IL-6增高,来促进Th17细胞分化;同时通过激活STAT3-RORγt-IL-17/IL-23信号通路,上调RORγt mRNA和蛋白高表达,诱导Th0细胞向Th17分化,释放IL-17、IL-23炎症介质。IL-23具有稳定维持Th17细胞产生IL-17a等炎症介质作用,可持续增强致炎效应,促进气道重塑,肺组织支气管充血水肿,黏膜细胞脱落以及炎性细胞浸润等症状,最终导致哮喘发作或者加重。这与其他临床报道结果一致,哮喘患者BALF中IL-17、TGF-β明显增加,且在暴露于过敏原时,水平进一步迅速增加,提示IL-17、TGF-β是气道重塑和气道炎症反应的关键细胞因子,并与哮喘严重程度存在一定相关性[26-27]。
人参性平味甘微苦,有大补元气、复脉固脱、补脾益肺、生津安神之功效,主要含有皂苷(Ginsenoside,GS)、多聚糖、多肽、聚炔醇和脂肪酸等活性成分。其中,皂苷Rgl为四环三萜类衍生物,具有抗氧化应激、抗炎症反应、抗纤维化和神经保护作用等功效[28-30]。有研究证明Rg1对内毒素导致肺血管内皮损伤的保护作用,对肺缺血再灌注损伤具有抗炎、抗细胞凋亡作用[10,31-32],改善肺组织肺泡结构和肺间质炎性浸润,对脓毒症肺损伤有修复作用[33-34]。
本研究显示经皂苷Rg1干预后,可明显下调PM2.5哮喘大鼠血清和肺泡灌洗液IL-6和TGF-β1含量,RORγt mRNA表达量下调,进而抑制IL-17a、IL-23的表达和释放,以上结果随着Rg1剂量上升而下降更为显著,并改善肺泡结构,减轻肺间质炎性浸润,说明皂苷Rg1呈剂量依赖性对于PM2.5致哮喘大鼠肺损伤,具有抑制气道炎症反应、改善肺损伤的作用。因此,人参皂苷Rg1有望用于PM2.5致气道损伤的有效药物。
参考文献
[1]阚海东.《环境空气质量标准》(GB3095-2012)细颗粒物(PM2.5)标准值解读[J].中华预防医学杂志,2012,46(5):396-398.
[2]华畅,黃亮然,罗艳侠.PM2.5损伤血管内皮细胞的研究进展[J].中国预防医学杂志,2018,19(7):544-547.
[3]杨柳,张军,王莹,等.2016年济南市大气PM2.5对人群超额死亡风险评估[J].环境卫生学杂志,2018,8(3):178-183.
[4]陈继珍,余健,邹敏书,等.武汉市PM2.5浓度与儿科呼吸道疾病就诊量的相关性分析[J].湖南中医杂志,2018,34(5):152-154.
[5]Guarnieri M,Balmes JR.Outdoor air pollution and asthma[J].Lancet,2014,383(9928):1581-1592.
[6]Gowers AM,Cullinan P,Ayres JG,et al.Does outdoor air pollution induce new cases of asthma Biological plausibility and evidence; a review[J].Respirology,2012,17(6):887-898.
[7]Liu F,Zhao Y,Liu YQ,et al.Asthma and asthma related symptoms in 23,326 Chinese children in relation to indoor and outdoor environmental factors:the Seven Northeastern Cities(SNEC)Study[J].Sci Total Environ,2014,497-498(16):10-17.
[8]Kagami S.IL-23 and Th17 cells in infections and psoriasis[J].Nihon Rinsho Meneki Gakkai Kaishi,2011,34(1):13-19.
[9]黄海英.人参皂苷Rg1药理作用研究进展[J].实用中医药杂志,2012,28(7):608-609.
[10]Bao S,Zou Y,Wang B,et al.Ginsenoside Rg1 improves lipopolysaccharide-induced acute lung injury by inhibiting inflammatory responses and modulating infiltration of M2 macrophages[J].Int Immunopharmacol,2015,28(1):429-434.
[11]国家环境保护部.关于发布国家环境质量标准《环境空气质量标准》的公告[EB/OL].(2012-03-02).http://www.gov.cn/zwgk/2012-03/02/content_2081359.htm.
[12]上海市环境保护局.北杭广深大气污染首要污染源机动车[EB/OL].(2015-04-02)http://www.sepb.gov.cn/fa/cms/shhj/shhj5082/shhj2254/2015/04/89130.htm.
[13]Qiu H,Yu IT,Tian L,et al.Effects of coarse particulate matter on emergency hospital admissions for respiratory diseases:a timeseries analysis in Hong Kong[J].Environ Health Perspect,2012,120(4):572-576.
[14]刘昌景,黄飞,杨志洲,等.我国空气污染物与人群呼吸系统疾病死亡急性效应的Meta分析[J].中华流行病学杂志,2015,36(8):889-895.
[15]Gehring U,Gruzieva O,Agius RM,et al.Air pollution exposure and lung function in children:the ESCAPE project[J].Environ Health Perspect,2013,121(11-12):1357-1364.
[16]Rice MB,Rifas-Shiman SL,Litonjua AA,et al.Lifetime Exposure to Ambient Pollution and Lung Function in Children[J].Am J Respir Crit Care Med,2016,193(8):881-888.
[17]Camargo L,Righetti RF,Aristóteles L,et al.Effects of Anti-IL-17 on Inflammation,Remodeling,and Oxidative Stress in an Experimental Model of Asthma Exacerbated by LPS[J].Front Immunol,2017,8:1835.
[18]Xu D,Fu J,Jin L,et al.Circulating and liver residen CD4+CD25+ regulatory T cells actively influence the antiviral immune response and disease progression in patient[J].J Immunol,2006,177(1):739-747.
[19]Huh JR,Littman DR.Small molecule inhibitors of RORγt:targeting Th17 cells and other applications[J].Eur J Immunol,2012,42(9):2232-2237.
[20]Kimura A,Kishimoto T.IL-6:regulator of Treg/Th17 balance[J].Eur J Immunol,2010,40(7):1830-1835.
[21]Tanaka S,Suto A,Iwamoto T,et al.Sox5 and c-Maf cooperatively induce Th17 cell differentiation via RORγt induction as downstream targets of Stat3[J].J Exp Med,2014,211(9):1857-1874.
[22]杨丽霞,黄朝峰.RORγt基因启动子的鉴定和特征分析[J].免疫学杂志,2013,29(1):28-32.
[23]陈啸洪,李华浚,姚欢银,等.外周血Th17和CD4+CD25+调节性T细胞变化与患儿支气管哮喘活动状态的相关性研究[J].中国全科医学,2015,15(8):969-971.
[24]Harrington LE,Mangan PR,Weaver CT.Expanding the effector CD4 T-cell repertoire:the Th17 lineage[J].Curr Opin Immunol,2006,18(3):349-356.
[25]田红岭,侯玉柱,王若雨,等.IL-23生理病理学意义及信号通路[J].免疫学杂志.2014,30(6):555-559.
[26]杜端林,周锐.支气管哮喘急性发作期患者血清IL-17和转化生长因子2的表达及其意义[J].国际呼吸杂志,2017,37(12):881-885.
[27]Zhao Y,Huang Y,He J,et al.Rosiglitazone,a peroxisome proliferator-activated receptor-γ agonist,attenuates airway inflammation by inhibiting the proliferation of effector T cells in a murine model of neutrophilic asthma[J].Immunol Lett,2014,157(1-2):9-15.
[28]Shin BK,Kwon SW,Park JH.Chemical diversity of ginseng saponins from Panax ginseng[J].J Ginseng Res,2015,39(4):287-298.
[29]李文娜,肖苑,黄燮南.人参皂苷Rg1心血管和神经系统药理活性研究进展[J].中国药理学通报,2012,28(6):751-754.
[30]鲁文茜,张斯琪,沈尚竹,等.人参皂苷Rc药理作用和药动学研究进展[J].中草药,2018,49(24):5961-5967.
[31]Sun ZG,Chen LP,Wang FW,et al.Protective effects of ginsenoside Rg1 against hydrogen peroxide-induced injury in human neuroblastoma cells[J].Neural Regen Res,2016,11(7):1159-1164.
[32]Zhang Y,Zhang Z,Wang H,et al.Neuroprotective effect of ginsenoside Rg1 prevents cognitive impairment induced by isoflurane anesthesia in aged rats via antioxidant,anti-inflammatory and anti-apoptotic effects mediated by the PI3K/AKT/GSK-3β pathway[J].Mol Med Rep,2016,14(3):2778-2784.
[33]吉其艦,孙兆瑞,杨志洲,等.人参皂苷Rg1对LPS诱导的肺上皮细胞凋亡和自噬的影响[J].中国中药杂志,2019,44(8):1648-1653.
[34]Yana Li,Fei Zhang,Wei Chen,et al.Total ginsenosides synergize with ulinastatin against septic acute lung injury and acute respiratory distress syndrome[J].Int J Clin Exp Pathol,2015,8(6):7385-7390.
(2020-09-20收稿 责任编辑:徐颖)
