重组蔗糖磷酸化酶表达培养基的优化及化学试剂对酶活的影响
2021-08-11周晓梅李文杰李拖平
张 蕙,周晓梅,张 彪,孙 晓,李文杰, ,李拖平
(1.吉林师范大学博达学院食品科学与工程学院,吉林四平 136000;2.沈阳农业大学食品学院,辽宁沈阳 110866;3.吉林师范大学生命科学学院,吉林四平 136000;4.沈阳市妇婴医院,辽宁沈阳 110011)
蔗糖磷酸化酶(EC2.4.1.7,Sucrose phosphorylase,SPase)属于糖基水解酶第13家族,是催化转移葡萄糖苷键的特异性酶,能催化蔗糖发生磷酸解作用,生成1-磷酸葡萄糖(glucose-1-phosphate, Glc1P)和D-果糖以及其逆反应[1−2]。由于该催化特性,SPase长期以来一直用于生产Glc1P。此外,SPase结构稳定,具有广泛的底物特异性,在食品、药品、化妆品等领域上均有广泛的应用,如可催化半乳糖、鼠李糖、果糖等物质合成不同的低聚糖;修饰和改造含有醇羟基、酚羟基及羧基的化合物;或可以将曲酸糖苷化、催化氢醌合成熊果苷等[3−5];也可以用于合成某些不稳定物质的衍生物,如将葡糖基转移到抗坏血酸上,使其稳定性和水溶性得到提升[6]。
SPase主要存在于乳酸菌和双歧杆菌中,有利于其能量代谢[7]。Kagan等[8]首次从Leuconostoc mesenteroides中发现SPase后,研究人员相继从不同的微生物中发现了该酶,如Pseudomonas saccharophila[9−10]、Stococcus mutans[11]、Bifidobacterium adolescentis[12]等。但通过野生菌株发酵获得的SPase产率较低,难以满足大规模的工业化生产。所以,采用基因工程技术构建重组SPase工程菌,实现该酶的高效表达是一条合理且有利的途径。常用于构建重组SPase工程菌的菌株有大肠杆菌和枯草芽孢杆菌,如E. coliRosetta(DE3)、E. coliBL21、B.subtilisWS11等[13−14]。
目前,国内外对于重组SPase工程菌的研究大多是工程菌的构建、应用、固定化、酶学性质分析和表达条件的优化等[15−20],但几乎没有对重组SPase表达培养基成分优化的研究。同时,化学试剂对SPase的影响直接关乎到该酶的贮存和使用,而这方面的研究也少之又少。因此,本文对来源于双歧杆菌的SPase基因的重组菌株E. coliBL21/pET30-SPase表达培养基的成分进行了优化,研究了不同的培养基成分对SPase表达的影响,并探究了常见化学试剂和金属离子化合物对该酶活性的影响,以期为SPase的高效生产提供理论与技术的支撑条件。
1 材料与方法
1.1 材料与仪器
重组菌E. coliBL21/pET30-SPase 由本实验室保存。其中,SPase基因克隆自Bifidobacterium longumJCM 1217(AB303838),与载体pET-30连接,转化至大肠杆菌BL21中[21];蛋白分子量Marker 北京索莱宝科技有限公司;卡那霉素、异丙基硫代-β-D-半 乳 糖 苷(isopropylthio-β-D-galactoside,IPTG)、BCA蛋白浓度测定试剂盒 北京鼎国昌盛生物技术有限责任公司;葡萄糖磷酸变位酶(phosphoglucomutase,PGM,100 U/mg)、6-磷酸葡萄糖脱氢酶(glucose-6-phosphate dehydrogenase,G6PDH,150 U/mg)、1,6-二磷酸葡萄糖(Glucose-1,6-diphosphate,Glc 1,6-bP) 上海瑞永生物科技有限公司;其他试剂 均为国产分析纯;LB培养基 按文献配制[5]。
HNY-21恒温培养振荡器 天津市欧诺仪器仪表有限公司;LDZX-30KBS立式压力蒸汽灭菌器上海申安医疗器械厂;TGL-16M高速冷冻离心机上海卢湘仪离心机仪器有限公司;SLPe超声波细胞粉碎机 广州中善仪器仪表有限公司;T6紫外可见分光光度计 北京普析通用仪器有限责任公司。
1.2 实验方法
1.2.1 重组菌E. coliBL21/pET30-SPase的表达从LB固体平板上挑取单菌落接种于3 mL含50 μg/mL卡那霉素的LB培养基中,37 ℃,180 r/min震荡培养过夜。按1%接种量接种于50 mL含50 μg/mL卡那霉素的LB培养基中,继续震荡培养至OD600=0.5~0.6时,加入终浓度为0.5 mmol/L IPTG,在30 ℃条件下振荡培养20 h[22]。
1.2.2 SPase粗酶液的制备及纯化 将目的菌培养液离心(4 ℃、10000 r/min、10 min),收集菌体,用50 mmol/L磷酸缓冲液(pH 7.0)洗涤两次沉淀。然后,超声破碎细胞(超声3 s、间歇5 s、共3 min,功率100 W),4 ℃、15000 r/min离心30 min得到粗酶液(上清液)。使用Ni-NTA柱以含60 mmol/L咪唑的磷酸缓冲液(20 mmol/L,pH7.0)对粗酶液进行洗脱纯化得到目标蛋白。
1.2.3 SPase的酶活性测定 将150 μL酶液和150 μL蔗糖溶液(10 mmol蔗糖、50 mmol/L磷酸缓冲液,pH7.0)在30 ℃反应30 min后,立即煮沸灭活10 min。加入300 μL反应液在30 ℃中反应30 min,然后在340 nm处测定吸光度值。反应液为2.5 U/mL PGM、2 U/mL G6PDH、20 μmol/L Glc 1,6-bP、2 mmol/L NADP+、10 mmol/L MgCl2、50 mmol/L MOPS缓冲液(pH7.0)[23−24]。采用标准曲线法,按照标准曲线公式y=2.1387x(R2=0.9992)计算酶与底物反应过程中生产的Glc1P。
酶活性定义为:在30 ℃、pH7.0条件下,以蔗糖为底物,每分钟产生1 μmol的Glc1P所需的酶量为1个酶活力单位(U)。
总酶活(U)为50 mL培养基中的总酶活。
1.2.4 蛋白含量测定及SDS-PAGE分析 以牛血清蛋白(BSA)为标准品,使用BCA蛋白定量试剂盒测定蛋白质含量。SDS-PAGE采用12%浓缩胶和5%分离胶进行电泳,用考马斯亮蓝R-250染色。总蛋白(mg)为50 mL培养基中蛋白的总量。
1.2.5 培养基成分的筛选 以50 mL LB培养基为基础,并作为空白对照,将不同的碳源、氮源、稳定剂、金属离子分别加入到LB培养基中,按1.2.1方法培养。以总蛋白和总酶活为评价指标,考察其对SPase表达的影响。根据参考文献[25−27]确定实验方案如下:在考察碳源对SPase表达的影响时,分别向LB培养基中添加的碳源为0.5%葡萄糖、0.5%可溶性淀粉、0.5%蔗糖和0.5%丙三醇;在考察氮源对SPase表达的影响时,分别向LB培养基中添加的氮源为0.5%NaNO3、0.5%NH4Cl、0.5%(NH4)2SO4和0.5%尿素;在考察稳定剂对SPase表达的影响时,分别向LB培养基中添加的稳定剂为0.1%BSA、0.1%精氨酸、0.1%维生素C和0.1%FeCl2;在考察金属离子对SPase表达的影响时,分别向LB培养基中添加的金属离子为0.1%KH2PO4、0.1%MgSO4、0.1%CuSO4和0.1%ZnCl2。
1.2.6 正交试验优化 在单因素实验的基础上,选择对重组SPase的表达有显著性提高的因素,并根据现有的相关研究中较优的因素水平[25−27]确定正交试验的因素水平(表1)。以淀粉、K+和Mg2+为变量因子,以总酶活为评价指标,进行三因素三水平的正交试验,研究三种培养基成分的协调作用对SPase表达的影响。
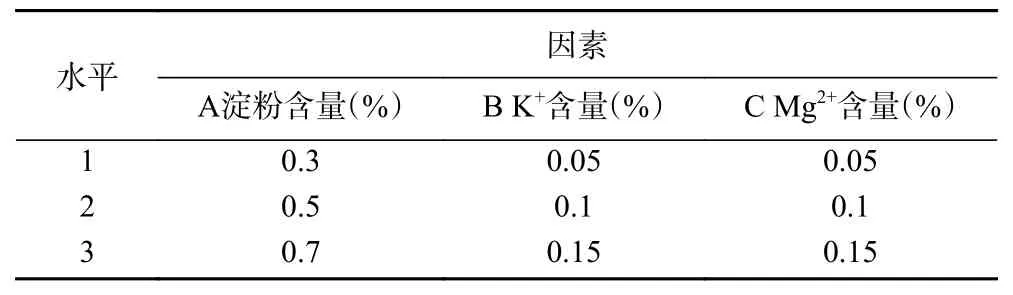
表1 正交试验因素水平表Table 1 Factors and levels table of orthogonal experiment
1.2.7 化学试剂对重组SPase酶活性的影响 依据参考文献[28]的方法,向纯化的重组SPase酶液中分别加入不同的化学试剂或金属离子化合物,考察其对重组SPase酶活性的影响。分别加入0.1%的吐温80、BSA、丙三醇、山梨醇、维生素C、十二烷基硫酸钠(sodium dodecyl sulfate,SDS);1%的吐温80、BSA、丙三醇、山梨醇、维生素C、SDS;1 mmol/L的FeSO4、MgSO4、ZnCl2、CuSO4、MnSO4、CaCl2;10 mmol/L的FeSO4、MgSO4、ZnCl2、CuSO4、MnSO4、CaCl2。将对照组和实验组在30 ℃下保温1 h,测定其酶活。以未经试剂处理的酶液作为对照,酶活设定为100%,计算处理后的相对酶活。
1.3 数据处理
本文中的每组实验均平行三次,采用Excel 2010软件制图,应用SPSS 18.0软件进行正交试验的方差分析和显著性分析。
2 结果与分析
2.1 碳源和氮源对重组SPase表达的影响
碳源和氮源是培养基的重要组成部分,是微生物生长代谢的能量来源和物质基础,与目的蛋白的表达有着密切的联系[29]。对培养基中碳源的研究结果如图1a所示,向LB培养基中添加0.5%可溶性淀粉可显著提高SPase的总酶活和总蛋白含量(P<0.05),而蔗糖和丙三醇的添加虽然提高了蛋白的表达量,但其酶活性极显著降低(P<0.01),推测这可能是由重组蛋白的高水平表达易形成无活性的包涵体[30]。氮源对SPase表达的影响如图1b所示,实验所用的四种氮源中,NaNO3对目的蛋白表达无显著的影响(P>0.05),其余三种氮源均较为明显的抑制了SPase蛋白的表达。并且,通过总蛋白含量和总酶活所表现的不同氮源和碳源对蛋白表达的影响与SDSPAGE分析结果(图1c)相一致(目的蛋白的分子量为56.51 kDa)。
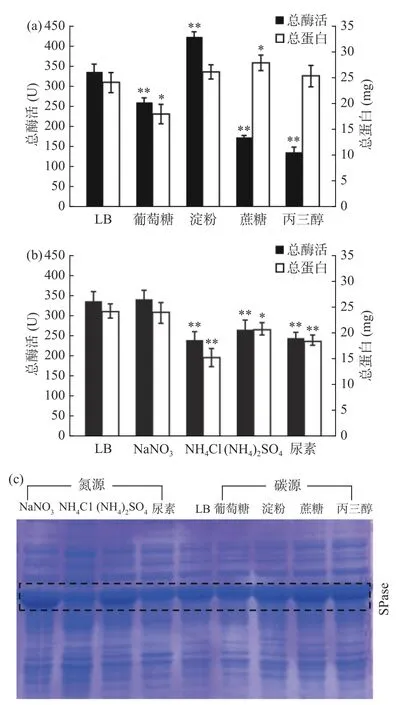
图1 碳源和氮源对重组SPase表达的影响Fig.1 Effects of carbon and nitrogen sources on the expression of recombinant sucrose phosphorylase
2.2 稳定剂和金属离子对重组SPase表达的影响
稳定剂除了可以影响酶的活性和稳定性以外,对微生物的生长也具有一定的影响效应[31]。如图2a所示,四种稳定剂对重组SPase在大肠杆菌中的表达均起到了抑制作用,SDS-PAGE分析(图2b)也显示了同样的结果。其中,维生素C和FeCl2极显著(P<0.01)抑制了蛋白的表达,这可能是由于维生素C和FeCl2抑制了大肠杆菌的生长,从而使菌密度和SPase的表达水平降低,导致总蛋白和总酶活较低。

图2 稳定剂和金属离子对重组SPase表达的影响Fig.2 Effects of stabilizers and metal ions on the expression of recombinant sucrose phosphorylase
金属离子是微生物生长繁殖及产物合成中的重要辅助因子,作为其生理活性物质的组成或生理活动的调节物,对酶的活性具有一定的激活作用[32]。由图2c可知,培养基中添加0.1% K+或Mg2+均提高了SPase的总酶活和总蛋白含量,促进了大肠杆菌的生长及SPase的表达。而Cu2+和Zn2+的添加则完全抑制了菌体的生长和SPase的表达。这可能是由于Cu2+和Zn2+的金属毒性较强,当其与微生物接触后,会破坏微生物的蛋白质结构,使微生物体内的一系列生化反应发生紊乱,从而导致了微生物的死亡[33]。同时SDS-PAGE的分析(图2d)结果也支持了总酶活和总蛋白含量的测定结果,可明显的看出K+或Mg2+处理的目标蛋白条带较粗。
2.3 培养基最优组成的正交试验结果
由表2、表3可知,在三个因素中对SPase表达影响的大小顺序为C>B>A,即Mg2+的添加量对SPase表达的影响表现为极显著(P<0.01),K+和淀粉的添加量对SPase表达的影响表现为显著(P<0.05)。培养基的最优组合为A2B2C1,即淀粉的添加量为0.5%、K+的添加量为0.1%和Mg2+的添加量为0.05%。根据所得最优培养基组合进行验证试验,SPase的总酶活平均值达到1207.83 U,比该酶在单因素实验的基础培养基中表达的总酶活提高了3.6倍,其优化结果在SPase的工业化生产中具有较大的应用潜力。
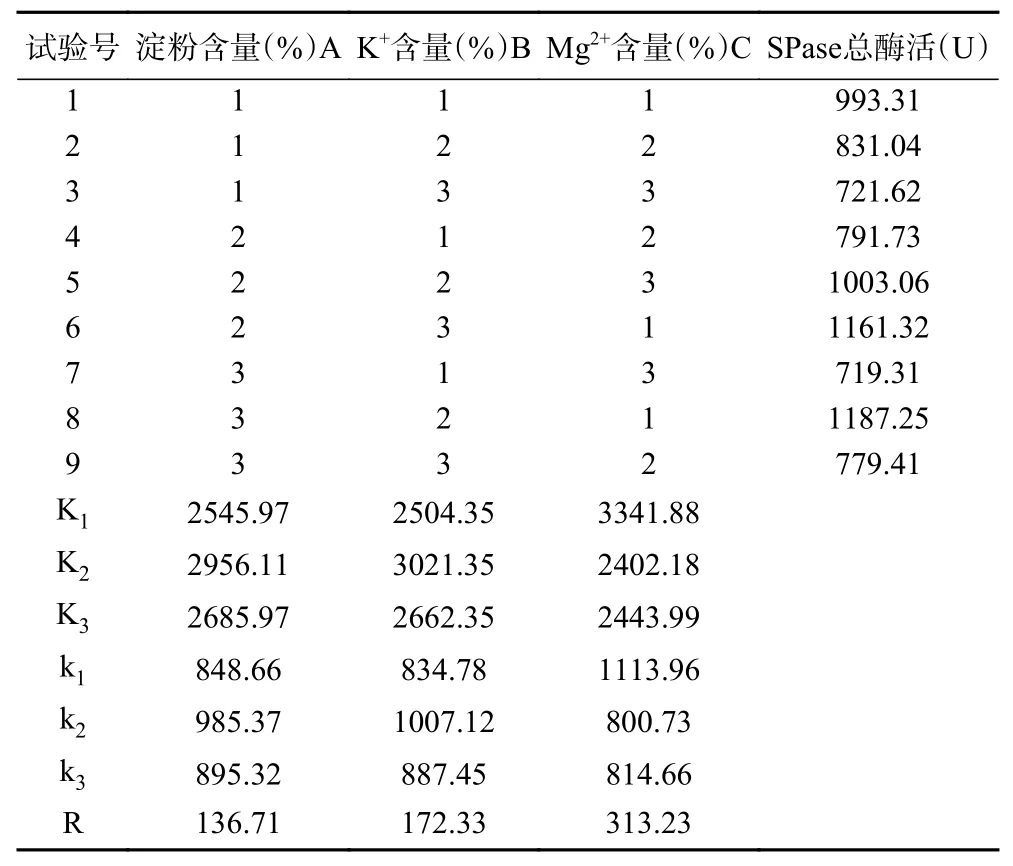
表2 正交试验结果Table 2 Results of orthogonal test

表3 正交试验的方差分析Table 3 Analysis of variance of orthogonal experimental results
2.4 化学试剂和金属离子对重组SPase稳定性的影响
当某些化学试剂与酶混合后,有可能影响酶的分子结构,近而对酶的活性产生不同程度的影响[34]。从表4的结果可以看出,低浓度(0.1%)的吐温80和高浓度(1%)的BSA对SPase的活性具有一定的提升作用,这是由于BSA具有稳定酶的作用,能有效地保护酶不被降解,从而促进了酶的活性。浓度为0.1%的BSA、丙三醇和山梨醇对酶活的影响不大;而0.1%的维生素C、SDS,1%的吐温80、维生素C、SDS、丙三醇和山梨醇对酶活性有不同程度的抑制作用,这可能是由于其改变了酶的活性中心结构,导致了该酶的活性部分或全部丧失。其中,作为蛋白质变性剂的SDS抑制了90%以上的酶活性,因为SDS分子上的硫酸基团与蛋白质表面的氨基酸紧密结合,其分子上的烷基则与蛋白质的疏水部分紧密结合,从而使蛋白质变性失活。吐温80属于非离子型表面活性剂,在低浓度时与酶的疏水活性中心产生相互作用,有利于底物与酶的结合,从而促进酶的活性;在高浓度时吐温80与酶的活性中心紧密结合,使底物无法进入到酶的活性中心,而无法催化其他化学反应,从而抑制了酶的活性[35]。
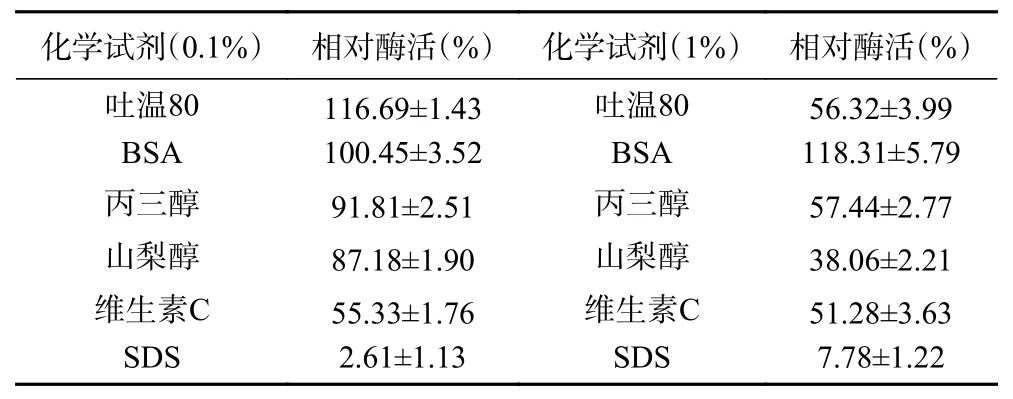
表4 化学试剂对重组SPase稳定性的影响Table 4 Effect of chemical reagents on stability of recombinant SPase
另一方面,金属离子在酶的催化反应过程中也均有重要的作用,可使底物直接结合到酶的活性部位,或者通过可逆地改变金属离子的氧化态从而调节氧化还原反应,或者通过静电稳定及屏蔽负电荷等途径参与酶的催化。国内外已有大量的研究表明,将金属离子作为激活剂添加到在酶反应液中是一种改善酶活性或稳定性的行之有效的方法[36−38]。如表5所示,1 mmol/L的Fe2+、Mg2+、Zn2+、Cu2+、Mn2+、Ca2+均可以影响到SPase的稳定性,经这些离子处理后的酶活均有不同程度的下降。而较高浓度(10 mmol/L)的Fe2+和Mg2+则对SPase的活性和稳定性表现出较好的促进作用。

表5 金属离子对重组SPase稳定性的影响Table 5 Effect of metal ions on stability of recombinant SPase
3 结论
通过单因素实验和正交试验结果表明,虽然作为碳源的淀粉和无机离子K+和Mg2+对SPase的表达具有一定的促进作用,但三者的协同作用是重组SPase工程菌(E.coliBL21/pET30-SPase)高效表达SPase的优选条件,可以在很大程度上提高SPase的表达效率。其中,在LB培养基的基础上添加0.5%淀粉、0.1% K+和0.05% Mg2+的组合,可提高到3.6倍的表达效率。与现有的重组SPase表达优化研究相比,该优化方式提高目的蛋白表达的水平较高,在SPase的工业化生产上具有一定的实际应用价值。另外,通过一些适当浓度的表面活性剂如吐温80,或一些金属离子如Fe2+和Mg2+可以对重组SPase的活性起到一定的促进作用,对该酶的高效利用提供了理论依据,也为日后进一步研究该酶的性质奠定了基础。但本试验也存在不足之处,在粗酶液的制备过程中存在影响酶活的操作,如细胞破碎。因此,在日后的科研工作中,将对此类操作步骤进行优化,以期进一步提高该酶的活性。
