宁波地区新生儿G6PD缺乏症基因突变特点及与酶活性的相关性分析
2021-08-05庄丹燕王飞潘婕文潘小莉潘澍青陈志央李海波
庄丹燕,王飞,潘婕文,潘小莉,潘澍青,陈志央,李海波
葡萄糖-6-磷酸脱氢酶缺乏症(G6PDD)是一种因编码G6PD酶的DNA突变使该酶结构或其活性发生改变,最终影响红细胞自身抗氧化能力减弱,易被破坏引发溶血黄疸等一系列症状的X连锁不完全显性遗传病[1]。G6PD基因突变类型和频率因地区种族人群差异较大,常见于非洲热带、东南亚、地中海和中东区域[2],我国则以南方地区为主[3]。G6PD酶法检测受性别、温度等影响较大[4-5]。本研究针对2018年宁波地区出生的新生儿,行G6PD缺乏症酶法筛查及基因诊断,以评估G6PD缺乏症在宁波地区的发病情况,明确宁波地区人群的G6PD基因突变类型和频率,同时分析基因型与酶活性相关性,为宁波市筛查中心制定本地区最佳的G6PD缺乏症筛查及确诊方案提供依据。
1 资料与方法
1.1 一般资料 收集宁波市2018年出生的新生儿78 338名,每例新生儿家长均签署知情同意书自愿参加免费新生儿疾病筛查。采其足跟血制成干血斑用于筛查,筛查阳性样本(酶活性≤2.6 U/g Hb)进行基因确诊,同一筛查时间段内酶活性介于2.6~3.0 U/g Hb的女性样本也纳入基因检测。
1.2 方法
1.2.1 G6PD初筛实验 采用Wallac 1420 VictorTM2及配套G6PD荧光分析试剂盒对新生儿干血斑进行初筛,试验步骤和结果判读严格按照试剂说明书执行。
1.2.2 G6PD/6GPD生化比值检测 筛查可疑阳性的患儿召回抽取患儿抗凝血,采用G6PD/6GPD试剂盒(广州米基)进行确诊,G6PD/6GPD<1视为确诊G6PD缺乏。
1.2.3 G6PD基因检测 采用Lab-Aid824核酸提取仪(厦门致善)提取干血斑标本中基因组DNA,用SLAN-96S实时PCR系统(上海宏石)进行多色探针荧光PCR熔解曲线分析。通过比较待检标本与野生型对照的熔解峰之间熔点(Tm值)的差异判断标本是否发生突变及突变的类型。如果没有发现热点突变,则对G6PD编码外显子进行Sanger测序(NM_001042351.1)。
1.3 统计方法 采用SPSS 13.0软件进行数据处理,计数资料采用2检验。P<0.05为差异有统计学意义。
2 结果
2.1 宁波地区G6PD基因突变类型和频率 78 338例新生儿G6PD筛查中,酶活性≤2.6 U/g Hb的阳性例数405例,介于2.6~3.0 U/g Hb之间的女性95例,共500例样本纳入基因检测。检测结果220例未见突变,280例检出不同位点突变,以1388G>A突变占比最多(86例,占30.71%,含72例纯合突变和14例杂合突变),其次为1376G>T(77例,占27.50%,含55例纯合突变和22例杂合突变)。其中c.1375C>T、c.350C>T两个突变,MMCA检测结果为未知基因,Sanger测序后发现为这两个突变。见表1、封三彩图7。
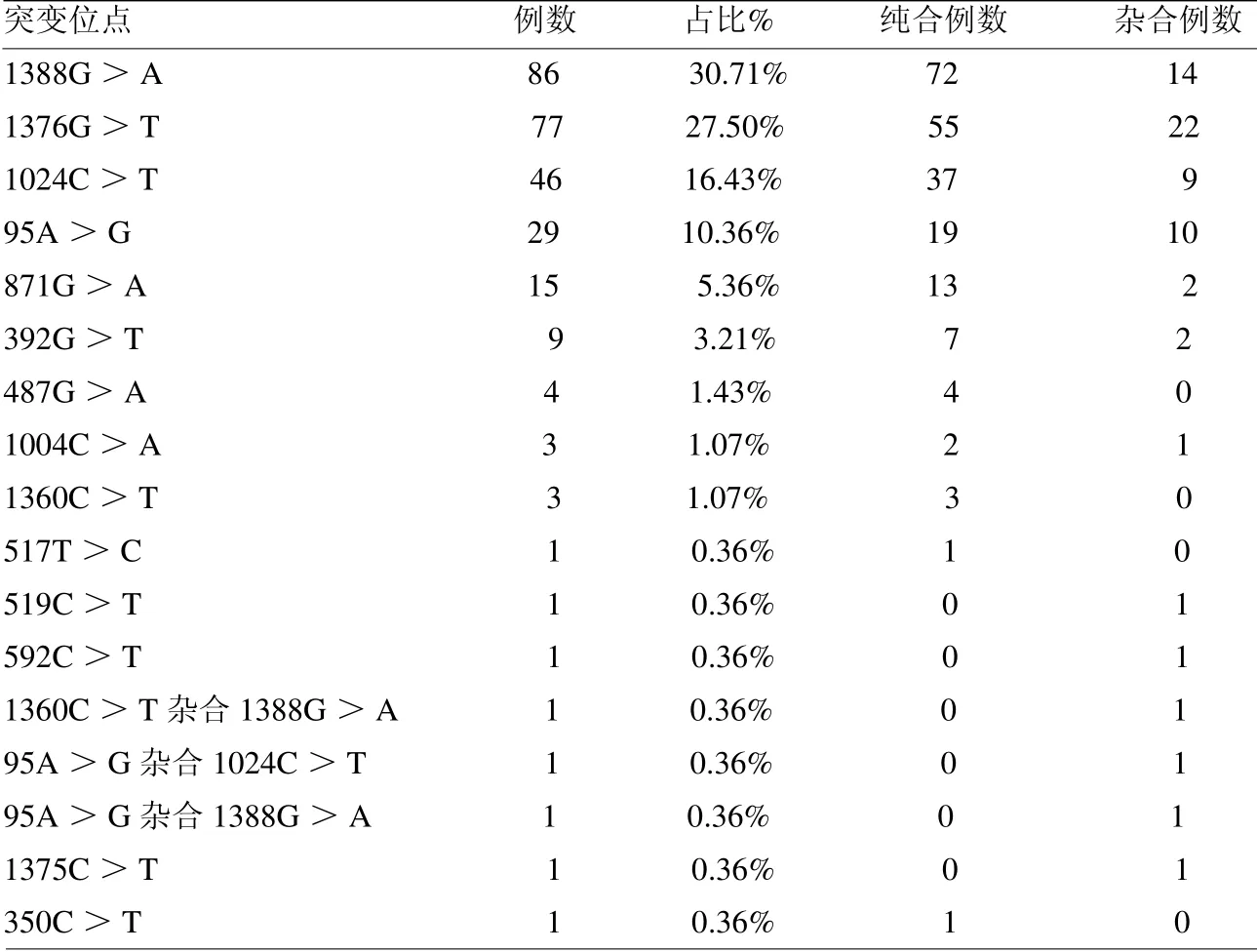
表1 不同基因突变位点和频率统计
2.2 基因突变携带率在不同G6PD酶活性区间分布情况 经基因检测的500例样本,其中男290例,女210例。当G6PD酶活>2.4 U/g Hb时,男性样本突变携带率<20%;而女性高达20%~50%。见封三彩图8。
2.3 G6PD基因型与酶活相关性 比较5种最常见基因突变位点样本G6PD酶活性差异,不同基因突变位点样本G6PD初筛浓度值差异有统计学意义(2=8.713,P<0.05);95A>G突变类型G6PD初筛>2.6 U/g Hb的比例均高于1376G>T(2=5.377,P<0.05),见表2。

表2 不同基因突变位点样本G6PD初筛值比较 例(%)
3 讨论
3.1 G6PD基因突变类型和频率G6PD是一种细胞溶质酶,在胞浆内和细胞膜上均有分布,几乎所有哺乳动物细胞中都含有G6PD。人类编码G6PD酶的DNA序列由13个外显子、12个内含子组成,位于X染色体端粒附近,其完整序列长达16.2Kb[6]。G6PD基因突变以点突变为主,世界范围已报道400多种突变[7]。我国以c.1388G>A、c.1376G>T及c.95A>G突变为主[8]。本研究发现,宁波地区最常见的前3位基因突变类型为c.1376G>T、c.1388G>A和c.1024C>T,共占75%;另外c.95A>G、c.871G>A和c.392G>T基因在宁波地区也有较高发生率,分别占10.36%、5.36%及3.21%,与海南省报道的相似[9]。虽然本研究与温州地区报道的c.1376G>T、c.1388G>A和c.1024C>T前3位略有不同[10],但前6位主要突变类型还是基本一致的。本研究还发现3例复合突变:1360C>T与1388G>A、95A>G与1024C>T、95A>G与1388G>A。这3例复合突变均发生于G6PD活性缺乏的女性,这提示该突变可能是双杂合子,需进一步需完善父母基因检测结合家系判定结果。
另外,在初筛阳性样本中检出两例未知突变,经基因测序发现是c.1375C>T、c.350C>T突变各1例,均未见报道。经数据库查询,c.350C>T突变为第5号外显子350位置C替换成T,导致氨基酸功能发生改变,丝氨酸转换成苯丙氨酸;c.1375C>T突变为第13号外显子1375位置C替换成T,精氨酸转换成半胱氨酸,均为错义突变。
3.2 G6PD基因型与酶活相关性G6PD缺乏症的遗传方式是一种伴性不完全显性遗传,男性患儿只有半合子,其多表现为酶活性显著缺乏,而女性因为有两条X染色体,故可有纯合子和杂合子2种。纯合子表现为酶活性严重缺乏,杂合子因X染色体存在随机失活现象,体内可同时存在酶缺乏和正常两种红细胞,且两者分布并不均[11],可表现为酶活性正常或仅轻度降低。本研究显示,G6PD酶活>2.4 U/g Hb时,男性样本突变携带率<20%,而女性高达20%~50%。可见,G6PD基因有突变携带的男性酶活性分布在2.4 U/g Hb以下居多;女性酶活性高至3.0 U/g Hb突变携带率才降至20%左右。假如不同性别使用同一酶活切值去界定阳性人群,则会导致绝大多数女性杂合子漏筛或男性出现过多假阳性,因此需要对不同性别分设不同阳性截断值。
本研究结果显示,871G>A和95A>G突变类型,其G6PD初筛>2.6 U/g Hb的比例显著高于1376G>T,这说明该种突变相对1376G>T,酶活性下降程度较低;而其他4种位点突变酶活性下降程度较高,后续可进一步进行挖掘探讨。
3.3 宁波地区筛查诊断模式探讨 由于G6PD缺乏症不完全显性的特性及突变分布的差异,不同省份对G6PD缺乏症的检出存在差异。本研究结果表明,宁波的G6PD新生儿人群突变携带率达0.36%(280/78338),低于海南、广东等高发地区[10,12],与本省温州地区相似[9],略高于温州的0.3%。宁波地区处于长江以南,随着近年城市化进程加快,人口流动日益频繁等因素,本地区的G6PD发病也确实不容忽视。G6PD缺乏症一旦发病病情严重,只能对症治疗,通过新生儿筛查及基因诊断可起到早诊断早预防的效果,并且对女性杂合子的检出可进一步指导生育。对于G6PD缺乏症的筛查诊断防治本研究提供了一定依据,也为后续基因型和表型相关研究提供了基础。
