黄芪多糖对小鼠慢性肾功能衰竭保护作用的机制研究
2021-08-04杨洁珂王丽于千惠刁会樊均明
杨洁珂,王丽,于千惠,刁会,樊均明,2△
慢性肾脏病(chronic kidney disease,CKD)在世界范围内已被视为重要公共卫生问题[1]。内皮细胞损伤、炎性细胞浸润、毒素蓄积进一步加快了终末期肾 病(end-stage renal disease,ESRD)发 展 的 进程[2-3]。近年来,随着“肠-肾轴”理论的提出,研究显示肠道微生态与CKD之间存在密切联系[4]。人体肠道由益生菌和机会致病菌维持着“动态平衡”[5]。研究发现,慢性肾功能衰竭患者中,尤其是ESRD患者,长期代谢蓄积体内的废物,致血液内毒素浓度过高而透过肠壁血管进入肠腔,引起肠道微生态改变,导致菌群失调[6]。而失调的菌群又可导致肠道功能紊乱,蛋白质降解受阻,毒素蓄积,从而进一步加重CKD的进展[7]。与此同时,随着测序技术的不断发展,长链非编码RNA(long non-coding RNA,lncRNA)的生物学功能受到关注。根据最新研究结果,lncRNA在CKD的发生发展中起着重要作用[8]。因此,探究lncRNA在“肠-肾轴”中的功能可能是一种新近治疗思路。黄芪多糖(astragalus polysaccharides,APS)是传统中药黄芪中的主要成分之一,具有明确的抗炎、抗氧化、抗纤维化、调节菌群等作用[9-11]。但黄芪多糖是否在肠、肾发挥联动调节作用仍未明确。本研究旨在从肠道微生态角度,探讨黄芪多糖对慢性肾功能衰竭小鼠的保护作用,以阐明其可能的治疗机制。
1 材料与方法
1.1 材料
1.1.1 实验动物6~8周龄雄性健康Balb/c小鼠30只,体质量18~22 g,购于成都达硕实验动物有限公司,实验动物生产许可证号:SCXK(川)2015-030。将所有动物置于温度和湿度受控的房间中饲养,温度(21.0±2.0)℃,湿度(65±5)%,自由饮水,并保持12 h/12 h昼夜循环光照。所有动物实验均根据西南医科大学动物伦理委员会批准的指导原则进行。
1.1.2 主要试剂与仪器 黄芪多糖(纯度:HPLC>95%;Macklin,A860847)。总RNA提取试剂盒(Tiangen,DP419);实时荧光定量逆转录聚合酶链反应(qPCR)试剂盒KitHiScript®ⅢRT SuperMix(+gDNA wiper)(Vazyme,7E34219);粪便基因组DNA提取试剂盒(Tiangen,DP328);肌酐(Scr)肌氨酸氧化酶法试剂盒(南京建成,C011-2-1);尿素氮(BUN)脲酶法试剂盒(南京建成,C013-2-1);尿蛋白定量(CBB法)测试盒(南京建成,C011-2-1);链霉卵白素-生物素标记山羊抗兔、山羊抗小鼠IgG二抗(中杉金桥,SP-9001、SP-9002);小鼠肿瘤坏死因子-α(TNF-α)、白细胞介素(IL)-1β、IL-6酶联免疫吸附测定(ELISA)试剂盒(Neobioscience,EMC102a、EMC001b、EMC004);鼠抗鼠紧密连接蛋白-1(ZO-1、Claudin-1、Occludin-1)单 克 隆 抗 体(Life technologies,QG215365、QD215273、QH215846),小鼠抗鼠核因子κB(NF-κB)单克隆抗体(Bioss,bs-0465R);兔抗鼠p-NF-κB单克隆抗体(CST,#3033);辣根过氧化物酶(HRP)标记的山羊抗兔、山羊抗小鼠IgG(H+L)(碧云天,A0208、A0216)二抗。ECL凝胶成像系统(BIO-RAD,USA);Light Cycler®480II PCR仪(Roche,Swiss);VS120虚 拟数字切片显微镜(Olympus,Japan)。
1.2 方法
1.2.1 分组及建模 将30只小鼠适应性喂养1周后采用随机数字表法分为假手术组、慢性肾功能衰竭模型组(模型组)和黄芪多糖干预组(APS组),每组10只。1%戊巴比妥钠(10 mL/kg)腹腔注射,无菌条件下分别沿后正中线左侧0.5 cm,肋弓下缘0.5 cm处做手术切口,游离左侧肾脏,模型组和APS组予以左肾切除并逐层缝合切口,假手术组只游离肾脏不切除并缝合切口。术后继续正常喂养1周,将模型组和APS组予以右肾的上1/3和下1/3结扎,将右肾等分为肾上、中、下三部分并缝合切口,假手术组同样只游离肾脏不结扎并缝合切口。术后正常喂养7周,随后APS组给予APS 100 mg(/kg·d)灌胃,其余2组给予等体积生理盐水连续灌胃。4周后行心脏取血并处死小鼠,处死前1 d各组小鼠置于代谢笼饲养,收集小鼠24 h尿液和粪便。处死后收集小鼠血清及右肾中部、结肠组织样本,部分置于4%多聚甲醛中固定24 h,随后乙醇梯度脱水、石蜡包埋切片;剩余部分冻存于-80℃冰箱进行后续分析。5/6肾切除模型造模期间,模型组死亡2只;灌胃期间模型组小鼠死亡2只,APS组死亡1只;小鼠出现死亡及时补充造模。
1.2.2 血清Scr、BUN、24 h尿蛋白定量检测 心脏采血后于4℃静置过夜,随后3 000 r/min离心15 min吸取上层血清。准备好收集的血清、尿液按照操作说明书分别检测血清Scr、BUN和24 h尿蛋白定量。
1.2.3 HE、天狼星红染色 将切片置于65℃烤箱烘烤2 h,予以二甲苯脱蜡,梯度乙醇复水。苏木素滴染2 min,自来水冲洗;伊红浸染1 min,自来水冲洗行HE染色。天狼星红浸染2 h,自来水冲洗,苏木素染核3 min,自来水冲洗行天狼星红染色。脱水透明封片后置于光镜下观察肾脏和肠道的结构改变及肾脏纤维沉积情况。
1.2.4 免疫组织化学染色检测紧密连接蛋白-1家族及p-NF-κB表达水平 切片置于65℃烤箱烘烤2 h,予以二甲苯脱蜡,梯度乙醇复水。予柠檬酸三钠抗原修复,晾至室温后滴加过氧化氢阻断剂10 min,封闭液15 min,滴加鼠抗ZO-1、Claudin-1、Occludin-1一抗,兔抗p-NF-κB一抗(1∶150),4℃孵育过夜,分别滴加对应抗小鼠、抗兔二抗后常温孵育1 h,DAB显色剂显色,苏木素染核数秒,无水乙醇脱水,二甲苯透明。封片后置于光镜下观察免疫复合物沉积情况。
1.2.5 ELISA检测IL-1β、IL-6和TNF-α表达水平 收集小鼠血清,按试剂盒操作说明分别检测各组IL-1β、IL-6和TNF-α细胞因子水平。
1.2.6 Western blot检测紧密连接蛋白-1家族及p-NF-κB蛋白水平 各组取适量结肠及肾脏皮质样本于RIPA蛋白裂解液和PMSF混合液中充分裂解30 min提取总蛋白,考马斯亮蓝法定量蛋白浓度,加Loading Buffer煮沸后取30 μg蛋白上样,SDS-PAGE分离转移至PVDF膜,5%BSA室温封闭1 h,加入相应的ZO-1、Claudin-1、Occludin-1、p-NF-κB、NF-κB(1∶1 000)、GAPDH(1∶50 000)一抗于4℃摇床过夜,次日TBST洗膜后加入带HRP标记山羊抗兔、抗鼠二抗(1∶2 000)于室温孵育1 h,滴加ECL发光液于Bio-rad凝胶成像系统成像。以Image J软件分析条带灰度值,计算目的蛋白与内参蛋白GAPDH的比值以及p-NF-κB与NF-κB的比值,进行定量分析。
1.2.7 总RNA及粪便基因组DNA的提取 各组取适量肾脏皮质样本,在Trizol裂解液中充分裂解,按照RNA simple Total RNA Kit试剂盒说明书提取总RNA,测RNA浓度,参照试剂盒说明书制备逆转录反应体系,将总RNA逆转录为cDNA。取适量新鲜粪便样本根据粪便基因组DNA提取试剂盒说明书提取粪便DNA,测定样品DNA浓度及A260/A280比值,比值在1.8左右为佳,否则重提。
1.2.8 qPCR检测促炎细胞因子、粪便菌群的表达量 在LightCycler®480Ⅱ仪器上进行qPCR检测肾脏组织中lncRNA Arid2-IR及促炎细胞因子IL-1β、IL-6和TNF-α的表达量,以GAPDH作为内参基因,通过比较循环阈值2-ΔΔCt分析结果。检测粪便中乳酸杆菌、双歧杆菌和大肠杆菌的表达量,采用细菌16 s rRNA V3区的扩增产物作为对照[12],通过循环阈值2-ΔΔCt分析结果。整个扩增程序:95℃10 min预变性,40个循环(95℃15 s,60℃15 s,72℃20 s)变性、退火、延伸;每个样本均设置3次重复,基因引物及细菌引物序列见表1,引物由上海生物工程有限公司合成。

Tab.1 The primer sequences of qPCR表1 qPCR所用引物序列
1.3 统计学方法 采用SPSS 21.0和GraphPad Prism 8软件对数据进行统计分析,数据均采用±s表示。2组间比较采用独立样本t检验,多组间比较采用One-way ANOVA,组间多重比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 APS对CKD小鼠肾功能的影响 与假手术组相比,模型组和APS组Scr、BUN和24 h尿蛋白总量均明显升高,而APS组Scr、BUN和24 h尿蛋白较模型组均显著下降(P<0.05),见表2。
Tab.2 Comparison of Scr,BUN and 24 h urine protein content between the three groups of mice表2各组小鼠Scr、BUN及24 h尿蛋白含量的比较(n=10,±s)
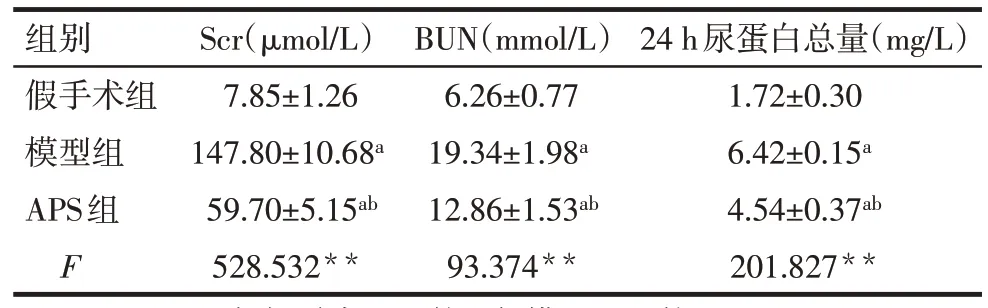
Tab.2 Comparison of Scr,BUN and 24 h urine protein content between the three groups of mice表2各组小鼠Scr、BUN及24 h尿蛋白含量的比较(n=10,±s)
**P<0.01,a与假手术组比较,b与模型组比较,P<0.05
组别Scr(μmol/L)BUN(mmol/L)24 h尿蛋白总量(mg/L)假手术组7.85±1.266.26±0.771.72±0.30模型组147.80±10.68a19.34±1.98a6.42±0.15a APS组59.70±5.15ab12.86±1.53ab4.54±0.37ab F528.532**93.374**201.827**
2.2 APS对CKD小鼠肾脏和结肠病理损伤的影响 肾脏HE染色结果显示,与假手术组相比,模型组肾小球明显萎缩硬化,肾小管扩张明显,伴随肾小管上皮细胞坏死脱落;APS组肾小管上皮细胞凋亡减少,管腔扩张程度减轻,肾小球形态稍有恢复,见图1。天狼星红染色结果显示,与假手术组相比,模型组染色阳性区域明显,肾纤维化程度严重;而APS组纤维化程度明显改善,见图2。HE染色结果显示,假手术组结肠黏膜上皮完整,绒毛排列整齐;模型组黏膜上皮脱落糜烂,绒毛缩短,数量减少,刷状缘不连续,固有层水肿明显,炎细胞浸润,红细胞增多;APS组绒毛高度有所恢复,刷状缘连续性有所改善,炎细胞减少,肠黏膜损伤较模型组有明显好转,但仍存在水肿,见图3。
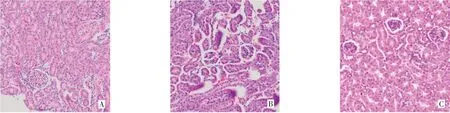
Fig.1 The effect of APS on mouse kidney tissue structure(HE staining,×200)图1 APS对小鼠肾脏组织结构的影响(HE染色,×200)
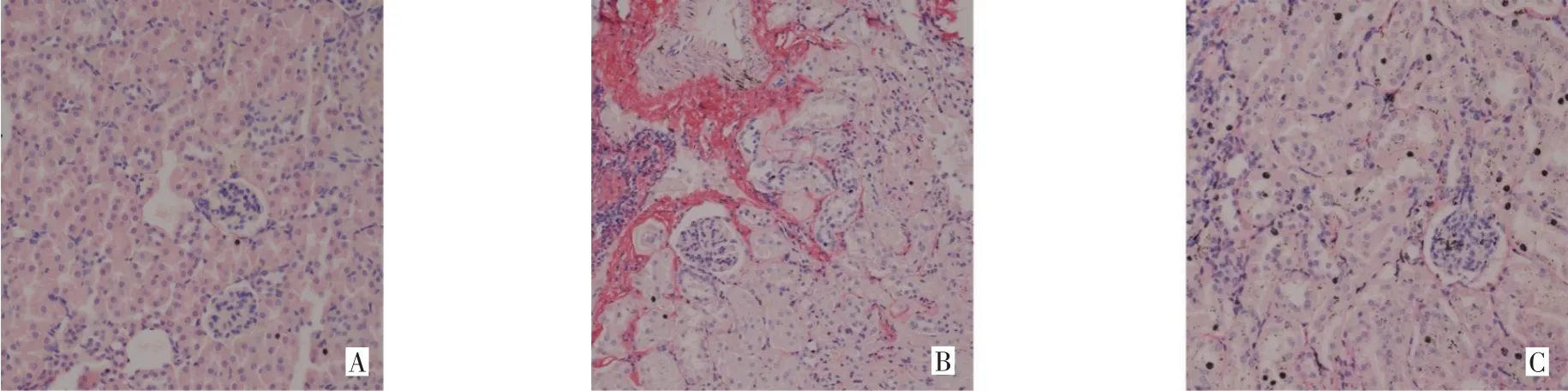
Fig.2 The effect of APS on kidney fiber deposition in mice(sirius red stain,×200)图2 APS对小鼠肾脏纤维沉积的影响(天狼星红染色,×200)

Fig.3 The effect of APS on the morphology of mouse colonic epithelium(HE staining,×200)图3 APS对小鼠结肠上皮组织形态的影响(HE染色,×200)
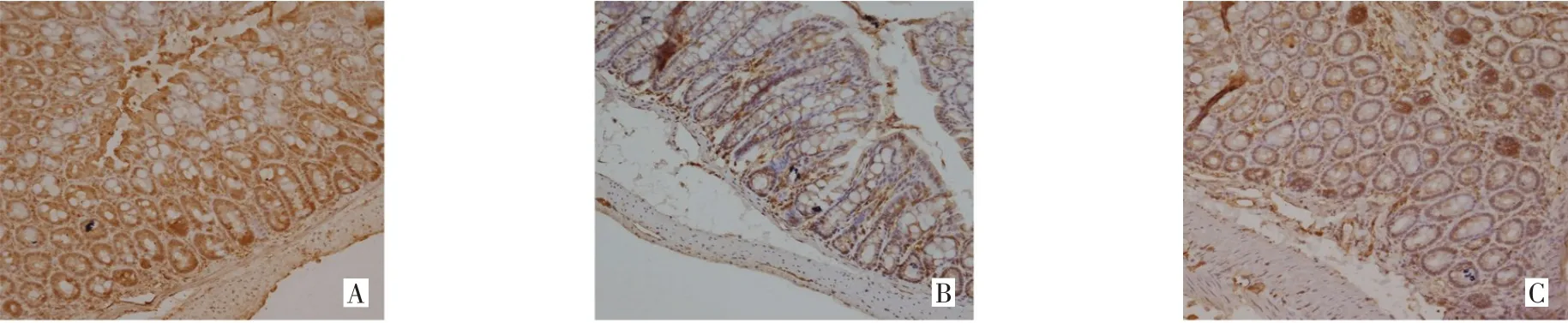
Fig.4 The effect of APS on Claudin-1 expression in mouse colon tissues(immunohistochemical staining,×200)图4 APS对小鼠结肠组织Claudin-1表达的影响(免疫组织化学染色,×200)
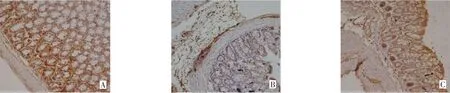
Fig.5 The effect of APS on Occludin-1 expression in mouse colon tissues(immunohistochemical staining,×200)图5 APS对小鼠结肠组织Occludin-1表达的影响(免疫组织化学染色,×200)

Fig.6 The effect of APS on ZO-1 expression in mouse colon tissues(immunohistochemical staining,×200)图6 APS对小鼠结肠组织ZO-1表达的影响(免疫组织化学染色,×200)

Fig.8 The effect of APS on the expression of p-NF-κB in mouse kidney tissues(immunohistochemical staining,×200)图8 APS对小鼠肾脏组织p-NF-κB表达的影响(免疫组织化学染色,×200)
2.3 APS对CKD小鼠结肠组织紧密连接蛋白Claudin-1、Occludin-1及ZO-1表达水平的影响 免疫组织化学染色结果显示,假手术组小鼠结肠组织Claudin-1、Occludin-1、ZO-1蛋白均呈蜂窝状或点状聚集,并均匀分布在肠上皮细胞顶端,模型组3种蛋白零散且分布不均,APS组可见紧密连接蛋白表达有所恢复并均匀分布,见图4~6。Western blot结果显示,与假手术组相比,模型组与APS组结肠组织Claudin-1、Occludin-1、ZO-1蛋白表达明显下降,而APS组3种蛋白的表达量较模型组明显升高(P<0.01),见图7、表3。

Fig.7 Protein levels of Claudin-1,Occludin-1 and ZO-1 in mouse colon tissue of the 3 groups图7 Western blot检测3组小鼠结肠组织中Claudin-1、Occludin-1和ZO-1蛋白水平
Tab.3 Comparison of expression levels of Claudin-1,Occludin-1 and ZO-1 in colonic tissues of mice between the three groups表3各组小鼠结肠组织Claudin-1,Occludin-1及ZO-1蛋白的表达水平比较 (n=10,±s)

Tab.3 Comparison of expression levels of Claudin-1,Occludin-1 and ZO-1 in colonic tissues of mice between the three groups表3各组小鼠结肠组织Claudin-1,Occludin-1及ZO-1蛋白的表达水平比较 (n=10,±s)
**P<0.01,a与假手术组比较,b与模型组比较,P<0.05
组别Claudin-1Occludin-1ZO-1假手术组1.69±0.131.32±0.102.01±0.09模型组0.59±0.07a0.48±0.04a1.06±0.11a APS组0.87±0.13ab0.56±0.02ab1.44±0.15ab F 77.892**177.000**49.022**
2.4 APS对CKD小鼠炎症反应的影响qPCR结果显示,与假手术组相比,模型组小鼠肾组织IL-1β、IL-6、TNF-α的表达水平明显升高,而APS组较模型组IL-1β、IL-6、TNF-α 的表达均明显下降(P<0.05),见表4。ELISA检测结果显示,与假手术组比较,模型组小鼠血清IL-1β、IL-6、TNF-α表达显著升高,而APS组较模型组IL-1β、IL-6、TNF-α表达下降(P<0.05),见表5。
Tab.4 Comparison of mRNA expression levels of IL-1β,IL-6 and TNF-α in renal tissues of mice between the three groups表4各组小鼠肾组织IL-1β、IL-6、TNF-α mRNA表达水平比较 (n=10,±s)

Tab.4 Comparison of mRNA expression levels of IL-1β,IL-6 and TNF-α in renal tissues of mice between the three groups表4各组小鼠肾组织IL-1β、IL-6、TNF-α mRNA表达水平比较 (n=10,±s)
*P<0.05,**P<0.01;a与假手术组比较,b与模型组比较,P<0.05
组别IL-1βIL-6TNF-α假手术组1.11±0.201.03±0.301.02±0.24模型组3.13±0.30a2.88±0.57a3.46±0.68a APS组2.07±0.21ab1.87±0.54ab2.42±0.31ab F 57.550**10.910*21.620**
Tab.5 Comparison of the serum expression levels of IL-1β,IL-6 and TNF-α between the three groups of mice表5各组小鼠血清中IL-1β、IL-6、TNF-α水平的比较(n=10,ng/L,±s)

Tab.5 Comparison of the serum expression levels of IL-1β,IL-6 and TNF-α between the three groups of mice表5各组小鼠血清中IL-1β、IL-6、TNF-α水平的比较(n=10,ng/L,±s)
**P<0.01,a与假手术组比较,b与模型组比较,P<0.05
组别IL-1βIL-6TNF-α假手术组0.03±0.010.12±0.140.23±0.04模型组0.11±0.02a1.12±0.23a0.82±0.08a APS组0.07±0.01ab0.66±0.14ab0.54±0.05ab F 21.384**24.943**77.734**
2.5 APS对肾脏组织NF-κB活化的影响 免疫组化结果显示,与假手术相比,模型组肾小球及肾间质有大量p-NF-κB沉积,而APS组p-NF-κB沉积较模型组明显减少,见图8。Western blot结果显示,假手术组、模型组和APS组p-NF-κB蛋白表达量分别为0.89±0.02、1.25±0.11和1.12±0.15,差异有统计学意义(n=10,F=8.671,P<0.05)。与假手术组相比,模型组p-NF-κB蛋白表达明显上升,而APS组p-NF-κB蛋白表达量较模型组明显下降(P<0.05),见图9。
2.6 APS对肾脏组织lncRNA Arid2-IR的影响 肾脏组织qPCR结果显示,假手术组、模型组和APS组lncRNA Arid2-IR表达水平分别为1.10±0.26、4.25±0.30和3.24±0.34(n=10,F=8.671,P<0.01)。与假手术组相比,模型组中lncRNA Arid2-IR的表达明显升高,而APS组中lncRNA Arid2-IR较模型组表达明显下降(P<0.05)。
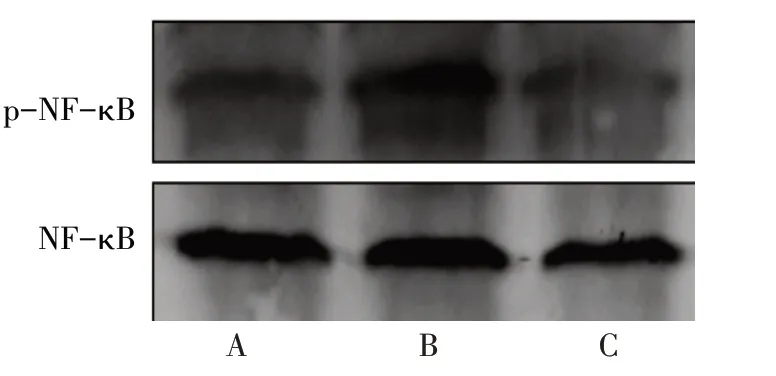
Fig.9 Protein levels of p-NF-κB in mouse kidney cortex of the three groups图9 Western blot检测3组小鼠肾皮质中p-NF-κB蛋白水平
2.7 APS对肠道菌群的调节作用 小鼠粪便的qPCR结果显示,与假手术组相比,模型组的大肠杆菌表达量明显升高,乳酸杆菌、双歧杆菌的表达量明显下降(P<0.05),而APS组乳酸杆菌、双歧杆菌的表达量较模型组有所升高,大肠杆菌的表达量出现下降(P<0.05),见表6。
Tab.6 Comparison of expression levels of probiotics and opportunistic pathogens in feces of each group of mice表6各组小鼠粪便中益生菌及机会致病菌表达量的比较(n=10,±s)

Tab.6 Comparison of expression levels of probiotics and opportunistic pathogens in feces of each group of mice表6各组小鼠粪便中益生菌及机会致病菌表达量的比较(n=10,±s)
**P<0.01,a与假手术组比较,b与模型组比较,P<0.05
组别 乳酸杆菌 双歧杆菌 大肠杆菌假手术组1.01±0.211.00±0.141.01±0.19模型组0.18±0.03a0.09±0.02a10.76±1.81a APS组0.55±0.01ab0.43±0.13ab5.64±1.28ab F 34.452**55.232**43.166**
3 讨论
人体肠道内有成百上千种菌群,健康的菌群环境可参与肠壁保护、毒素代谢、免疫调节等,失调的菌群环境亦可诱发、加重肾脏疾病[5]。这与中医认为慢性肾功能衰竭的基本病机为脾肾亏虚、湿浊内阻一致[13]。两者互为因果,相互作用。
在前期研究中[14],本课题组对我院临床用于治疗慢性肾病的中药复方黄芪三七合剂干预治疗5/6肾结扎诱导的慢性肾功能衰竭小鼠进行肠道菌群分析,发现肾功能衰竭小鼠细菌的类别发生了一定变化,其中有益菌双歧杆菌、乳酸杆菌的菌群丰度显著降低,但有害菌大肠杆菌的菌群丰度明显升高,与文献[15]报道相一致。研究表明,菌群失调可激活机体NF-κB,产生持续的炎症反应,破坏肠道黏膜机械屏障完整性,导致毒素通过肠壁血管进入血液,进一步加重CKD患者肾脏负荷[16-18]。目前,已有研究证实lncRNA可参与介导CKD的发生发展,其中lncRNA np_28496启动子区域包含了Smad3的结合位点,因其位于Arid2基因的内含子区域内,又称lncRNA Arid2-IR。研究发现该lncRNA在单侧输尿管梗阻小鼠诱导的肾功能衰竭模型肾脏中高表达[19]。另有研究发现其可促进NF-κB介导的炎症,NF-κB活化后可激活下游促炎因子如TNF-α、IL-1β和IL-6的表达,本课题组前期在糖尿病肾病模型中得到同样结论[20]。因此,通过介导lncRNA Arid2-IR“从肠治肾”也许是治疗慢性肾病的新的方向。
本研究进一步探索了黄芪主成分APS对“肠-肾轴”的调节作用。血清Scr、BUN、24 h尿蛋白检测结果显示黄芪多糖治疗可明显改善肾功能衰竭小鼠的肾脏功能;HE染色及天狼星红染色发现APS治疗后肾功能衰竭小鼠肾脏及结肠的病理损伤、肾脏纤维沉积均得到了改善;ELISA检测发现慢性肾功能衰竭模型组小鼠的炎性因子表达明显升高,提示机体处于持续的全身炎症状态。与此同时,模型组肠道紧密连接蛋白家族中Claudin-1、Occludin-1和ZO-1的表达均明显下降,而这些蛋白在维持肠道正常生理功能中起着重要作用,其表达量降低提示肠黏膜破坏严重,屏障功能受损[21]。经APS治疗后,慢性肾功能衰竭小鼠肾组织中lncRNA Arid2-IR及p-NF-κB水平均明显下调,炎性因子表达下降,而肠上皮紧密连接蛋白的表达增加。提示系统炎症以及肠道屏障损伤均明显改善,肠壁得到了修复,表明APS对慢性肾功能衰竭小鼠的结肠肠道屏障具有保护作用,且该作用可能通过抑制lncRNA Arid2-IR及其下游NF-κB的活化、减轻肾功能衰竭小鼠肾脏及全身的炎症反应而实现的,与Zhou等[19]的研究结果一致。进一步对小鼠粪便进行qPCR结果显示,APS组益生菌(双歧杆菌、乳酸杆菌)的基因表达量较模型组升高,而机会致病菌(大肠杆菌)的基因表达量明显下降,提示菌群环境亦得到改善,这与Dong等[11]以APS治疗腹泻小鼠的粪便菌群检测结果一致。为进一步探究APS对不同菌群的干预作用,后续研究还可将APS单味药治疗的慢性肾功能衰竭模型小鼠粪便进行包括宏基因组学在内的深度测序分析。
综上,APS能通过维持肠道微生态对慢性肾功能衰竭小鼠的肾脏起保护作用。其机制可能是通过调节肠道菌群的动态平衡恢复肠道的正常生理功能,下调lncRNA Arid2-IR表达以减轻NF-κB磷酸化诱导的系统微炎症状态,修复肠道黏膜损伤,恢复肠道屏障功能的保护作用,减轻肾脏负担,从而改善肾脏损伤。本研究结果为临床应用APS及黄芪治疗CKD患者,延缓其疾病进展提供了基础理论依据。
