急性高温胁迫对翘嘴鳜幼鱼抗氧化酶和消化酶活性及热休克蛋白基因表达的影响
2021-08-02张晨光丁炜东曹哲明邴旭文徐畅李良
张晨光 丁炜东 曹哲明 邴旭文 徐畅 李良

摘要:【目的】從抗氧化酶和消化酶活性及热休克蛋白基因表达层面明确高温胁迫对翘嘴鳜(Siniperca chuatsi)幼鱼生长及应激生理响应的影响,为实际生产中翘嘴鳜幼鱼培育提供可靠的参考依据。【方法】对2月龄翘嘴鳜幼鱼进行96 h的急性高温胁迫,通过预试验测试高起始致死温度(96 h-UILT50),采用突变升温方法设常温对照组(26.0 ℃)和急性高温胁迫组(36.0 ℃),分别于胁迫0、6、12、24、48和96 h后取样,使用生化试剂盒测定抗氧化酶和消化酶活性,并以实时荧光定量PCR检测热休克蛋白基因(HSP70α和HSP90α)的表达情况。【结果】翘嘴鳜幼鱼死亡率随水温的升高不断上升,其96 h-UILT50为36.22 ℃。在96 h的急性高温胁迫过程中,翘嘴鳜幼鱼肝脏超氧化物歧化酶(SOD)和过氧化氢酶(CAT)活性呈降低—升高—降低的变化趋势,谷丙转氨酶(GPT)活性及丙二醛(MDA)含量则表现出升高—降低—升高的变化趋势;在消化酶方面,翘嘴鳜幼鱼胃蛋白酶和肠道淀粉酶(AMS)活性呈降低—升高—降低的变化趋势,而肠道脂肪酶(LPS)活性呈升高—降低—升高的变化趋势。在急性高温胁迫过程中,翘嘴鳜幼鱼HSP70α基因相对表达量呈升高—下降的波动式变化趋势,于胁迫12 h时达最高值,在胁迫48 h时出现第2个峰值;HSP90α基因表达呈先升高后降低的变化趋势,于胁迫24 h时上调至最高值;但至胁迫96 h时HSP70α和HSP90α基因的相对表达量仍显著高于对照组翘嘴鳜幼鱼(P<0.05)。【结论】急性高温胁迫对翘嘴鳜幼鱼抗氧化酶和消化酶活性及热休克蛋白基因表达产生显著影响。其中,热休克蛋白基因HSP70α和HSP90α参与高温胁迫应答过程的生理调节,以应对高温胁迫对肝脏细胞的损伤,故可作为高温胁迫应答的标志物。
关键词: 翘嘴鳜;高温胁迫;抗氧化酶;消化酶;热休克蛋白基因
中图分类号: S965.127 文献标志码: A 文章编号:2095-1191(2021)03-0815-12
Effects of acute high temperature stress on antioxidant enzymes activity, digestive enzymes activity and gene expression of heat shock proteins in mandarin fish(Siniperca chuatsi)
ZHANG Chen-guang1, DING Wei-dong2, CAO Zhe-ming2, BING Xu-wen1,2*,
XU Chang1,2, LI Liang1,2
(1Wuxi Fisheries College, Nanjing Agricultural University, Wuxi, Jiangsu 214081, China; 2Fisheries Research
Center, Chinese Academy of Fishery Sciences, Wuxi, Jiangsu 214081, China)
Abstract:【Objective】The effects of high temperature stress on the growth and physiological response of juvenile mandarin fish(Siniperca chuatsi) were investigated from the aspects of antioxidant enzyme, digestive enzyme activities and heat shock protein family gene expression, which provided a reliable reference for the cultivation of juvenile S. chuatsi in practical production. 【Method】Two-month-old juvenile S. chuatsi was subjected to acute high temperature stress for 96 h. The high initial lethal temperature(96 h-UILT50) was measured by pre-test. The control group(26.0 ℃) and the acute high temperature stress group(36.0 ℃) were set by abrupt temperature rise method. Samples were taken at 0, 6, 12, 24, 48 and 96 h respectively after stress. Biochemistry kits were used to determine the activities of antioxidant and digestive enzymes, and real-time fluorescence quantitative PCR was used to detect the expression of heat shock protein family genes(HSP70α and HSP90α). 【Result】The mortality rate of juvenile S. chuatsi increased with the increase of water temperature, and its 96 h-UILT50 was 36.22 ℃. During the 96 h acute high temperature stress, the activities of superoxide dismutase(SOD) and catalase(CAT) in liver of S. chuatsi showed a decreasing, increasing and decreasing trend, while the activities of alanine aminotransferase(GPT) and the content of malondialdehyde(MDA) showed an increasing, decrea-sing and increasing trend.In terms of digestive enzymes, the activities of pepsin and intestinal amylase(AMS) of juvenile S. chuatsi showed a decreasing, increasing and decreasing trend, while the activities of intestinal lipase(LPS) showed an increasing, decreasing and increasing trend. In the process of acute heat stress, the relative expression of HSP70α gene in juvenile S. chuatsi showed a fluctuating trend of increasing to decreasing, and reached the highest value at 12 h of stress, and the second peak value appeared at 48 h of stress. The expression of HSP90α gene increased at first and then decreased, and reached the highest value at 24 h of stress. However, at 96 h of stress, HSP70α and HSP90α genes were still significantly higher than those of juvenile S. chuatsi in the control group(P<0.05). 【Conclusion】The activity of antioxidant enzyme, digestive enzyme and the expression of heat shock protein gene of juvenile S. chuatsiare significantly affec-ted by acute high temperature stress. Among them, heat shock protein genes HSP70α and HSP90α are involved in the phy-siological regulation of the response to high temperature stress to deal with the damage of liver cells under high temperature stress, so they can be used as markers of the response to high temperature stress.
Key words: Siniperca chuatsi; high temperature stress; antioxidant enzymes; digestive enzymes; heat shock protein gene
Foundation item: Jiangsu Agricultural Independent Innovation Fund Project[CX(17)3005]; Basic Research Pro-ject of Fisheries Research Center, Chinese Academy of Fishery Sciences(2019JBFZ01)
Effects of acute high temperature stress on antioxidant enzymes activity, digestive enzymes activity and gene expression of heat shock proteins in mandarin fish(Siniperca chuatsi)
ZHANG Chen-guang1, DING Wei-dong2, CAO Zhe-ming2, BING Xu-wen1,2*,
XU Chang1,2, LI Liang1,2
(1Wuxi Fisheries College, Nanjing Agricultural University, Wuxi, Jiangsu 214081, China; 2Fisheries Research
Center, Chinese Academy of Fishery Sciences, Wuxi, Jiangsu 214081, China)
Abstract:【Objective】The effects of high temperature stress on the growth and physiological response of juvenile mandarin fish(Siniperca chuatsi) were investigated from the aspects of antioxidant enzyme, digestive enzyme activities and heat shock protein family gene expression, which provided a reliable reference for the cultivation of juvenile S. chuatsi in practical production. 【Method】Two-month-old juvenile S. chuatsi was subjected to acute high temperature stress for 96 h. The high initial lethal temperature(96 h-UILT50) was measured by pre-test. The control group(26.0 ℃) and the acute high temperature stress group(36.0 ℃) were set by abrupt temperature rise method. Samples were taken at 0, 6, 12, 24, 48 and 96 h respectively after stress. Biochemistry kits were used to determine the activities of antioxidant and digestive enzymes, and real-time fluorescence quantitative PCR was used to detect the expression of heat shock protein family genes(HSP70α and HSP90α). 【Result】The mortality rate of juvenile S. chuatsi increased with the increase of water temperature, and its 96 h-UILT50 was 36.22 ℃. During the 96 h acute high temperature stress, the activities of superoxide dismutase(SOD) and catalase(CAT) in liver of S. chuatsi showed a decreasing, increasing and decreasing trend, while the activities of alanine aminotransferase(GPT) and the content of malondialdehyde(MDA) showed an increasing, decrea-sing and increasing trend.In terms of digestive enzymes, the activities of pepsin and intestinal amylase(AMS) of juvenile S. chuatsi showed a decreasing, increasing and decreasing trend, while the activities of intestinal lipase(LPS) showed an increasing, decreasing and increasing trend. In the process of acute heat stress, the relative expression of HSP70α gene in juvenile S. chuatsi showed a fluctuating trend of increasing to decreasing, and reached the highest value at 12 h of stress, and the second peak value appeared at 48 h of stress. The expression of HSP90α gene increased at first and then decreased, and reached the highest value at 24 h of stress. However, at 96 h of stress, HSP70α and HSP90α genes were still significantly higher than those of juvenile S. chuatsi in the control group(P<0.05). 【Conclusion】The activity of antioxidant enzyme, digestive enzyme and the expression of heat shock protein gene of juvenile S. chuatsiare significantly affec-ted by acute high temperature stress. Among them, heat shock protein genes HSP70α and HSP90α are involved in the phy-siological regulation of the response to high temperature stress to deal with the damage of liver cells under high temperature stress, so they can be used as markers of the response to high temperature stress.
Key words: Siniperca chuatsi; high temperature stress; antioxidant enzymes; digestive enzymes; heat shock protein gene
Foundation item: Jiangsu Agricultural Independent Innovation Fund Project[CX(17)3005]; Basic Research Pro-ject of Fisheries Research Center, Chinese Academy of Fishery Sciences(2019JBFZ01)
0 引言
【研究意義】水温是水产养殖过程中最重要的生态因子,水温变化均直接影响鱼类的生长、发育、摄食及代谢等生命活动(He et al.,2014)。高温是导致多种鱼类疾病产生的重要因素,尤其在有条件致病菌的环境条件下,当水温持续升高至超过鱼类耐受范围时,可导致鳃、肠胃及肝脏等部位组织丧失生理功能,鱼类体内的抗氧化酶系统遭到损伤,呼吸、消化及排泄系统被破坏,进而影响机体的正常生理机能(Yanar et al.,2019)。虽然大多数鱼类具备适应高温的能力,但若长期处于高温胁迫下,便会对鱼类造成不可逆的损伤,而引发鱼类疾病甚至造成死亡。因此,基于抗氧化酶和消化酶指标及热休克蛋白相关基因表达趋势,探讨鱼类对高温的耐受程度,可为揭示高温胁迫下鱼体的应对机制提供理论依据。【前人研究进展】当鱼类感受到水温变化时,便刺激下丘脑—垂体—肾间组织轴(Hypothalamus-pitui-tary-interrenal axis,HPI)作用,通过增加呼吸量和代谢率而维持新陈代谢及其稳态;但水温进一步升高超过其调节范围时,则导致机体代谢紊乱甚至死亡(辛苑茹等,2019)。在银鲳(Pampus argenteus)(谢明媚等,2015)、暗纹东方鲀(Takifugu obscurus)(Cheng et al.,2018)和葛氏鲈塘鳢(Perccottus glenii)(王博雅等,2020)等鱼类中均发现高温可引起抗氧化相关酶呈规律性表达,整体上表现为先升高后降低。已有研究表明,暴露于高温应激状态下的鱼类会出现肝细胞空泡化、细胞间边缘消失及细胞核水解等现象,随着水温升高加剧或胁迫时间延长最终引发其肝脏变性坏死(张思敏等,2018)。消化酶能直观表征鱼类的消化生理机能状况,反映鱼体对食物的吸收消化能力,且水温变化会极大影响新陈代谢等生理活动。至今,有关水温对鱼体消化酶活性影响的研究已有较多报道,如大黄鱼(Larimichthys crocea)(朱爱意和褚学林,2006)、驼背鲈(Cromileptes altivelis)(刘江华等,2014)及美洲鲥(Alosa sapidissima)(杨明等,2020),但鲜见针对翘嘴鳜(Siniperca chua-tsi)的相关报道。热休克蛋白家族生物学功能广泛,其中HSP70和HSP90基因能维持热休克蛋白的空间结构,修正并降解因外界刺激引发的蛋白错误折叠,在多肽链折叠及蛋白组装、加工、运输和降解等方面也发挥着重要作用(Encomio and Chu,2007;金新萍等,2018)。在团头鲂(Megalobrama amblycephala)(明建华等,2009)、虹鳟(Oncorhynchus mykiss)(周彦静等,2017)和西伯利亚鲟(Acipenser baeri)(王晓雯等,2019)的相关研究中,发现在高温胁迫下HSP70和HSP90基因均显著上调。【本研究切入点】翘嘴鳜统称为白鳜,隶属于鲈形目(Perciformes)真鲈科(Percichthyidae)鳜属(Siniperca),肉质细嫩鲜美,为高档的名特淡水鱼(卢薛等,2013;王鹏飞,2014;刘雨等,2019;徐畅等,2020)。由于国内养殖环境限制及自身特点等因素,翘嘴鳜幼鱼从投放到生长至商品鱼阶段一般在室外土塘进行。我国南方地区夏季高温,水温可升至37.0 ℃甚至更高,即高温胁迫已成为长三角地区翘嘴鳜养殖业健康发展的主要限制因素,但至今鲜见有关水温对其影响的研究报道。【拟解决的关键问题】探究高温胁迫下翘嘴鳜抗氧化酶和消化酶活性及热休克蛋白基因(HSP70α和HSP90α)的变化规律,从酶活性及基因表达层面明确高温胁迫对其生长及存活率的影响,为实际生产中翘嘴鳜幼鱼培育提供可靠的参考依据。
1 材料与方法
1. 1 试验用鱼及控温方式
2月龄翘嘴鳜幼鱼购自湖州市某翘嘴鳜良种场,在中国水产科学研究院无锡淡水研究中心养殖区暂养,置于水泥厂房中的循环水槽中喂养(400 L/桶)。挑选鳞片齐整、规格一致、平均体重9.23±0.34 g、平均体长5.21±0.25 cm的翘嘴鳜幼鱼共300尾,在室内循环水槽中暂养1周后开始试验,期间投喂小规格的鲮鱼幼鱼。翘嘴鳜幼鱼饲养在80 cm×45 cm×50 cm的复合材料桶中,试验期间保持水体溶解氧≥6 mg/L、氨氮≤0.05 mg/L、水温(26.0±0.5)℃、pH 7.3±0.4。养殖水温以制冷加热循环器(NH03801型,赛默飞世尔科技公司)进行调控,可控温度范围在4.0~35.0 ℃,辅以钛加热棒(500 W)。
1. 2 高起始致死温度(96 h-UILT50)测试
设26.0、30.0、34.0和38.0 ℃等4个温度梯度,每个温度梯度放入同规格翘嘴鳜幼鱼20尾,初始水温为(26.0±0.5)℃,按1.0 ℃/h的速度进行加温,以水温升高至预设值为时间零点(0 h),进行96 h的高温胁迫,胁迫结束后统计各温度处理组翘嘴鳜幼鱼的累计死亡率。利用Probit回归分析获得96 h死亡率达50%的温度,作为翘嘴鳜幼鱼高起始致死温度(Upper incipient lethal temperature 50,96 h-UILT50)(窦硕增等,2017)。观测翘嘴鳜幼鱼的行为反应,每3 h测量1次水温、溶解氧和pH,每24 h记录各平行的死亡鱼体数,并及时剔除死去的幼鱼(鱼体平躺或翻转且没有连续呼吸现象则认定为死亡)。
1. 3 高温胁迫试验
完成预试验后,根据96 h-UILT50设定对照组(26.0 ℃)和试验组(36.0 ℃),挑选鳞片齐整、体长相近的翘嘴鳜幼鱼180尾,分开置于6个塑料桶中饲养,对照组与试验组均设3个平行,每个塑料桶投放30尾幼鱼。其中,试验组须在水温升至36.0 ℃后再投放幼鱼,以达到急性高温胁迫的条件。试验期间停止投喂,持续充氧,利用HACH-LDO溶氧仪监测水体溶解氧含量变化,pH维持在7.3±0.4。在高温胁迫0、6、12、24、48和96 h时,每桶随机抽取3尾翘嘴鳜幼鱼,使用50 mg/L MS-222进行麻醉,剖解后采集翘嘴鳜的胃、肠道及肝脏组织,使用现配的生理盐水进行冲洗,经液氮处理后放入-80 ℃冰箱保存备用。
1. 4 样品处理
将各处理组采集的组织样品擦干水分,随即称重并记录,加入生理盐水后研磨,研磨液在4.0 ℃下4000 r/min离心10 min,取上清液,-80.0 ℃保存备用。采用南京建成生物工程研究所生产的生化试剂盒测定不同指标,总蛋白试剂盒(考马斯亮蓝法)测定翘嘴鳜幼鱼胃、肠道和肝脏总蛋白(TP)浓度,总超氧化物歧化酶(SOD)试剂盒测定SOD活性,过氧化氢酶(CAT)试剂盒测定CAT活性,谷丙转氨酶(GPT)试剂盒测定GPT活性,丙二醛(MDA)试剂盒测定MDA含量,胃蛋白酶试剂盒测定胃蛋白酶活性,淀粉酶(AMS)试剂盒测定AMS活性,脂肪酶(LPS)试剂盒测定LPS活性,酶活性单位采用U/mg或U/g表示。
1. 5 实时荧光定量PCR检测
称取0.1 g翘嘴鳜幼鱼肝脏置于RNAiso Plus中匀浆,并按说明进行总RNA提取。以RNA为模板,采用HiFiScript cDNA Synthesis Kit试剂盒反转录合成cDNA,-20.0 ℃保存备用。根据NCBI数据库中的Heat shock protein 70 alpha(HSP70α)和Heat shock protein 90 alpha(HSP90α)基因序列,以β-actin为内参基因,使用Primer Premier 6.0设计引物(表1),委托生工生物工程(上海)股份有限公司合成。实时荧光定量PCR反应体系20.0 μL:2×UltraSYBR Mixture 10.0 μL,正、反向引物各0.4 μL,cDNA模板0.8 μL,ddH2O 8.4 μL。扩增程序:95 ℃预变性10 min;95 ℃ 10 s,60 ℃ 30 s,72 ℃ 32 s,进行39个循环;60 ℃ 30 s,95 ℃ 15 s。根据实时荧光定量PCR扩增结果,采用2-ΔΔCt法计算目的基因的相对表达量。
1. 6 统计分析
采用SPSS 20.0以概率单位加权回归(Probit)法求出翘嘴鳜幼鱼的96 h-UILT50及95%置信区间,并进行单因素方差分析(One-way ANOVA)和Duncans多重比较。
2 结果与分析
2. 1 急性高温胁迫对翘嘴鳜幼鱼行为的影響
翘嘴鳜幼鱼对急性高温胁迫产生明显的行为反应,高温(34.0~38.0 ℃)组鱼体应激响应时间提前,鱼体反应程度剧烈。26.0 ℃组翘嘴鳜幼鱼在整个试验周期均相对安静,多数时间潜伏在桶底不动,偶尔上游捕食,泳速及泳态正常,体色呈较深的暗绿色;30.0 ℃组翘嘴鳜幼鱼在试验初期(0~24 h)相对安静,中期(48 h)后游动频率高于对照组,喜爱在水体中层游动,泳速、泳态及体色均正常;34.0 ℃组翘嘴鳜幼鱼试验初期(0~12 h)即表现活跃,游动频繁,喜欢向水面游动、滞留,后期活力变差,体色变浅,体表特有的色素斑点更明显;38.0 ℃组翘嘴鳜幼鱼试验初期(0~6 h)即表现烦躁,聚集在水体表面,呼吸急促且极易受惊,中期(48 h)鱼体运动频率明显下降,身体逐渐失去平衡,且有不同比例的个体反应迟钝,后期逐渐死亡,死亡个体症状:口张大,背脊鳍条竖起,体表有黏液渗出,斑纹消失。
2. 2 高起始致死温度(96 h-UILT50)的确定
26.0 ℃组翘嘴鳜幼鱼在96 h的试验过程中仅有1条死亡,30.0 ℃组累计有2条幼鱼在96 h内死亡,34.0 ℃组累计有5条幼鱼在96 h内死亡,38.0 ℃组累计有13条幼鱼在96 h内死亡(表2)。可见,翘嘴鳜幼鱼死亡率随水温的升高不断上升,其96 h-UILT50为36.22 ℃。
2. 3 急性高温胁迫对翘嘴鳜幼鱼抗氧化酶活性的影响
2. 3. 1 SOD活性 由图1可看出,在96 h的急性高温胁迫过程中,对照组翘嘴鳜幼鱼肝脏SOD活性无显著变化(P>0.05,下同),试验组翘嘴鳜幼鱼肝脏SOD活性则呈降低—升高—降低的变化趋势。在急性高温胁迫初始,试验组翘嘴鳜幼鱼肝脏SOD活性即迅速降低,至胁迫6 h时其SOD活性显著低于对照组翘嘴鳜幼鱼(P<0.05,下同),至胁迫12 h时降至最低值(23.33 U/mg);随后试验组翘嘴鳜幼鱼肝脏SOD活性呈明显上升趋势,于胁迫48 h时升至最大值(42.60 U/mg),与对照组翘嘴鳜幼鱼无显著差异;此后翘嘴鳜幼鱼肝脏SOD活性又表现出下降趋势,至胁迫96 h时显著低于对照组翘嘴鳜幼鱼。
2. 3. 2 CAT活性 由图2可看出,在96 h的急性高温胁迫过程中,对照组翘嘴鳜幼鱼肝脏CAT活性无显著变化,试验组翘嘴鳜幼鱼肝脏CAT活性变化趋势与SOD活性相似,也呈降低—升高—降低的变化趋势。在急性高温胁迫初始,试验组翘嘴鳜幼鱼肝脏CAT活性即迅速降低,于胁迫6 h时降至最低值(30.86 U/mg),与对照组翘嘴鳜幼鱼差异显著;至胁迫12 h时CAT活性仍显著低于对照组翘嘴鳜幼鱼,但随后明显上升,至胁迫48 h时升至最高值(66.27 U/mg),且显著高于对照组翘嘴鳜幼鱼;此后再次下降,至胁迫96 h时试验组翘嘴鳜幼鱼肝脏CAT活性低于对照组翘嘴鳜幼鱼,但差异不显著。
2. 3. 3 GPT活性 由图3可看出,在96 h的急性高温胁迫过程中,对照组翘嘴鳜幼鱼肝脏GPT活性无显著变化,试验组翘嘴鳜幼鱼肝脏GPT活性变化趋势则与SOD和CAT活性恰好相反,表现为升高—降低—升高的变化趋势。在急性高温胁迫初始,试验组翘嘴鳜幼鱼肝脏GPT活性即迅速上升,于胁迫6 h时升至最高值(142.83 U/g),显著高于对照组翘嘴鳜幼鱼;从胁迫12 h时开始持续下降,至胁迫48 h时降至最低值(23.03 U/g),且与对照组翘嘴鳜幼鱼差异显著;随后再次上升,至胁迫96 h时试验组翘嘴鳜幼鱼GPT活性高于对照组翘嘴鳜幼鱼,但二者间无显著差异。
2. 3. 4 MDA含量 由图4可看出,在96 h的急性高温胁迫过程中,对照组翘嘴鳜幼鱼肝脏MDA含量无显著变化,试验组翘嘴鳜幼鱼肝脏MDA含量则表现为升高—降低—升高。试验组翘嘴鳜幼鱼肝脏MDA含量在急性高温胁迫开始即持续上升,至胁迫6 h时显著高于对照组翘嘴鳜幼鱼,随后继续升高,于胁迫12 h时升至最高值(140.67 nmol/mg),且显著高于对照组翘嘴鳜幼鱼;随后试验组翘嘴鳜幼鱼肝脏MDA含量呈明显下降趋势,至胁迫48 h时降至最低值(74.23 nmol/mg),但与对照组翘嘴鳜幼鱼差异不显著;此后再次上升,至胁迫96 h时试验组翘嘴鳜幼鱼肝脏MDA含量高于对照组翘嘴鳜幼鱼,但差异不显著。
2. 4 急性高温胁迫对翘嘴鳜幼鱼消化酶活性的影响
2. 4. 1 胃蛋白酶活性 从图5可看出,在96 h的急性高温胁迫过程中,对照组翘嘴鳜幼鱼胃蛋白酶活性无显著变化,试验组翘嘴鳜幼鱼胃蛋白酶活性则呈降低—升高—降低的变化趋势。在急性高温胁迫初始,试验组翘嘴鳜幼鱼胃蛋白酶活性即迅速降低,于胁迫6 h时达最低值(27.80 U/mg),显著低于对照组翘嘴鳜幼鱼;随后表现为持续升高趋势,至胁迫24 h時其胃蛋白酶活性显著高于对照组翘嘴鳜幼鱼,并于胁迫48 h时达最高值(105.69 U/mg);此后试验组翘嘴鳜幼鱼胃蛋白酶活性又呈明显下降趋势,但仍显著高于对照组翘嘴鳜幼鱼。
2. 4. 2 AMS活性 从图6可看出,在96 h的急性高温胁迫过程中,对照组翘嘴鳜幼鱼肠道AMS活性无显著变化,试验组翘嘴鳜幼鱼肠道AMS活性变化趋势与胃蛋白酶相似,呈降低—升高—降低的变化趋势。试验组翘嘴鳜幼鱼肠道AMS活性在急性高温胁迫初始呈略微下降趋势,随后持续上升,至胁迫48 h时达最高值(0.97 U/mg),显著高于对照组翘嘴鳜幼鱼;此后出现明显下降趋势,但至胁迫96 h时试验组翘嘴鳜幼鱼肠道AMS活性仍显著高于对照组翘嘴鳜幼鱼。
2. 4. 3 LPS活性 从图7可看出,在96 h的急性高温胁迫过程中,对照组翘嘴鳜幼鱼肠道LPS活性无显著变化,试验组翘嘴鳜幼鱼肠道LPS活性变化趋势则与胃蛋白酶和AMS活性恰好相反,呈升高—降低—升高的变化趋势。在急性高温胁迫初始,试验组翘嘴鳜幼鱼肠道LPS活性即显著升高,至胁迫6 h时达最高值(23.33 U/g);随后呈持续降低趋势,于胁迫24 h时降至最低值(6.08 U/g),显著低于对照组翘嘴鳜幼鱼;此后再呈上升趋势,至胁迫96 h时试验组翘嘴鳜幼鱼LPS活性仍低于对照组翘嘴鳜幼鱼,但差异不显著。
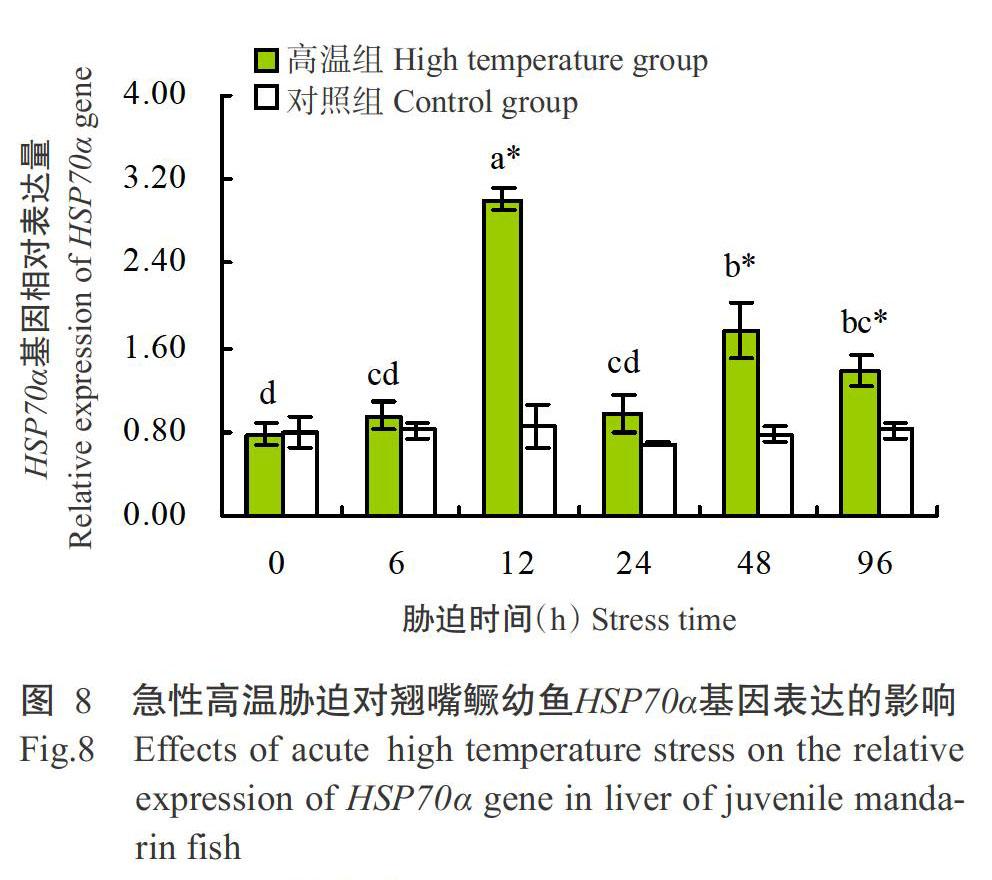
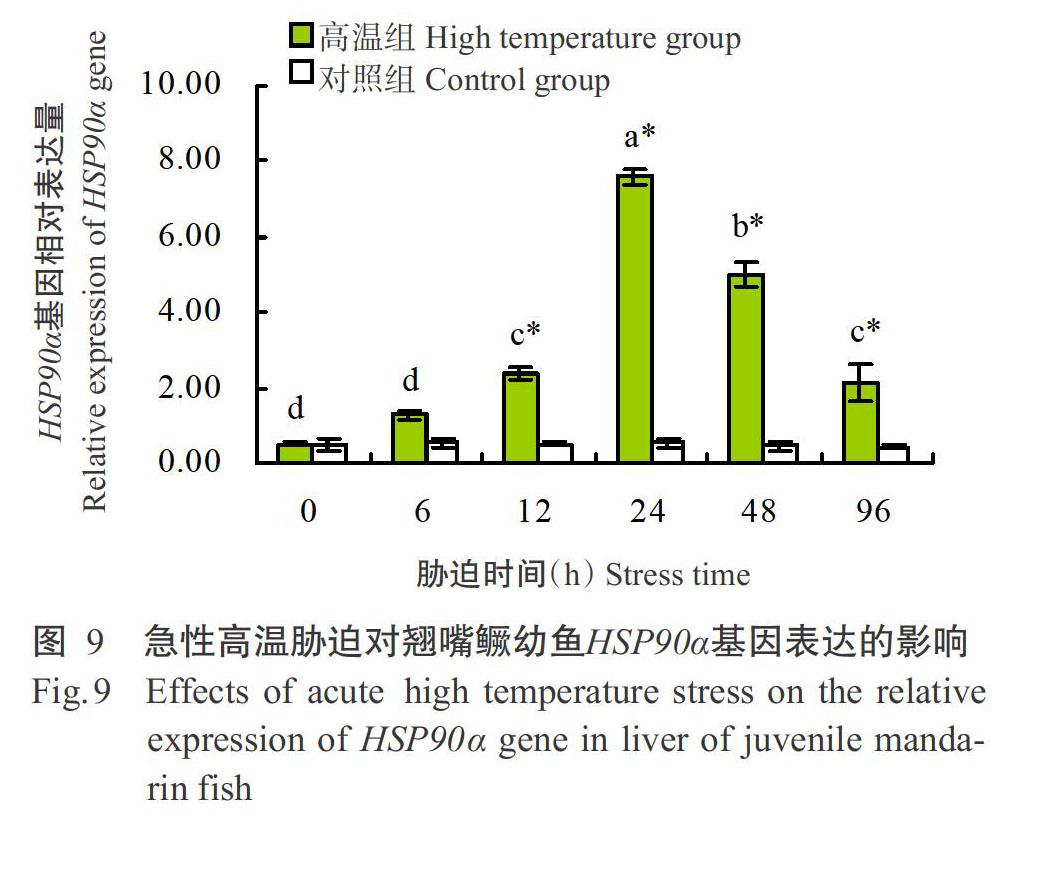
2. 5 急性高温胁迫对翘嘴鳜幼鱼热休克蛋白基因表达的影响
2. 5. 1 HSP70α基因 由图8可知,在96 h的急性高温胁迫过程中,对照组翘嘴鳜幼鱼HSP70α基因相对表达量无显著变化,而试验组翘嘴鳜幼鱼HSP70α基因相对表达量呈升高—下降的波动式变化趋势。随着急性高温胁迫时间的推移,试验组翘嘴鳜幼鱼HSP70α基因表达先持续上调,于胁迫12 h时达最高值;随后其表达快速下调,但在胁迫48 h时出现第2个峰值,其相对表达量显著高于对照组翘嘴鳜幼鱼;至胁迫96 h时翘嘴鳜幼鱼HSP70α基因相对表达量仍显著高于对照组翘嘴鳜幼鱼。
2. 5. 2 HSP90α基因 由图9可知,在96 h的急性高温胁迫过程中,对照组翘嘴鳜幼鱼HSP90α基因相对表达量也无显著变化,而试验组翘嘴鳜幼鱼HSP90α基因的表达呈先升高后降低的变化趋势。随着急性高温胁迫时间的推移,试验组翘嘴鳜幼鱼HSP90α基因表达先持续上调,至胁迫12 h时其相对表达量显著高于对照组翘嘴鳜幼鱼;于胁迫24 h时上调至最高值,随后开始逐渐下调,但至胁迫96 h时仍显著高于对照组翘嘴鳜幼鱼。
3 讨论
3. 1 高温胁迫对翘嘴鳜幼鱼存活及行为的影响
水温变化会直接影响鱼类的摄食、生长、代谢及免疫等生理活动,尤其是夏季和冬季水温变化较大,一旦突破鱼体的耐受极限即引起代谢紊乱,最终导致死亡(Bly and Clem,1992)。本研究结果表明,在急性升温方式下,高温胁迫(34.0和38.0 ℃)组翘嘴鳜幼鱼早期均表现出游动频繁、浮于水面和呼吸急促等特征,后期则逐渐减慢游动频率,失去平衡直至丧失运动能力,其96 h-UILT50为36.22 ℃。翘嘴鳜幼鱼对高温胁迫表现出的行为反应与大黄鱼(李庆昌等,2016)、虹鳟(夏斌鹏等,2017)及大菱鲆(Scophthalmus maximus)(孟振等,2020)等鱼类相同,而96 h-UILT50高于许氏平鲉(Sebastes schlegeli)(窦硕增等,2017)和西伯利亚鲟(王晓雯等,2019)等冷水系鱼类。王鹏飞(2014)研究发现,翘嘴鳜成鱼的半致死温度(LT50)为39.9 ℃,可能与鱼类个体大小有关,幼鱼的各器官组织尚未发育完全,因此抵御高温胁迫的能力较成鱼弱;也可能是升温方式不同所引起,本研究是采用突变高温胁迫方法,而王鹏飞(2014)采用1.2 ℃/h的梯度升温方式,鱼体已逐渐产生耐受性。Yanar等(2019)研究表明,鱼类的UILT50还受多种条件协同作用,包括分布地域、个体大小、驯化温度、升温速率及水质条件等。
3. 2 高温胁迫对翘嘴鳜抗氧化酶活性的影响
鱼类机体细胞生存需保持适度的氧化与抗氧化平衡,在适宜水体条件下,机体中的抗氧化系统能及时处理因生理代谢等活动产生的活性氧自由基(ROS)。当水温快速上升时,鱼类机体遭受严重应激而生成过多的ROS,一旦冗余ROS突破机体抗氧化系统的承受限度,就会导致组织器官应激损伤且易引发致死现象(胡静等,2016)。CAT和SOD是动物机体抗氧化及清理自由基作用较强的酶类,SOD可使ROS分解成H2O2,而CAT能将H2O2还原为氧分子和水分子,二者协同配合以确保细胞和机体的常规生理生化活动(Martínez-?lvarez et al.,2005)。本研究结果显示,翘嘴鳜幼鱼肝脏SOD和CAT活性在急性高温胁迫过程中均呈降低—升高—降低的变化趋势。胁迫6 h时翘嘴鳜幼鱼肝脏中的SOD和CAT活性显著降低,可能是急性高温胁迫初期水温急剧上升,翘嘴鳜幼鱼短时间内无法适应高温环境,其体内抗氧化系统被抑制,因此SOD和CAT活性呈显著下降趋势;胁迫24 h后,SOD和CAT活性显著升高,可能是翘嘴鳜幼鱼通过调节代谢等生理活动,逐渐适应高温环境,其体内抗氧化系统功能开始恢复;也可能是低氧所致,高温会降低水体的溶解氧含量,引起抗氧化酶SOD和CAT活性增加,以强化机体的抗氧化防御作用,迅速除去冗余的ROS而维持机体生理代谢平衡(Patterson et al.,2013;Varghese et al.,2017)。该阶段的抗氧化酶(SOD和CAT)活性变化趋势与在吉富罗非鱼(Oreochromis niloticus)(王海贞等,2012)和大口黑鲈(Micropterus salmoides)(孙永旭等,2019)等鱼类中的研究结果一致。急性高温胁迫48 h后,翘嘴鳜幼鱼肝脏SOD和CAT活性再次下降,至胁迫96 h时SOD活性已显著低于对照组翘嘴鳜幼鱼,究其原因可能是胁迫后期伴随高温胁迫时长的增加,翘嘴鳜幼鱼机体已产生免疫疲劳,体内ROS浓度远高于抗氧化系统调节阈值,肝脏遭受高温应激损伤,导致抗氧化能力下降,与刘峰等(2016)的研究结果一致。在整个急性高温胁迫过程中,翘嘴鳜幼鱼肝脏SOD和CAT活性随时间的变化趋势相似,故推测二者在功能上具有协同性(Livingstone,2001)。
王伟等(2012)研究发现,当机体遭受逆境胁迫生成冗余的ROS且未能及时清除时,会导致ROS与多不饱和脂肪酸(PUFA)反应,大量的脂质过氧化物(LPO)生成并最终分解为MDA。MDA的累积会导致生物膜流通性降低和细胞损伤,因此器官组织MDA含量通常是其脂质过氧化程度的体现,从侧面反映细胞遭受损伤的程度(史鲲鹏等,2018)。孙学亮等(2010)研究发现,在急性高温胁迫下,半滑舌鳎(Cynoglossus semilaevis)体内的MDA含量随胁迫时间延长呈先升高后降低的变化趋势,于胁迫6 h时达最高值;王艳妮等(2015)发现虹鳟体内的MDA含量在热应激开始后持续上升,应激4 h后显著高于试验初期。在本研究中,高温胁迫6 h后翘嘴鳜幼鱼肝脏MDA含量显著上升,至胁迫12 h时达最高值(140.67 nmol/mg),说明急性高温胁迫下翘嘴鳜幼鱼新陈代谢加快引起ROS浓度上升,机体无法及时清除,导致脂质过氧化水平加深,与抗氧化酶(SOD和CAT)活性在胁迫初期(0~12 h)显著下降相吻合;胁迫12 h后MDA含量逐渐回落,至胁迫48 h时降至最低值(74.23 nmol/mg),且明显低于对照组翘嘴鳜幼鱼,说明翘嘴鳜体内的抗氧化系统已被诱导激活,脂质过氧化程度开始降低。在逆境胁迫状态下,热休克蛋白作为分子伴侣表达量明显上调,具有保护生物体免受损伤的重要作用(周鑫等,2013)。但由于热休克蛋白的作用能力不足以应对长时间的高温胁迫,胁迫48 h后抗氧化链条被打破,抗氧化系统酶消除ROS的能力减退,而刺激脂质过氧化反应,故导致鱼体内MDA含量再次上升,在鲻鱼(Mugil cephalus)(吴庆元等,2014)和大泷六线鱼(Hexagrammos otakii)(樊英等,2020)的研究中也发现类似结果。
GPT是一种与氨基酸代谢相关的转氨酶,主要分布在细胞线粒体中,少量存在于血液中,可催化氨基转变为戊二酸酯和丙酮酸,其活性能间接体现蛋白合成与分解的情况(李开放和徐奇友,2019),是衡量肝细胞损伤的重要指标之一(Casillas et al.,2006)。当鱼类遭受氧化应激时,其体内肝细胞膜通透性迅速增加,合成胞浆酶输送至血液和组织中,表现为GPT活性迅速上升。在本研究中,急性高温胁迫下翘嘴鳜幼鱼肝脏GPT活性表现出升高—降低—升高的变化趋势,至高温胁迫12 h时试验组翘嘴鳜幼鱼肝脏GPT活性显著高于对照组翘嘴鳜幼鱼,表明急性高温胁迫已对鱼体肝脏细胞造成损伤。急性高温胁迫前期,翘嘴鳜幼鱼未能适应高温环境,其抗氧化系统被抑制,无法迅速清理冗余的ROS,但机体通过提高GPT活性,加速新陈代谢以提高对高温的适应能力,与刘超等(2016)的研究结果一致;胁迫12 h后GPT活性开始下降,至胁迫48 h时降至最低值(23.03 U/g),表明机体进行自我调节后得到恢复,抗氧化系统可继续发挥作用,及时清除体内冗余的ROS。可见,CAT、SOD和GPT可协同作用,但三者对高温的应激反应速率不一致,GPT最先响应,而SOD和CAT的反应存在滞后性,故推测这3种抗氧化酶在氧化应激系统中承担不同职能。
3. 3 高温胁迫对翘嘴鳜幼鱼消化酶活性的影响
消化酶能直接反映鱼体的消化生理机能,表征鱼类对体内食物的吸收消化能力。已有研究表明,消化酶活性受诸多因素影响,可因所属种类、生理状况、水体环境及养殖方式等不同而存在差异(Zhou et al.,2016;Hoseinifar et al.,2017)。翘嘴鳜为肉食性魚类,胃蛋白酶活性最能体现机体消化和吸收营养物质的状况。本研究结果表明,翘嘴鳜幼鱼胃蛋白酶活性在急性高温胁迫6 h内显著降低,随后持续上升,于胁迫48 h时达最高值(105.69 U/mg),说明经过短暂的适应后,高温胁迫并不会破坏胃蛋白酶活性,反而在某种程度上促进胃蛋白酶分泌,以分解更多蛋白为免疫相关酶的表达与翻译提供原料,与施兆鸿等(2016)发现银鲳幼鱼受高温胁迫后,其体内胃蛋白酶活性持续升高的结论一致。LPS是脂质代谢过程中极其重要的酶类,催化分解脂肪,产生甘油一酯、甘油二酯及游离脂肪酸,最终转化为脂肪酸和甘油而为鱼体供能。刘玲等(2018)在驼背鲈和鞍带石斑鱼(Epinephelus lanceolatus)杂交子代鼠龙斑的研究中也发现,在35.0 ℃高温环境下鼠龙斑肠道LPS活性呈先升后降的变化趋势。翘嘴鳜幼鱼肠道LPS活性在短时间内显著升高,随后持续降低,说明在急性高温胁迫下机体清除氧化自由基需消耗比正常代谢更多的能量,前期翘嘴鳜幼鱼主要依靠消耗脂肪来提供能量,因此高温胁迫前期(6 h)LPS活性上升而为抗氧化系统供能;后期由于高温胁迫时间延长,机体自身已无法清除冗余的ROS,抗氧化系统及免疫系统受损,同时消化系统因组织结构发生变性坏死而导致LPS活性降低。在AMS方面,试验组翘嘴鳜幼鱼肠道AMS活性在胁迫初期(6 h)略有下降,随后持续上升,并于胁迫48 h时达最高值(0.97 U/mg)。在半滑舌鳎(田相利等,2008)、蓝点马鲛鱼(Scomberomorus niphoius)(陈健等,2015)和小黄鱼(Larimichthys polyactis)(刘峰等,2016)等相关研究中也发现高温胁迫会诱导肠道AMS活性上升,说明鱼体需通过水解淀粉来弥补因应对高温失去的能量。
本研究結果显示,急性高温胁迫下翘嘴鳜幼鱼消化酶(胃蛋白酶、LPS和AMS)活性均有降低现象,但对高温的敏感性存在差异。至高温胁迫结束时,LPS活性恢复到与对照组翘嘴鳜幼鱼相当的水平,表现出对高温环境的适应;AMS和胃蛋白酶活性至胁迫96 h时仍显著高于对照组翘嘴鳜幼鱼,说明翘嘴鳜幼鱼可通过增加这2种消化酶活性,分解淀粉和蛋白质以应对高温环境。
3. 4 高温胁迫对翘嘴鳜幼鱼热休克蛋白基因表达的影响
热休克蛋白也称应激蛋白,在多种生物体中均有发现,能有效提升机体应对温度胁迫、低氧胁迫、重金属胁迫及饥饿胁迫等恶劣环境的能力(Basu et al.,2002)。本研究结果表明,经急性高温胁迫后翘嘴鳜幼鱼HSP70α基因表达量显著增加,于胁迫12 h时升达最高值,随后整体上呈降低趋势,与已报道的部分水生生物试验结果一致。苏岭等(2010)研究发现,在28.0 ℃高温胁迫下,鲫鱼(Carassius auratus)HSP70基因开始逐渐上调,至胁迫4 h时达最高值,随后逐渐下调并于胁迫48 h时降至最初值;Ming等(2010)研究证实,在34.0 ℃高温下胁迫24 h,团头鲂肝脏HSP70基因相对表达量呈先上升后降低的变化趋势;强俊等(2012)研究发现,尼罗罗非鱼(Oreochromis niloticus)经35.0 ℃高温胁迫6 h,其肝脏中的HSP70基因上调表达至最高值,随后24 h内逐渐降低。可见,改变HSP70基因表达量是鱼类应对高温胁迫的主要途径,胁迫初期高温胁迫引起组织中变性蛋白和异常蛋白数目增多,正常状态的蛋白平衡被打破,从而导致部分维持正常生理功能的酶活性下降甚至丧失,HSP70基因通过多种途径调节,诱导肝脏细胞中HSP70含量升高。胁迫后期HSP70基因表达量回落,或许是由于HSP70基因对细胞的保护作用存在局限性,胁迫程度超过其调节范围时,肝脏细胞膜结构和蛋白质组成改变,而干扰HSP70基因在细胞内的分布,因此对机体的保护能力下降。本研究结果表明,翘嘴鳜幼鱼HSP70α基因表达受温度调节,以此确保组织器官不被损害及维持机体内部功能的稳定,因此HSP70被视为评估应激水平的生物标志之一(Jonsson et al.,2006)。
HSP90基因存在于真核细胞中,能与400多种蛋白相结合,在不同胁迫条件下,如高温胁迫或低温胁迫均能诱导其上调表达。Wu等(2012)研究发现,草鱼(Ctenopharyngodon idella)在高温或低温胁迫下均会显著上调多种组织中的HSP90基因表达量;生安志等(2016)研究表明,牙鲆(Paralichthys olivaceus)经28.0 ℃高温胁迫1 h,其肝脏中的HSP90基因相对表达量显著升高;Yan等(2017)研究表明,在高温胁迫下泥鳅(Misgurnus anguillicaudatus)HSP90基因表达迅速上调;张德康等(2020)研究发现,美洲鲥经7.0 ℃低温胁迫12 h,其HSP90基因表达显著上调。在本研究中,翘嘴鳜幼鱼HSP90α基因在急性高温胁迫后显著上调,并于胁迫24 h时达最高值,为对照组翘嘴鳜幼鱼的14.06倍,说明高温胁迫会诱导HSP90α大量合成,且在初期发挥细胞防御功能。随后HSP90α基因表达逐渐下调,但至胁迫结束时仍显著高于对照组翘嘴鳜幼鱼,或许是由于氧化损伤较严重已超过鱼体调节范围,且长时间会引发免疫水平降低及代谢紊乱现象,从而引起HSP90α基因表达下调。HSP90α基因可通过参与热休克转录因子的聚合作用以激活目标基因,在高温环境下保护细胞不受损伤,也可能是通过抑制高温诱导细胞凋亡来实现(Yavelsky et al.,2004)。
4 结论
急性高温胁迫对翘嘴鳜幼鱼抗氧化酶和消化酶活性及热休克蛋白基因表达产生显著影响。在高温胁迫过程中,CAT、SOD和GPT等3种抗氧化酶在氧化应激系统中承担不同职能,AMS和胃蛋白酶2种消化酶通过分解淀粉和蛋白质以应对高温环境;热休克蛋白基因HSP70α和HSP90α参与高温胁迫应答过程的生理调节,以应对高温胁迫对肝脏细胞的损伤,故可作为高温胁迫应答的标志物。
参考文献:
陈健,郑春静,桑卫国. 2015. 温度和pH对不同日龄蓝点马鲛鱼仔鱼消化酶活性的影响[J]. 宁波大学学报(理工版),28(3):9-12. [Chen J,Zheng C J,Sang W G. 2015. Effects of temperature and pH on digestive enzyme day-var-ying activity larvae of Scomberomorus niphoius[J]. Journal of Ningbo University(Natural Science & Engineering Edition),28(3):9-12.]
窦硕增,南鸥,曹亮,宋骏杰,田洪林,刘永叶. 2017. 石岛湾四种常见鱼类的热耐受性比较研究[J]. 海洋科学,41(9):56-64. doi:10.11759//hykx2017031002. [Dou S Z,Nan O,Cao L,Song J J,Tian H L,Liu Y Y. 2017. A comparative study of the thermal tolerance of four common fish species in Shidao Bay,the Yellow Sea[J]. Marine Scien-ces,41(9):56-64.]
樊英,王晓璐,于晓清,刘洪军,叶海斌,王淑娴,刁菁,胡发文,菅玉霞. 2020. 地衣芽孢杆菌对大泷六线鱼生长、肠道消化酶、血清非特异性免疫及抗病力的影响[J]. 渔业科学进展,41(1):63-73. doi:10.19663/j.issn.2095-9869. 20191111001. [Fan Y,Wang X L,Yu X Q,Liu H J,Ye H B,Wang S X,Diao J,Hu F W,Jian Y X. 2020. Effect of Bacillus licheniformis on growth,intestinal digestive enzymes,serum non-special immune and resistance against Aeromonas salraonicida in fat greenling,Hexagrammos otakii[J]. Progress in Fishery Sciences,41(1):63-73.]
胡静,叶乐,吴开畅,王雨. 2016. 急性盐度胁迫对克氏双锯鱼幼鱼血清皮质醇浓度和Na+-K+-ATP酶活性的影响[J]. 南方水产科学,12(2):116-120. doi:10.3969/j.issn.2095-0780. 2016.02.017. [Hu J,Ye L,Wu K C,Wang Y. 2016. Effect of acute salinity stress on serum cortisol and activity of Na+/K+-ATPase of juvinile Amphiprion clarkii[J]. South China Fisheries Science,12(2):116-120.]
金新萍,谢倩,吕斌,曹诣斌. 2018. 金鱼HSC70和HSP40基因克隆及其原核表达[J]. 南方农业学报,49(2):367-374. doi:10.3969/j.issn.2095-1191.2018.02.25. [Jin X P,Xie Q,Lü B,Cao Y B. 2018. Cloning and prokaryotic expression of genes HSC70 and HSP40 in goldfish[J]. Journal of Southern Agriculture,49(2):367-374.]
李开放,徐奇友. 2019. 白藜芦醇对松浦镜鲤生长性能、肠道消化酶活性、肝脏抗氧化指标和血清生化指标的影响[J]. 动物营养学报,31(4):1833-1841. doi:10.3969/j.issn. 1006-267x.2019.04.042. [Li K F,Xu Q Y. 2019. Effects of resveratrol on growth performance,intestinal digestive enzyme activity,liver antioxidant index and serum biochemical index of Songpu mirror carp[J]. Chinese Journal of Animal Nutrition,31(4):1833-1841.]
李慶昌,陈小明,刘贤德. 2016. 突变高温胁迫对大黄鱼血清生理指标的影响[J]. 渔业研究,38(6):437-444. doi:10.14012/j.cnki.fjsc.2016.06.002. [Li Q C,Chen X M,Liu X D. 2016. Acute heat stress on the influence of large yellow croaker(Larimichthys crocea) serum physiological indicators[J]. Journal of Fisheries Research,38(6):437-444.]
刘超,吴富村,林思恒,阙华勇,张国范. 2016. 高温刺激导致虾夷扇贝死亡因素的探究[J]. 海洋科学,40(11):91-98. doi:10.11759/hykx20151008001. [Liu C,Wu F C,Lin S H,Que H Y,Zhang G F. 2016. Pilot study on reasons for yesso scallops(Patinopecten yessoensis) survival after heat shock[J]. Marine Sciences,40(11):91-98.]
刘峰,刘阳阳,楼宝,陈睿毅,詹伟,徐麒翔,马涛,徐冬冬,王立改,毛国民. 2016. 温度对小黄鱼体内抗氧化酶及消化酶活性的影响[J]. 海洋学报,38(12):76-85. doi:10. 3969/j.issn.0253-4193.2016.12.008. [Liu F,Liu Y Y,Lou B,Chen R Y,Zhan W,Xu Q X,Ma T,Xu D D,Wang L G,Mao G M. 2016. Effects of water temperature on antioxi-dant and digestive enzymes activities in Larimichthys poly-actis[J]. Haiyang Xuebao,38(12):76-85.]
刘江华,区又君,李加儿,吴水清. 2014. 温度和pH对驼背鲈消化酶活力的影响[J]. 中山大学学报(自然科学版),53(3):95-100. doi:10.13471/j.cnki.acta.snus.2014.03.022. [Liu J H,Qu Y J,Li J E,Wu S Q. 2014. Effects of temperature and pH on the activities of digestive enzymes in Cromileptes altivelis[J]. Acta Scientiarum Naturalium Universitatis Sunyatseni,53(3):95-100.]
刘玲,陈超,李炎璐,刘莉,陈建国,李文升,马文辉. 2018. 短期温度胁迫对驼背鲈(♀)×鞍带石斑鱼(♂)杂交子代幼鱼抗氧化及消化酶活性的影响[J]. 渔业科学进展,39(2):59-66. [Liu L,Chen C,Li Y L,Liu L,Chen J G,Li W S,Ma W H. 2018. Effects of short-term temperature stress on antioxidant and digestive enzymes of hybrid progeny (Cromileptes altivelis Valenciennes ♀×Epinephelus lanceolatus ♂)[J]. Progress in Fishery Sciences,39(2):59-66.]
刘雨,丁炜东,曹哲明,邴旭文,徐畅,杨帆,张晨光,谷心池,孙阿君. 2019. 急性氨氮胁迫对翘嘴鳜幼鱼抗氧化酶活性及炎症反应相关基因表达的影响[J]. 南方农业学报,50(8):1860-1868. doi:10.3969/j.issn.2095-1191.2019.08. 29. [Liu Y,Ding W D,Cao Z M,Bing X W,Xu C,Yang F,Zhang C G,Gu X C,Sun A J. 2019. Effects of acute ammonia nitrogen stress on antioxidant enzymes activity and gene expression involved in inflammation of juvenile Siniperca chuatsi[J]. Journal of Southern Agriculture,50(8):1860-1868.]
卢薛,孙际佳,王海芳,罗渡,侯晓翠,刘凌志,李桂峰. 2013. 大眼鳜与翘嘴鳜正反交及其正交子代自交的胚胎发育观察[J]. 中国水产科学,20(5):975-981. doi:10.3724/SP.J.1118.2013.00975. [Lu X,Sun J J,Wang H F,Luo D,Hou X C,Liu L Z,Li G F. 2013. Observations on embryonic development of reciprocal hybrids of Siniperca kneri Garman×Siniperca chuatsi Basilewsky and F2 of S. kneri females×S. chuatsi males F1[J]. Journal of Fishery Sciences of China,20(5):975-981.]
孟振,张鸿丽,刘新富,贾玉东,刘滨,曲江波. 2020. 急性热应激对大菱鲆血液生化指标的影响[J]. 海洋科学,44(1):122-131. doi:10.11759/hykx20190814001. [Meng Z,Zhang H L,Liu X F,Jia Y D,Liu B,Qu J B. 2020. Effect of acute heat stress on plasma biochemical indexes in turbot Scophthalmus maximus[J]. Marine Sciences,44(1):122-131.]
明建华,谢骏,刘波,何义进,周群兰,潘良坤,俞菊华,徐跑. 2009. 团头鲂HSP70 cDNA的克隆、序列分析以及热应激对其mRNA表达的影响[J]. 中国水产科学,16(5):635-648. [Ming J H,Xie J,Liu B,He Y J,Zhou Q L,Pan L K,Yu J H,Xu P. 2009. Cloning,sequence analysis of HSP70 cDNA and effects of heat stress on its mRNA expression in Megalobrama amblycephala[J]. Journal of Fishery Sciences of China,16(5):635-648.]
强俊,杨弘,王辉,徐跑,何杰. 2012. 急性温度应激对吉富品系尼罗罗非鱼(Oreochromis niloticus)幼鱼生化指标和肝脏HSP70 mRNA表达的影响[J]. 海洋与湖沼,43(5):943-953. [Qiang J,Yang H,Wang H,Xu P,He J. 2012. The effect of acute temperature stress on biochemical indices and expression of liver HSP70 mRNA in GIFT nile tilapia juveniles(Oreochromis niloticus)[J]. Oceanologia et Limnologia Sinica,43(5):943-953.]
生安志,鞠辉明,李贵阳,李杰,莫照兰. 2016. 牙鲆(Paralichthys olivaceus)HSP90 mRNA在温度刺激和鳗弧菌感染下的表达特征[J]. 渔业科学进展,37(5):1-8. doi:10. 11758/yykxjz.20150326001. [Sheng A Z,Ju H M,Li G Y,Li J,Mo Z L. 2016. Expression patterns of HSP90 of Paralichthys olivaceusin response to temperature treatment and Vibrio anguillarum infection[J]. Progress in Fishery Sciences,37(5):1-8.]
施兆鴻,谢明媚,彭士明,张晨捷,高权新. 2016. 温度胁迫对银鲳(Pampus argenteus)幼鱼消化酶活性及血清生化指标的影响[J]. 渔业科学进展,37(5):30-37. doi:10.11758/yykxjz.20150617001. [Shi Z H,Xie M M,Peng S M,Zhang C J,Gao Q X. 2016. Effects of temperature stress on activities of digestive enzymes and serum biochemical indices of Pampus argenteus juveniles[J]. Progress in Fishery Sciences,37(5):30-37.]
史鲲鹏,董双林,周演根,高勤峰,孙大江. 2018. 不同倍性虹鳟幼鱼对急性温度胁迫的抗氧化响应[J]. 应用生态学报,29(9):3102-3110. doi:10.13287/j.1001-9332.201809. 001. [Shi K P,Dong S L,Zhou Y G,Gao Q F,Sun D J. 2018. Antioxidant responses of rainbow trout with diffe-rent ploidies to acute temperature stress[J]. Chinese Journal of Applied Ecology,29(9):3102-3110.]
蘇岭,李绍戊,王荻,刘红柏,卢彤岩,尹家胜. 2010. 半定量RT-PCR方法检测热应激对鲫鱼肝脏中HSP70 mRNA含量的影响[J]. 华北农学报,25(S):100-104. [Su L,Li S W,Wang D,Liu H B,Lu T Y,Yin J S. 2010. Semi-quantitative RT-PCR method of detection of heat stress on fish liver content of HSP70 mRNA[J]. Acta Agriculturae Boreali-Sinica,25(S):100-104.]
孙学亮,邢克智,陈成勋,王庆奎,于学全,胡金城. 2010. 急性温度胁迫对半滑舌鳎血液指标的影响[J]. 水产科学,29(7):387-392. doi:10.16378/j.cnki.1003-1111.2010.07.002. [Sun X L,Xing K Z,Chen C X,Wang Q K,Yu X Q,Hu J C. 2010. The effects of acute temperature stress on blood parameters in half-smooth tongue-sole(Cynoglossus semilaevis)[J]. Fisheries Science,29(7):387-392.]
孙永旭,董宏标,王文豪,曹明,段亚飞,李华,刘青松,张家松. 2019. 温度对大口黑鲈幼鱼不同组织抗氧化能力及免疫相关蛋白表达的影响[J]. 生态科学,38(3):18-25. doi:10.14108/j.cnki.1008-8873.2019.03.003. [Sun Y X,Dong H B,Wang W H,Cao M,Duan Y F,Li H,Liu Q S,Zhang J S. 2019. Effects of temperature on antioxidant capacity and immune associated protein expression in different tissues and organs of juvenile(Micropterus salmoides)[J]. Ecological Science,38(3):18-25.]
田相利,任晓伟,董双林,王国栋,房景辉. 2008. 温度和盐度对半滑舌鳎幼鱼消化酶活性的影响[J]. 中国海洋大学学报,38(6):895-901. doi:10.16441/j.cnki.hdxb.2008.06. 006. [Tian X L,Ren X W,Dong S L,Wang G D,Fang J H. 2008. Studies on the specific activities of digestive enzymes of Cynoglossus semilaevis Günther at different salinities and temperatures[J]. Periodical of Ocean University of China,38(6):895-901.]
王博雅,郭策,黄璞祎,柴龙会. 2020. 急性升温胁迫与恢复对葛氏塘鳢抗氧化酶活性的影响[J]. 水产科学,39(3):394-399. doi:10.16378/j.cnki.1003-1111.2020.03.012. [Wang B Y,Guo C,Huang P Y,Chai L H. 2020. Effects of acute raising temperature stress and recovery on antioxidant enzyme activities of amur sleeper Perccottus glenii[J]. Fishe-ries Science,39(3):394-399.]
王海贞,王辉,李瑞伟,梁国栋. 2012. 温度和盐度对吉富罗非鱼幼鱼肠道两种抗氧化酶活力的联合效应[J]. 广东海洋大学学报,32(1):47-53. [Wang H Z,Wang H,Li R W,Liang G D. 2012. Combined effect of temperature and salinity on two kinds intestinal antioxidant enzymes of GIFT tilapia juveniles(Oreochromis niloticus)[J]. Journal of Guangdong Ocean University,32(1):47-53.]
王鹏飞. 2014. 鳜热休克蛋白和低氧反应基因的克隆和表达研究[D]. 广州:中山大学. [Wang P F. 2014. Cloning and expression analysis of heat shock protein and hypoxia responsive genes in mandarin fish(Siniperca chuatsi)[D]. Guangzhou:Sun Yat-sen University.]
王伟,姜志强,孟凡平,李莹,王震宇. 2012. 急性温度胁迫对太平洋鳕仔稚鱼成活率、生理生化指标的影响[J]. 水产科学,31(8):463-466. doi:10.16378/j.cnki.1003-1111.2012. 08.009. [Wang W,Jiang Z Q,Meng F P,Li Y,Wang Z Y. 2012. The effects of sharply changes in temperature on survival and indices of physiology and biochemistry in Pacific cod Gadus macrocephalus[J]. Fisheries Science,31(8):463-466.]
王晓雯,张蓉,朱建亚,刘丽丽,马国庆,朱华. 2019. 急性热应激对西伯利亚鲟肝功指标及肝脏热休克蛋白表达的影响[J]. 四川农业大学学报,37(1):122-128. doi:10.16036/ j.issn.1000-2650.2019.01.019. [Wang X W,Zhang R,Zhu J Y,Liu L L,Ma G Q,Zhu H. 2019. Effects of acute heat stress on hepatic biochemical index and gene expression of heat shock proteins in Acipenser baeri[J]. Journal of Sichuan Agricultural University,37(1):122-128.]
王艳妮,刘哲,康玉军,李珍,施海娜,张久盘,王建福,蒋丽,黄进强. 2015. 热应激对虹鳟部分非特异性免疫指标的影响[J]. 农业生物技术学报,23(5):634-642. doi:10. 3969/j.issn.1674-7968.2015.05.009. [Wang Y N,Liu Z,Kang Y J,Li Z,Shi H N,Zhang J P,Wang J F,Jiang L,Huang J Q. 2015. Effects of heat stress on some non-specific immunity parameters in rainbow trout(Oncorhynchus mykiss)[J]. Journal of Agricultural Biotechnology,23(5):634-642.]
吴庆元,蒋玫,李磊,牛俊翔,沈新强. 2014. 低盐度胁迫对鲻鱼(Mugil cephalus)幼鱼鳃丝、肌肉、肠Na+-K+-ATP酶活性和MDA含量的影响[J]. 生态与农村环境学报,30(4):481-487. [Wu Q Y,Jiang M,Li L,Niu J X,Shen X Q. 2014. Effects of chronic stress of lower salinity on activity of Na+-K+-ATPase and content of MDA in branchial filament,muscle,intestine of juvenile mullet(Mugil cepha-lus)[J]. Journal of Ecology and Rural Environment,30(4):481-487.]
夏斌鹏,刘哲,周彦静,王永杰,黄进强,李永娟,康玉军,王建福,刘晓霞. 2017. 慢性热应激对虹鱒部分血清非特异性免疫指标的影响[J]. 农业生物技术学报,25(7):1078-1085. doi:10.3969/j.issn.1674-7968.2017.07.005. [Xia B P,Liu Z,Zhou Y J,Wang Y J,Huang J Q,Li Y J,Kang Y J,Wang J F,Liu X X. 2017. Effects of chronic heat stress on part of serum non-specific immunity parameters in rainbow trout(Oncorhynchus mykiss)[J]. Journal of Agricultural Biotechnology,25(7):1078-1085.]
谢明媚,彭士明,张晨捷,高权新,施兆鸿. 2015. 急性温度胁迫对银鲳幼鱼抗氧化和免疫指标的影响[J]. 海洋渔业,37(6):541-549. doi:10.13233/j.cnki.mar.fish.2015.06. 008. [Xie M M,Peng S M,Zhang C J,Gao Q X,Shi Z H. 2015. Effects of acute temperature stress on antioxidant enzyme activities and immune indexes of juvenile (Pampus argenteus)[J]. Marine Fisheries,37(6):541-549.]
辛苑茹,温海深,李吉方,侯志帅,张美昭,车德钊,陈落落. 2019. 急性高温胁迫对虹鳟二倍体和三倍体幼鱼hsps基因表达的影响[J]. 中国海洋大学学报,49(3):129-137. doi:10.16441/j.cnki.hdxb.20180334. [Xin Y R,Wen H S,Li J F,Hou Z S,Zhang M Z,Che D Z,Chen L L. 2019. Effects of acute thermal stress on gene expression of heat shock protein in diploid and triploid juvenile rainbow trout(Oncorhynchus mykiss)[J]. Periodical of Ocean University of China,49(3):129-137.]
徐畅,丁炜东,曹哲明,邴旭文,张晨光,谷心池,刘雨. 2020. 急性低氧胁迫对翘嘴鳜抗氧化酶、呼吸相关酶活性及相关基因表达的影响[J]. 南方农业学报,51(3):686-694. doi:10.3969/j.issn.2095-1191.2020.03.027. [Xu C,Ding W D,Cao Z M,Bing X W,Zhang C G,Gu X C,Liu Y. 2020. Effects of acute hypoxia stress on antioxidant enzymes,respiratory related enzymes and expression of related genes in mandarin fish(Siniperca chuatsi)[J]. Journal of Southern Agriculture,51(3):686-694.]
杨明,蒋飞,施永海,徐嘉波,刘永士,邓平平,袁新程. 2020. 高温胁迫对美洲鲥消化酶活性的影响[J]. 西北农林科技大学学报(自然科学版),48(10):1-8. doi:10.13207/j.cnki.jnwafu.2020.10.001. [Yang M,Jiang F,Shi Y H,Xu J B,Liu Y S,Deng P P,Yuan X C. 2020. Effect of high temperature stress on activities of digestive enzymes in Alosa sapidissima[J]. Journal of Northwest A & F University (Natural Science edition),48(10):1-8.]
张德康,高建操,王裕玉,庄砚冰,顾若波,徐钢春. 2020. 低温胁迫对美洲鲥抗氧化状态及应激相关基因表达的影响[J]. 海洋湖沼通报,(2):144-151. doi:10.13984/j.cnki.cn37-1141.2020.02.018. [Zhang D K,Gao J C,Wang Y Y,Zhuang Y B,Gu R B,Xu G C. 2020. Influences of low temperature stress on antioxidant status and expression of stress related genes of American shad,Alosa sapidissima[J]. Transactions of Oceanology and Limnology,(2):144-151.]
张思敏,李吉方,温海深,吕里康,李兰敏,赵吉. 2018. 急性温度胁迫对许氏平鲉肝脏代谢机能和血液指标的影响及生理机制[J]. 中国海洋大学学报,48(5):35-38. doi:10.16441/j.cnki.hdxb.20170224. [Zhang S M,Li J F,Wen H S,Lü L K,Li L M,Zhao J. 2018. Effect of acute temperature stress on liver metabolism of black rockfish Sebastes schlegelii and associating physiological mechanism[J]. Periodical of Ocean University of China,48(5):35-38.]
周鑫,董云伟,王芳,董双林. 2013. 草鱼hsp70和hsp90对温度急性变化的响应[J]. 水产学报,37(2):216-221. doi:10. 3724/SP.J.1231.2013.37965. [Zhou X,Dong Y W,Wang F,Dong S L. 2013. Effect of rapid temperature change on expression of hsp70 and hsp90 in grass carp(Ctenopharyngodon idella)[J]. Journal of Fisheries of China,37(2):216-221.]
周彥静,刘哲,夏斌鹏,康玉军,王永杰,刘晓霞. 2017. 持续热应激对虹鳟肝脏组织形态结构的影响[J]. 甘肃农业大学学报,52(6):1-5. doi:10.13432/j.cnki.jgsau.2017.06.001. [Zhou Y J,Liu Z,Xia B P,Kang Y J,Wang Y J,Liu X X. 2017. Effect of continuing heat stress on the liver tissue morphology of rainbow trout(Oncorhynchus mykiss)[J]. Journal of Gansu Agricultural University,52(6):1-5.]
朱爱意,褚学林. 2006. 大黄鱼(Pseudosciaena crocea)消化道不同部位两种消化酶的活力分布及其受温度、ph的影响[J]. 海洋与湖沼,37(6):561-567. [Zhu A Y,Chu X L. 2006. Activity and distribution of two enzymes in diffe-rent parts of digestive tract of Pseudosciaena crocea temperature and pH impacts[J]. Oceanologia et Limnologia Sinica,37(6):561-567.]
Basu N,Todgham A E,Ackerman P A,Bibeau M R,Nakano K,Schulte P M,Iwama George K. 2002. Heat shock protein genes and their functional significance in fish[J]. Gene,295(2):173-183. doi:10.1016/s0378-1119(02)00687-x.
Bly J E,Clem L W. 1992. Temperature and teleost immune functions[J]. Fish & Shellfish Immunology,2(3):159-171. doi:10.1016/s1050-4648(05)80056-7.
Casillas E,Sundquist J,Ames W E. 2006. Optimization of assay conditions for,and the selected tissue distribution of,alanine aminotransferase and aspartate aminotransferase of English sole,Parophrys vetulus Girard[J]. Journal of Fish Biology,21(2):197-204. doi:10.1111/j.1095-8649. 1982.tb03999.x.
Cheng C H,Guo Z X,Luo S W,Wang A L. 2018. Effects of high temperature on biochemical parameters,oxidative stress,DNA damage and apoptosis of pufferfish(Takifugu obscurus)[J]. Ecotoxicology and Environmental Safety,150:190-198. doi:10.1016/j.ecoenv.2017.12.045.
Encomio V G,Chu F L E. 2007. Heat shock protein (hsp70) expression and thermal tolerance in sublethally heat-shocked eastern oysters Crassostrea virginica infected with the parasite Perkinsus marinus[J]. Diseases of Aqua-tic Organisms,76(3):251-260. doi:10.3354/dao076251.
He Y F,Wu X B,Zhu Y J,Li H C,Li X M,Yang D G. 2014. Effect of rearing temperature on growth and thermal to-lerance of Schizothorax(Racoma) kozlovi larvae and juveniles[J]. Journal of Thermal Biology,46:24-30. doi:10. 1016/j.jtherbio.2014.09.009.
Hoseinifar S H,Dadar M,Ring? E. 2017. Modulation of nu-trient digestibility and digestive enzyme activities in aqua-tic animals:The functional feed additives scenario[J]. Aquaculture Research,48(8):3987-4000. doi:10.1111/are.13368.
Jonsson H,Schiedek D,Goks?yr A,EinarGr?svik B. 2006. Expression of cytoskeletal proteins,cross-reacting with anti-CYP1A,in Mytilussp exposed to organic contaminants[J]. Aquatic Toxicology,78(S1):S42-S48. doi:10.1016/j.aquatox.2006.02.014.
Livingstone D R. 2001. Contaminant-stimulated reactive oxygen species production and oxidative damage in aquatic organisms[J]. Marine Pollution Bulletin,42(8):656-666. doi:10.1016/S0025-326X(01)00060-1.
Martínez-?lvarez R M,Moralesa A E,Sanz A. 2005. Antioxidant defenses in fish:Biotic and abiotic factors[J]. Reviews in Fish Biology & Fisheries,15(1-2):75-88. doi:10.1007/s11160-005-7846-4.
Ming J H,Xie J,Xu P,Liu W B,Ge X P,Liu B,He Y J,Cheng Y F,Zhou Q L,Pan L K. 2010. Molecular cloning and expression of two HSP70 genes in the Wuchang bream(Megalobrama amblycephala Yih)[J]. Fish & Shellfish Immunology,28(3):407-418. doi:10.1016/j.fsi.2009. 11.018.
Patterson J T,Mims S D,Wright R A. 2013. Effects of body mass and water temperature on routine metabolism of American paddlefish Polyodon spathula[J]. Journal of Fish Biology,82(4):1269-1280. doi:10.1111/jfb.12066.
Varghese T,Pal A K,Mishal P,Sahu N P,Dasgupta S. 2017. Physiological and molecular responses of a bottom dwe-ling carp,Cirrhinus mrigala to short-term envrionmental hypoxia[J]. Turkish Journal of Fisheries and Aquatic Scien-ces,18(3):483-490. doi:10.4194/1303-2712-v18_3_14.
Wu C X,Zhao F Y,Zhang Y,Zhu Y J,Ma M S,Mao H L,Hu C Y. 2012. Overexpression of Hsp90 from grass carp (Ctenopharyngodon idella) increases thermal protection against heat stress[J]. Fish & Shellfish Immunology,33(1):42-47. doi:10.1016/j.fsi.2012.03.033.
Yan J,Liang X,Zhang Y,Li Y,Cao X J,Gao J. 2017. Clo-ning of three heat shock protein genes (HSP70,HSP90α and HSP90β) and their expressions in response to thermal stress in loach(Misgurnus anguillicaudatus) fed with different levels of vitamin C[J]. Fish & Shellfish Immunology,66:103-111. doi:10.1016/j.fsi.2017.05.023.
Yanar M,Erdo?an E,Kumlu M. 2019. Thermal tolerance of thirteen popular ornamental fish species[J]. Aquaculture,501(25):382-386. doi:10.1016/j.aquaculture.2018.11.041.
Yavelsky V,Vais O,Piura B,Wolfson M,Rabinovich A,Fraifeld V. 2004. The role of Hsp90 in cell response to hyperthermia[J]. Journal of Thermal Biology,29(7-8):509-514. doi:10.1016/j.jtherbio.2004.08.078.
Zhou P P,Wang M Q,Xie F J,Deng D F,Zhou Q C. 2016. Effects of dietary carbohydrate to lipid ratios on growth performance,digestive enzyme and hepatic carbohydrate metabolic enzyme activities of large yellow croaker(Lar-michthys crocea)[J]. Aquaculture,452:45-51. doi:10.1016/ j.aquaculture.2015.10.010.
(責任编辑 兰宗宝)
