危重先天性心脏病新生儿手术前后血清25-羟基维生素D水平与预后的相关性*
2021-08-02陈仁伟艾力夏提阿里甫王海凡王娜张瑞贾兵
陈仁伟, 艾力夏提·阿里甫, 王海凡, 王娜, 张瑞, 贾兵
(1.海南省妇女儿童医学中心 & 海南医学院附属妇幼保健院 & 儿童医院 小儿心胸外科, 海南 海口 570300; 2.复旦大学附属儿科医院 心胸外科, 上海 201102)
先天性心脏病(congenital heart disease,CHD)发病率为0.7%~0.8%,是儿童常见的先天性出生缺陷疾病,可导致心力衰竭、缺氧、酸中毒等[1];部分CHD新生儿早期表现为高危重症,如室间隔缺损(VSD)、完全性肺静脉异位引流(TAPVC)、主动脉缩窄(COA)及肺动脉闭锁(PA)。CHD患儿的病死率较高,需在出生后早期给予体外循环(CPB)手术治疗[2-3]。维生素D属于脂溶性维生素,由维生素D2(麦角钙化醇)、维生素D3(胆钙化醇)等组成,在体内重要代谢产物之一为25羟维生素D3[25-hydroxyvitamin D,25-(OH)D3],可进一步羟化为有生物活性的类固醇激素[1,25(OH)2D3],从而调节机体钙磷代谢水平,并参与机体防御、炎性反应、免疫系统分化调节等病理生理过程[4]。调查显示,目前世界上仍有50%人群有维生素D缺乏或不足,即使健康儿童也存在维生素D轻度缺乏[5]。有研究发现,CHD患儿维生素D缺乏症与再次发生心血管功能障碍等关联[6],目前国内关于接受手术的危重CHD新生儿术后血清25-(OH)D变化特点的研究甚少,因此,本文对60例新生危重CHD患儿手术前后25-(OH)D水平进行分析,并探讨25-(OH)D水平与危重CHD患儿预后的关系。
1 对象与方法
1.1 研究对象
选取2018年5月—2020年6月收治的60例危重CHD新生儿手术资料。纳入标准:(1)经心脏彩超证实为危重CHD;(2)手术矫正日龄≤28 d,符合CPB下CHD手术指征,在本中心接受手术;(3)术前相关资料齐全,术前肝肾功能正常,无凝血功能障碍。排除标准:(1)合并感染、肿瘤、肝脏、肾脏与内分泌系统疾病、中枢神经系统疾病或其他心脏病;(2)急诊或二次手术患儿;(3)治疗过程未结束时监护人放弃治疗。60例CHD新生儿男34例、女26例,日龄0~28 d、平均(14.15±1.52)d,早产儿11例、足月儿49例, TGA合并IVS 13例、TGA合并VSD 5例、VSD 15例、TAPVC 12例、COA合并VSD 15例。
1.2 方法
1.2.1手术治疗方法 均在CPB下进行手术治疗,采用Stockert Ⅳ型人工心肺机、新生儿膜肺Dideco Lilliput 901及内径6 mm的动脉输血管、静脉回流管和泵管,泵中加预冲液(乳酸林格液150~200 mL,20%人血白蛋白50 mL,新鲜全血或浓缩红细胞0.5~1.5 U,冰冻血浆50~100 mL,总预充量为350~500 mL)。CPB降温与复温过程中缓慢均匀进行,水温与血温相差<10 ℃。CPB中应用常规超滤及改良超滤,维持循环中红细胞比容(Hct)在0.25~0.30,复杂手术应用低温低流量15~30 mL/(kg·min)灌注,必要时予以深低温停循环(DHCA),心肌保护采用心脏灌注液(HTK)或含血冷晶体停搏液顺行灌注。
1.2.2血清25-(OH)D水平测定 于术前(T1)、术毕(手术结束转入CCU时,T2)及术后24 h(在CCU后24 h,T3)抽取新生儿空腹静脉血2 mL,置于真空管,震荡摇匀后置入37 ℃水浴,3 000 r/min离心5 min分离血清,-80 ℃冻存待检。采用罗氏全自动电化学仪、离心机、微量加样器、25-(OH)D3检测试剂盒(购自上海梵态生物科技有限公司,批号FT-e10298),以双抗体夹心酶联免疫吸附试验测定血清25-(OH)D3水平代表机体总维生素D水平。根据T3时点维生素D水平将患儿分为缺乏组、不足组及正常组,维生素D缺乏程度的判断参照文献[7],正常为25-(OH)D水平>30 μg/L、不足为25-(OH)D水平20~30 μg/L、缺乏为25-(OH)D水平≤19 μg/L,缺乏率=缺乏例数/总例数×100%,对T1时不同缺乏程度的患儿基线资料进行分析,包括年龄、体质量、缺损面积、性别、先天性心脏手术风险调整-1(RACHS-1)评分、诊断类型,其中RACHS-1评分将CHD患儿手术风险分为6个风险级别,记1~6分,诊断类型分为紫绀、非紫绀。
1.2.3血管活性药物(VIS)评分[8]VIS评分=多巴胺[μg/(kg·min)]+多巴酚丁胺[μg/(kg·min)]+10×米力农+100×肾上腺素[μg/(kg·min)]+100×去甲肾上腺素[μg/(kg·min)]+10 000×垂体后叶素(U/(kg·min)]。评分1次/h,统计新生儿术后第1个24 h内平均VIS评分。
1.2.4预后评估 记录患儿术后预后情况,包括术后24 h内胸液量、尿量、机械通气时间、ICU时间、住院时间、住院期间不良事件(死亡、腹膜透析、二次开胸、肺部感染等)。
1.3 统计学分析
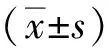
2 结果
2.1 血浆25-(OH)D水平
结果显示,新生危重CHD患儿T2、T3时25-(OH)D水平低于T1时点,维生素D缺乏程度高于T1时点,差异有统计学意义(P<0.05);但T2时点与T3时点的25-(OH)D水平及维生素D缺乏程度比较,差异无统计学意义(P>0.05)。见表1。

表1 危重CHD新生儿CPB手术前后血清25-(OH)D水平Tab.1 Changes of serum 25-(OH)D levels among neonates with critical CHD before and after surgery
2.2 不同维生素D水平患儿基线资料比较
结果显示,T1时点维生素D缺乏、不足及正常患儿的年龄、体质量、缺损面积、性别、RACHS-1评分及诊断类型比较,差异无统计学意义(P>0.05)。见表2。

表2 不同维生素D水平患儿基线资料比较Tab.2 Comparison of baseline data among neonates with critical CHD of different vitamin D level
2.3 危重CHD新生儿VIS评分与维生素D水平的相关性
结果显示, 危重CHD新生儿术后24 h内最大VIS评分为(31.75±3.28)分,相关分析结果显示,T2及T3时点25-(OH)D水平与24 h内最大VIS评分呈负相关(r=-0.615、-0.529,P<0.05),T2及T3时点维生素D缺乏程度与24 h内最大VIS评分呈正相关(r=0.466、0.368,P<0.05),24 h内最大VIS评分与T1时的维生素D水平无相关性(P>0.05)。见表3。

表3 危重CHD新生儿VIS评分与维生素D水平的相关性Tab.3 Relationship between VIS score and vitamin D level in neonates with critical CHD
2.4 维生素D水平对预后的影响
结果显示,危重CHD新生儿术后24 h内维生素D缺乏组、不足组、正常组胸液量、尿量、机械通气时间、不良事件发生率比较,差异无统计学意义(P>0.05),缺乏组ICU时间、住院时间较不足组和正常组延长,差异有统计学意义(P<0.05)。见表4。

表4 术后24 h维生素D水平对预后的影响Tab.4 Effect of vitamin D level at 24 h after surgery on
3 讨论
危重CHD新生儿一般会在出生后出现严重临床症状,若未能及时给予合理和有效的治疗,早期将有较高的病死率[9-10]。维生素D在体内的代谢产物25-(OH)D3可活化为1,25(OH)2D3,组成固有免疫的第一道防线,国外Mokhtar等[11]埃及病例对照研究发现,母亲维生素D水平和维生素D受体基因多态性是后代CHD的危险因素,国内徐亚利[12]发现,反复呼吸道感染儿童体内血清维生素D缺乏也对其有不利影响。危重CHD新生儿有独特的生理学特点,其体内液体管理、电解质平衡、内分泌变化和营养支持均与年长儿、非危重CHD新生儿存在差别,围术期需要尤其留意[13-14],因此分析危重CHD新生儿术后维生素D水平状况及其与预后的关系有重要意义。
有研究发现,复杂性CHD患儿维生素D缺乏症发生率较高,为72.46%[15];张海[16]报道78例CHD患儿血清25-(OH)D3水平为(18.92±9.17)μg/L,其中正常32.05%、不足48.72%、缺乏19.23%。本次研究发现,危重CHD新生儿在T1时25-(OH)D水平为(21.78±2.29)μg/L,其中缺乏、不足、正常分别占18.33%、51.67%、18.33%,与上述报道比例有一定差异,可能与研究对象的病情严重程度等因素有关,但新生儿在术前普遍存在有维生素D缺乏或不足,这可能是因为危重CHD患儿易出现缺氧、营养不良与心功能不全有关,此外该类患儿外出活动减少也会使阳光照射减少,导致维生素D不足或缺乏。
本研究发现,危重CHD新生儿T2、T3时25-(OH)D水平低于T1时,T2与T3时25-(OH)D水平无差异,且T2、T3时的维生素D缺乏程度较T1时增加,表明危重CHD新生儿在CPB术后维生素D水平有下降趋势,可能与CPB手术中机械通气、有创操作等有关[17]。Abou等[18]也发现,CHD新生儿在CPB后的维生素D水平下降,在术后即刻、术后24 h 25-(OH)D水平分别为(19.0±5.8)μg/L、(19.5±6.6)μg/L,均低于术前(21.3±8.0)μg/L,本研究结论与之一致,该研究还发现25-(OH)D下降主要是在25-(OH)D水平足够的患儿中观察到,在对游离的25-(OH)D进行检测又出现相似结果,但本研究受条件限制未做此方面的观察,后期值得进一步深入研究。
Dohain等[19]在分析小儿心脏手术后的血清维生素D状况及其与临床结局的关系时发现,术后即刻维生素D缺乏率达91.3%,术后25-(OH)D下降42.03%,术后24 h内较低的25-(OH)D与较高的VIS评分相关(r=-0.259,P=0.03),本研究也发现CHD患儿术后24 h内最大VIS评分为(31.75±3.28)分,相关分析显示T2、T3时25-(OH)D水平与24 h内最大VIS评分呈负相关,维生素D缺乏程度与24 h内最大VIS评分呈正相关,与上述研究结果相近,表明接受CPB心脏手术的CHD患儿术后维生素D含量降低,可能与增加正性肌力支持有关。维生素D水平也可能与疾病种类、手术时间、输血量等、机械通气、有创操作等因素有关,本次未对这些因素进行分析,是否会影响研究结论的得出后期值得进一步探究。维生素D是一种多效激素,对钙稳态具有重要作用,不仅可调节钙及磷的稳定,也能调节免疫系统、预防肿瘤[20],而在CPB下正性肌力支持率升高,会导致儿童维生素D急剧下降,董彦博等[21]也提出钙剂及维生素D对CHD术后鸡胸等并发症有预防作用。
本研究也对不同维生素D患儿的预后情况进行分析,发现术后24 h内维生素D缺乏组、不足组、正常组胸液量、尿量、机械通气时间、不良事件发生率比较差异无统计学意义,而缺乏组ICU时间、住院时间较不足组和正常组延长,表明危重CHD患儿在术后维生素D缺乏及不足现象可能延长其ICU时间、住院时间,应在术后24 h内及时补充维生素D以帮助改善患儿心脏功能,促进患儿术后恢复。在维生素D补充制剂的选择方面,维生素D3制剂优于维生素D2,且口服优于注射,需要一次性大剂量补充维生素D时,剂量宜控制在15~20万单位是安全的,但也需注意,对严重缺乏维生素D的危重症患儿,过早给予大剂量维生素D补充可能会增加其病死率,因此治疗时也需更慎重[22]。受研究条件限制,本次未分析补充维生素D与否对术后治疗时间的影响,后期可进一步开展研究。
综上所述,危重CHD新生儿术后存在维生素D缺乏或不足现象,这一改变可能与CPB术中正性肌力支持率升高有关,并对患者预后有一定影响,需考虑实际情况及时为患儿补充维生素D。
