miR-141-3p对腰椎间盘突出症大鼠髓核组织核转录因子κB信号通路的影响*
2021-08-02陈胜乐米盼盼许雅芳史学双樊国峰王一凤贾俊玲
陈胜乐, 米盼盼**, 许雅芳, 史学双, 樊国峰, 王一凤, 贾俊玲
(1.河北中石油中心医院 骨科, 河北 廊坊 065000; 2.河北中石油中心医院 影像科, 河北 廊坊 065000; 3.河北中石油中心医院 病案科, 河北 廊坊 065000)
健康人群中腰椎间盘突出症(lumbar disc herniation,LDH)的高发年龄为30~40岁,50岁以后发病率可达90%[1]。LDH的主要临床表现为复发性腰腿痛,伴有患肢麻木和肌无力,男性偶尔伴有腹股沟或睾丸疼痛,严重者压迫马尾神经,引起下肢麻木、肛周疼痛、会阴麻木及括约肌麻痹等症状[2]。目前临床上对LDH的发病机制尚未完全了解,但有学者支持的LDH病因病机主要有机械压迫理论、炎症反应理论、自身免疫理论和生物力学改变理论[3]。核转录因子κB(nuclear factor kappa-B,NF-κB)是一种广泛存在于细胞质中的核转录因子,在细胞刺激后的信号通路中发挥作用,它通过调节趋化因子、黏附分子、生长因子和多种酶的基因表达,在炎症反应、免疫调节和细胞凋亡中发挥重要作用[4-5]。近年来,通过动物实验观察椎间盘退变模型和人椎间盘退变髓核细胞,发现退变髓核细胞中NF-κB的阳性表达率较高,因此NF-κB信号通路通常被认为与LDH有关[6]。miRNA是不编码蛋白质的单链RNA,miR-141-3p基因位于14号染色体,参与肿瘤的发生,其在不同肿瘤组织中的表达水平也不同[7-8]。有学者发现miR-141-3p参与调节肿瘤细胞的生长,对不同的肿瘤细胞有不同的作用[9],miR-141-3p还可通过靶向作用于肿瘤坏死因子受体相关因子5(tumor necrosis factor receptor-associated factor-5,TRAF5)和肿瘤坏死因子受体相关因子6(tumor necrosis factor receptor-associated factor-6,TRAF6)而对NF-κB的激活产生抑制作用,进而抑制前列腺癌细胞的侵袭和转移,提示miR-141-3p与NF-κB信号通路活化存在一定的关系[10]。本研究自体髓核回植法成功制备LDH大鼠模型,麻醉后取出大鼠髓核组织细胞培养,观察miR-141-3p对髓核组织细胞的调控作用,探讨NF-κB信号通路与LDH的相关性和miR-141-3p对LDH模型大鼠NF-κB信号通路的影响。
1 材料与方法
1.1 实验材料
1.1.1实验动物 选取20只8周龄雄性SD大鼠,清洁级、3月龄、体质量(198.68±7.55)g,由湖南省中医药研究院动物实验室购入,合格证号为SCXK(湘)2021-0318,自体髓核回植法[11]成功建立腰椎间盘突出大鼠模型18只。
1.1.2试剂与仪器 胎牛血清和RPMI 1640培养基(南京生航生物技术有限公司),Lipofectamine 2000脂质体转染试剂(Invitrogen),miR-141-3p mimics及其对照(广州市锐博生物科技有限公司),Trizol试剂及逆转录试剂盒(上海杰美基因医药科技有限公司),四甲基偶氮唑蓝试剂(MTT,美国Amresco),蛋白提取和检测试剂(上海碧云天生物技术有限公司),NF-κB信号通路相关抗体(美国Cell Signaling Technology公司);日立投射电子显微镜(型号H-7650,上海筑金分析仪器有限公司),离心机(型号BT-1500,丹东百特仪器有限公司)。
1.2 研究方法
1.2.1模型制备[11]腹腔注射10%水合氯醛后,大鼠俯卧位固定,常规准备背部和尾部手术区域,进行备皮和消毒,先切开两个尾盘,开放的椎间盘应包含上下软骨终板,刺破椎间盘上下板暴露髓核,用7号手术线将椎间盘包裹成“米”形待用;依次切开皮肤组织,使L5/L6椎间隙和L5神经根暴露,将准备好的桡侧椎间盘置入左侧L5神经根,并缝合。术后3 d内每日腹腔注射青霉素[80万U/(kg·d)]。造模第3天,采用Siegal神经功能六级评分法[12]评定大鼠神经功能,评分>2级(>6分)为建模成功。
1.2.2分组及转染 将18只大鼠处死后取出髓核组织分为miR-141-3p mimics转染组、转染miR-141-3p阴性对照组及不进行转染正常对照组,每组6例;转染组大鼠体质量(201.68±6.49)g,阴性对照组大鼠体质量(197.72±3.56)g,正常对照组大鼠体质量(199.36±5.94)g。麻醉后处死大鼠,在解剖显微镜下用眼科手术器械去除大鼠背部皮肤和软组织,取出椎间盘,去除环纤维和软骨板,将提取的髓核组织置于含DMEM(0.1%小牛血清)1 mL的12孔板,37 ℃、5%CO2培养箱培养。细胞贴壁后,每1~2 d更换1次培养基,当细胞融合度>85%时,加入胰蛋白酶消化传代,将对数型髓核细胞接种于6孔板上,37 ℃培养箱中培养。当细胞融合率达到50%时,加入无血清培养基同步处理12 h,按说明书进行Lipofectamine 2000试剂转染。转染后,细胞均置于37℃培养箱中培养,6 h后换用正常培养基,共培养48 h。
1.3 观察指标
1.3.1细胞活力 采用MTT法测定,各组细胞均培养48 h,于每孔内均加入MTT溶液20 μL,37 ℃孵育4 h, 加入DMSO 150 μL,摇动10 min,然后将样品置于酶标仪上,490 nm处检测吸光度值,计算细胞活性,细胞活性(%)=转染组或阴性对照组吸光度值/正常对照组吸光度值×100%。
1.3.2细胞侵袭能力 细胞浓度调整为2×107个/L,将细胞悬液接种于包被或不包被Matrigel胶的Transwell上室中,培养液添加到下室;培养24 h后,用4%多聚甲醛固定,0.1%结晶紫染色,显微镜下观察5个随机视野内结晶紫染色细胞数为细胞浸润数。
1.3.3细胞凋亡率 采用流式细胞仪检测,将5×105对数生长的髓核细胞接种于培养瓶内,收集悬浮和贴壁细胞,在Annexin V-FITC488和PI溶液中室温避光孵育15 min,测定3次计算平均值。
1.3.4炎性指标 培养48 h后,以ELISA法检测髓核细胞中白细胞介素-1(interleukin-1,IL-1)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、红细胞沉降率(erythrocyte sedimentation rate,ESR)、C反应蛋白(C-reactiveprotein,CRP)水平。将抗原使用包被稀释液稀释至适当浓度,每孔加入抗原100 μL,置于37 ℃下反应4 h,弃孔中液体;将5%小牛血清置于37 ℃下封闭40 min,结束后使用洗涤液洗涤3次、3 min/次;将1 ∶50稀释的样品加入酶标反应孔内,确保每个样本双孔,100 μL /孔,置于37 ℃下反应60 min,洗涤液洗涤3 min;加入酶标抗体,置于37 ℃下反应60 min,加洗涤液洗涤;加入底物液,置于37 ℃下避光放置5 min,加入终止液,加入显色剂50 μL,震荡均匀后于37 ℃下避光显色15 min;每孔加终止液50 μL,终止反应; 15 min后测定450 nm波长时各孔的吸光度值。
1.3.5NF-κB信号通路相关蛋白水平 采用Western blot法检测,提取髓核细胞总蛋白,用二喹啉甲酸法测定蛋白质浓度,对等量蛋白样本进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,将蛋白转移到二氟乙烯膜(polyvinylidene fluoride,PVDF)上,密封于5%脱脂奶粉中,用磷酸盐缓冲液(phosphate buffered solution,PBST)洗涤3次,加入核因子κB磷酸化65(nuclear factor kappa-B phosphorylation 65,NF-κB p65,1 ∶800)、IκB激酶α(IκB kinase-α,IKK-α)、磷酸化IκB激酶α(phosphorylation IκB kinase-α,p-IKK-α)、IκB激酶α抗体(IκB-kinase α antibody,IKB-α)、磷酸化IκB激酶α抗体(phosphorylation IκB-kinase α antibody,p-IKB-α,1 ∶1 000)相应的一抗,在4 ℃培养过夜。PBST洗涤3次,加入二抗(1 ∶3 000),室温下孵育2 h,PBST洗涤3次,加入电化学发光试剂,以β-actin作为内参,暗室内凝胶成像系统拍照,使用Image J软件分析条带灰度值。
1.3.6NF-κB信号通路相关mRNA水平 采用荧光定量聚合酶链反应(real-time quantitative reverse,qRT-PCR)检测,从培养48 h的髓核细胞中提取RNA,并测定纯度和浓度,逆转录为cDNA,按照荧光定量试剂盒的说明进行PCR。NF-κBp65的上游引物为AGCGTAGCTTATCAGACTGATG,下游引物为TAGCTTATCAGACTGATGTTGA;IKK-α的上游引物为CAGTGCAATGATGAAAGGGCAT,下游引物为CAGTGCAATGATGAAAGGGCAC;IKB-α的上游引物为GTCGTATCCAGTGCAGGGTGAC,下游引物为CGCAGGGTCCGAGGTATTCTCG。95 ℃预变性2 min,95 ℃变性30 s,60 ℃退火30 s、72 ℃延伸30 s,40个循环,60 ℃最后延长5 min,产物200 bp,以β-actin为内标,用2-△△Ct法计算相对表达。
1.4 统计学分析
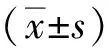
2 结果
2.1 细胞活力、侵袭及凋亡率比较
培养48 h时,转染组髓核组织的细胞活力、细胞侵袭个数低于阴性对照组和正常对照组,凋亡率高于阴性对照组和正常对照组,差异有统计学意义(P<0.05)。见表1、图1~3。

表1 各组髓核组织培养48 h时细胞活力、侵袭及凋亡率Tab.1 Cell viability, invasion, and apoptosis of nucleus pulposus tissue cultured for 48 h in each
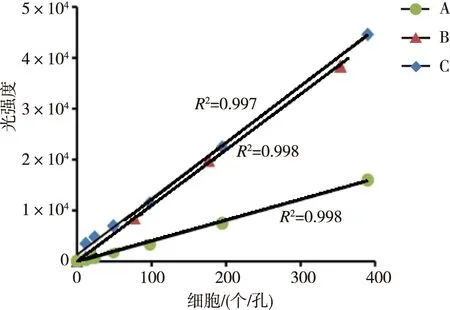
注:A为转染组,B为阴性对照组,C为正常对照组。图1 各组髓核组织培养48 h时细胞活力Fig.1 Cell viability of nucleus pulposus tissue cultured for 48 h in each group
2.2 髓核组织IL-1、IL-10、TNF-α、ESR及CRP表达
结果显示,3组髓核组织培养48 h时的IL-1、TNF-α、ESR、CRP水平比较,转染组<阴性对照组<正常对照组,差异有统计学意义(P<0.05); IL-10水平比较,转染组>正常对照组>阴性对照组,差异有统计学意义(P<0.05)。见表2。

表2 各组髓核组织培养48 h时IL-1、IL-10、TNF-α、ESR及CRP水平Tab.2 Comparison of IL-1,IL-10,TNF-α,ESR, and CRP levels of nucleus pulposus tissue cultured for 48 h in each group
2.3 NF-κB信号通路相关因子水平
结果显示,培养48 h时,转染组NF-κB p65、IKK-α、p-IKK-α、IKB-α及p-IKB-α水平低于阴性对照组和正常对照组,差异有统计学意义(P<0.05)。见图4和表3。
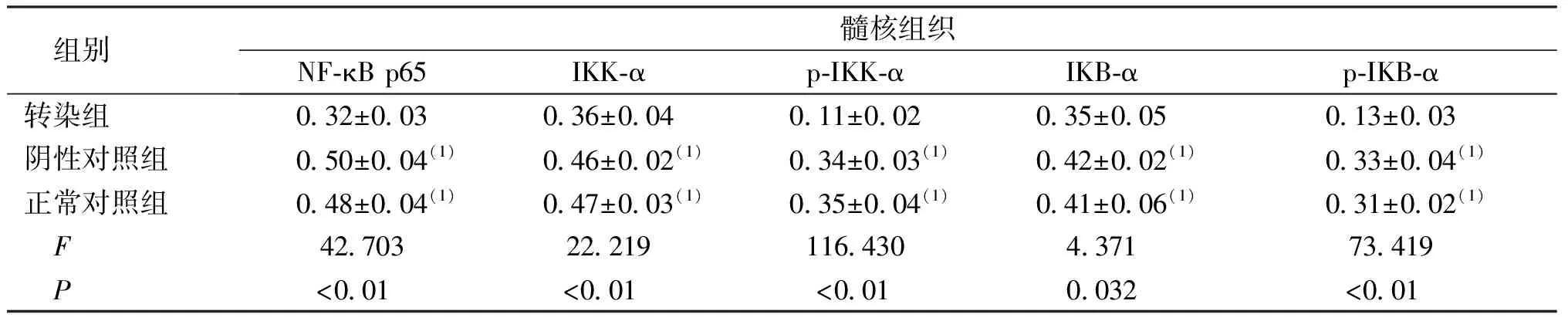
表3 各组髓核组织培养48 h时NF-κB信号通路相关因子水平Tab.3 The levels of NF-κB signaling pathway related factors in nucleus pulposus tissue culture for 48 h in each group

图4 各组髓核组织培养48 h时NF-κB信号通路相关因子水平(Western blot)Fig.4 The levels of NF-κB signaling pathway related factors in nucleus pulposus tissues cultured for 48 h in each group (Western blot)
2.4 NF-κB信号通路相关因子mRNA水平
结果显示,培养48 h时,转染组NF-κBp65、IKK-α及IKB-αmRNA水平低于阴性对照组和正常对照组,差异有统计学意义(P<0.05)。见表4。

表4 各组髓核组织培养48 h时NF-κB信号通路相关因子mRNA水平比较Tab.4 Comparison of mRNA levels of NF-κB signaling pathway related factors cultured for 48 h in each group

转染组 阴性对照组 正常对照组图2 各组髓核组织培养48 h时侵袭细胞个数(结晶紫染色,×200)Fig.2 Number of invasive cells in each group of nucleus pulposus tissue cultured for 48 h (crystal violet staining, ×200)

转染组 阴性对照组 正常对照组图3 各组髓核组织培养48 h时细胞凋亡率Fig.3 Apoptosis of nucleus pulposus tissue cultured for 48 h in each group
3 讨论
临床中已经明确椎间盘退变是一系列脊柱退行性疾病发生的前提和基本病理过程,椎间盘退变是由细胞生物学、机械应力、营养、免疫和年龄的变化引起的,相关的临床症状包括LDH、颈椎和腰椎神经根病、颈脊髓病和椎间盘源性腰痛,可导致脊柱损伤甚至残疾,影响正常生活和工作,但其确切发生机制尚不清楚[13-14]。NF-κB是一种广泛存在于真核细胞中的多向转录因子,最早从成熟的B淋巴细胞中提取,可与IgK轻链基因结合,以多种方式在细胞增殖、分化和凋亡中发挥关键作用[15]。NF-κB的异常激活增强了其转录活性,进而触发细胞间信号级联,导致一系列疾病[16]。近年来的研究表明,NF-κB信号通路在椎间盘退变中起重要作用,抑制NF-κB信号通路可延缓椎间盘退变过程[17],但NF-κB信号通路的激活途径尚不清楚。
miRNA的长度约为15~25 bp,在人体组织中广泛表达,参与了几乎所有的生理过程,如胚胎发育和组织功能维持[18]。miRNA还参与心血管疾病、肿瘤和其他病理过程的调控,是一种与细胞生长和凋亡密切相关的调节因子,参与调节神经细胞和其他细胞的正常生理功能,在肿瘤组织中异常表达,可以作为肿瘤促进剂或抑癌剂来调节肿瘤细胞的生长[19-20]。目前miR-141-3p在乳腺癌及其他肿瘤组织中已被发现过表达, miR-141-3p可能是一种抑癌基因,在肿瘤细胞的生长和凋亡中起重要作用,如miR-141-3p可抑制胃癌及其他肿瘤细胞的生长,促进前列腺癌及其他肿瘤细胞的生长[21-22]。因此本研究分析了miR-141-3p对LDH模型大鼠NF-κB信号通路的影响,以为今后临床治疗提供参考。
本研究结果显示,培养48 h后转染组髓核组织的细胞活力、侵袭个数均低于阴性对照组和正常对照组,凋亡率高于阴性对照组和正常对照组,IL-1、TNF-α、ESR、CRP水平均低于阴性对照组和正常对照组,IL-10水平高于阴性对照组和正常对照组,且正常对照组高于阴性对照组,NF-κB p65、IKK-α、p-IKK-α、IKB-α、p-IKB-α蛋白及其mRNA水平均低于阴性对照组和正常对照组,说明miR-141-3p高表达能够抑制NF-κB信号通路的激活,抑制髓核细胞活力和侵袭,促进细胞凋亡,缓解炎症反应。这是由于正常状态下激活NF-κB信号通路可诱导炎症因子的表达,诱导腰椎间盘髓核细胞发生炎症反应,促进腰椎间盘退变,诱导LDH,直接刺激周围神经组织,产生症状[23]。且NF-κB信号通路激活后,NF-κB可诱导腰椎间盘髓核细胞大量凋亡,导致髓外基质的合成,最终导致LDH的退行性病变,导致LDH[24-25]。因此本研究中miR-141-3p在髓核细胞中的过表达抑制了NF-κB p65、IKK-α和p-IKK-α等的表达,提示miR-141-3p可抑制NF-κB信号通路激活,联系到临床中已明确NF-κB在肿瘤细胞增殖和侵袭中的作用,推测miR-141-3p在髓核细胞中的抗增殖和侵袭作用可能与抑制NF-κB信号通路相关,但具体的调控机制有待进一步探讨。
综上所述,miR-141-3p高表达能够对NF-κB信号通路的激活产生抑制作用,进而抑制髓核细胞活力和侵袭,促进细胞凋亡,缓解炎症反应。
