miR-214-3p对缺糖缺氧再灌注诱导PC12细胞凋亡的作用及机制*
2021-08-02郭冬芬任真奎胡玉梅吴昌学禹文峰
郭冬芬, 任真奎, 胡玉梅, 吴昌学*, 禹文峰*
(1.贵州医科大学 分子生物学重点实验室, 贵州 贵阳 550004; 2.贵州医科大学 地方病与少数民族疾病教育部重点实验室, 贵州 贵阳 550004; 3.黔西南州人民医院 检验科, 贵州 兴义 562400)
脑卒中是一种急性脑血管疾病,分为出血性和缺血性脑卒中,其中急性缺血性脑卒中又称为脑梗死,是由于脑组织局部区域血液供应障碍,导致脑组织缺血、缺氧而发生坏死[1-2]。缺血性脑卒中具有高发病率、高致残及高死亡率的特点,严重威胁人类健康,是世界范围内致残和致死的第二大疾病[3-5]。溶栓是目前公认的临床治疗急性缺血性脑卒中的唯一有效的治疗方案[6-7],然而静脉溶栓增加了出血性转化的风险,反而会造成患者病情恶化和死亡[8-9],因而寻找新的治疗靶点是研究者们一直重点关注的方向。micro RNA(miRNA)是小非编码RNA中的一类,长度为21个核苷酸,能在转录后参与基因表达的调控,在细胞信号通路中发挥着重要功能,亦可在许多生理或病理过程中发生表达异常[10]。近年研究发现,miRNA与急性脑卒中发生具有密切关系[11];脑卒中患者中出现miRNA表达异常,如与发育相关的miR-124在大鼠和小鼠脑卒中模型中表达均显著上调[12-13],miR-210在脑卒中患者血液中表达下调[14]。B淋巴细胞瘤因子2样蛋白2(B-cell lymphoma 2 like protein 2,BCL2L2)作为BCL2家族新成员之一,具有抗凋亡功能[15],但miR-214-3p是否能通过靶向BCL2L2而参与调控神经元凋亡尚未见相关报道。因此,本研究通过构建大鼠肾上腺髓质嗜铬瘤细胞缺糖缺氧再灌注模型,检测miR-214-3p表达的变化及其对细胞凋亡的影响,探讨miR-214-3p与脑卒中的相关性。
1 材料与方法
1.1 实验材料
1.1.1细胞来源 肾上腺嗜铬神经细胞瘤12(adrenal pheochromocytoma 12,PC12)细胞、人胚肾细胞293T购于中国科学院上海细胞库。
1.1.2主要试剂与仪器miR-214-3p逆转录引物、模拟物(miR-214-3pmimic)、抑制物(miR-214-3pinhibitor)及相对应的模拟物对照(miR-214-3p negative control,miR-214-3pNC,广州锐博),实时荧光定量聚合酶链式反应(quantitative real-time polymerase chain reaction,real-time PCR)相关试剂(北京Aidlab),完全培养基(dulbecco’s modified eagle medium,DMEM)和无糖培养基(美国Gibico),胎牛血清(以色列Biological Industries),凋亡相关蛋白裂解半胱天冬酶(cleaved cysteine-dependent aspartate-specifc proteases,Cleaved-caspase3)、B淋巴细胞瘤-2基因(B-cell lymphoma-2,Bcl2)、Bcl2-Associated X的蛋白质(Bcl2-Associated X,Bax)及BCL2L2抗体(美国CST);-80 ℃冰箱(中国HAIER),金属浴(上海其林贝尔),台式冷冻离心机(德国EPPendorf),电泳仪(北京百晶),CO2培养箱(美国Thermor)。
1.2 研究方法
1.2.1生物信息学分析 利用数据库Targetscan 7.2(http://www.targetscan.org/vert_72/)预测miR-214-3p和BCL2L2之间有无结合位点。
1.2.2细胞培养 取PC12细胞培养于含10%胎牛血清的DMEM培养基中,培养条件为37 ℃、5%CO2,此方法下培养的即为PC12细胞的正常组(Control组),根据实验情况选择继续传代培养或用于实验。取293T细胞培养于含10%胎牛血清的DMEM培养基中,培养条件为37 ℃、5%CO,根据实验情况选择继续传代培养或用于实验。
1.2.3荧光素酶报告基因实验 构建带有荧光素酶报告基因的3′UTR野生型/突变型的BCL2L2质粒,合成miR-214-3pmimic/mimic NC质粒。取正常生长且细胞密度为50%时的293T细胞,PBS轻柔洗涤两次,选择一部分孔将野生型BCL2L2 3′UTR同miR-214-3pmimic共转染(wt+mimic组),对照组为野生型BCL2L2 3′UTR同mimic NC共转染(wt+NC组),另一部分孔则是将突变型BCL2L2 3′UTR同miR-214-3pmimic共转染(mut+mimic组),对照组为突变型BCL2L2 3′UTR同mimic NC共转染(mut+NC组)。转染6h后更换培养基继续培养,转染48h后收集细胞,按照试剂盒说明书进行操作,最后使用荧光素酶活性发光计(promega corporation)分别测量四个组别的Renilla luciferase值,此即为报告基因发光值。
1.2.4OGD/R模型构建 选取生长状态良好的PC12细胞,胰酶消化,1 000 r/min离心3~5 min,用含血清的完全培养基混成密度为5×109~5×1011个/L的悬液,吸取悬液100 μL加到含有培养基2 mL的6孔板,待孔内细胞密度为70%时,吸掉培养孔内的培养基,用磷酸盐缓冲液轻柔洗涤2次,加无糖培养基2 mL,置于37 ℃的含5%CO2、94%N2及1%O2恒温培养箱中培养4 h,更换培养基为含10%胎牛血清的DMEM完全培养基,更换培养条件37 ℃、5%CO2,继续培养18 h,为OGD/R组。
1.2.5PC12细胞的转染 选取正常生长的PC12细胞,用含血清的培养基混制成密度为5×108个/L的细胞悬液,接种到6孔板中,待密度达50%时,分别在相应的孔进行以下转染操作:转染miR-214-3pmimic(mimic组)、mimic NC(mimic NC组)、miR-214-3pinhibitor(inhibitor组)、inhibitor NC(inhibitor NC组),转染后培养4~6 h,更换新鲜培养基继续培养48 h。
1.2.6PC12细胞的OGD/R+miR-214-3pmimic模型 转染miR-214-3pmimic到PC12细胞后,进行缺糖缺氧4 h再灌注18 h,为OGD/R+mimic组。
1.2.7miR-214-3p和BCL2L2 mRNA水平 采用实时荧光定量聚合酶链式反应(Real-time fluorescent quantitative PCR,Real-time PCR)检测, 用TRIZOL法从Control组、OGD/R组PC12细胞的总RNA并测定浓度,取 0.5 μg进行逆转录获取cDNA(TUREscript 1st Stand Cdna SYNTHESIS kit);取cDNA 1 μL同SYBR及相应的引物混合制成10 μL的体系,上机循环;miR-214-3p的循环条件为95 ℃ 3 min,95 ℃ 10 s、60 ℃ 30 s,39个循环,70 ℃ 15 s完成反应;BCL2L2的循环条件为95 ℃ 3 min,95 ℃ 10 s、60 ℃ 30 s,40个循环,70 ℃、15 s完成反应。引物序列见表1。miR-214-3p以U6作为内参照,BCL2L2以GAPDH作为内参照,分别计算miR-214-3p和BCL2L2 mRNA的相对表达水平。

表1 引物序列Tab.1 Primer sequence
1.2.8BCL2L2、Cleaved-caspase3、Bax、Bcl2蛋白表达 采用蛋白免疫印迹(Western blot)进行检测,提取mimic组、mimic NC组、inhibitor组、inhibitor NC组总蛋白,检测BCL2L2表达;提取Control组、OGD/R组及OGD/R+mimic组总蛋白,检测Cleaved-caspase3、Bax、Bcl2表达。各组别用蛋白裂解液充分裂解总蛋白后,收集总蛋白并利用BCA定量试剂盒对蛋白质进行定量,根据定量结果将不同组蛋白按相同的量与5×SDS上样缓冲液按4 ∶1混合,100 ℃煮沸10 min变性蛋白;SDS-PAGE电泳、转膜2 h、5%牛血清白蛋白(bovine serum albumin,BSA)封闭液封闭2 h,BCL2L2、Cleaved-caspase3、Bax、Bcl2及内参一抗4 ℃孵育过夜,相应二抗室温孵育2 h,曝光。
1.3 统计学分析
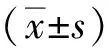
2 结果
2.1 miR-214-3p靶向调控BCL2L2的表达
选用数据库Targetscan 7.2进行预测,结果显示miR-214-3p与野生型BCL2L2的3′UTR端存在结合位点,而与3′UTR发生突变的BCL2L2之间未发现结合位点;在293T细胞中,荧光素酶报告基因结果显示,与wt + NC组比较,wt + mimic组中荧光素酶的活性降低(P<0.05),而mut + NC组与mut + mimic组荧光素酶活性未发生明显变化(P>0.05);在PC12细胞中,与mimic NC组比较,mimic组BCL2L2蛋白表达下调,与inhibitor NC组比较,inhibitor组BCL2L2蛋白表达上调(P<0.05)。见图1。

注:A为数据库预测结合位点(加粗字母表示预测结合序列位点),B为293T细胞双荧光素酶报告基因结果,C、D分别为PC12细胞中BCL2L2的蛋白表达和定量结果;(1)与wt+NC组或mimic-NC组比较,P<0.05;(2)与inhibitor-NC组比较,P<0.05。图1 miR-214-3p靶向调控BCL2L2蛋白表达Fig.1 miR-214-3p inhibited BCL2L2 expression via sponging BCL2L2
2.2 miR-214-3p与BCL2L2的表达
与Control组比较,OGD/R组PC12细胞中BCL2L2的mRNA和蛋白表达水平降低、miR-214-3pmRNA表达升高,差异均有统计学意义(P<0.05)。见图2。

注:A、B分别为BCL2L2蛋白表达和定量结果,C、D分别为BCL2L2和miR-214-3p mRNA表达量;(1)与Control组比较,P<0.05。图2 PC12细胞miR-214-3p与BCL2L2的表达Fig.2 The expression levels of miR-214-3p and BCL2L2 in PC12 cell
2.3 相关凋亡蛋白的表达
免疫印迹结果显示,与Control组相比,OGD/R组PC12细胞中凋亡蛋白Cleaved-caspase3和Bax的表达增加、抗凋亡蛋白Bcl2的表达降低,差异均有统计学意义(P<0.05);与OGD/R组比较,OGD/R+mimic组PC12细胞中Cleaved-caspase3和Bax的表达增加、Bcl2的表达降低(P<0.05)。见图3。

注:A为Cleaved-caspase3、Bax及Bcl2蛋白的电泳结果,B、C及D分别为Cleaved-caspase3、Bax及Bcl2蛋白表达的定量结果;(1)与Control组比较,P<0.05; (2)与OGD/R组比较,P<0.05。图3 miR-214-3p通过靶向BCL2L2调控凋亡蛋白表达Fig.3 miR-214-3p regulated the expression levels of apoptosis-related proteins by targeting BCL2L2
3 讨论
脑卒中的高发病率、高致残及高死亡率给世界医疗卫生和经济造成重大负担,寻找有效治疗脑卒中的方案依旧亟待解决。近年研究发现,miRNA在脑卒中的发生发展中发挥一定作用,miRNA不仅能作为一种潜在的疾病治疗靶标,其异常表达也可作为疾病早期的诊断指标[16-17]。而miR-214-3p主要与细胞的增殖、迁移及生存等相关,如miR-214-3p通过靶向细胞黏附分子促进骨肉瘤的增殖、迁移及浸润[18-20]。近年来还发现miR-214-3p能参与细胞凋亡的调控,神经元凋亡是脑卒中的重要病理特征之一[21-24]。考虑到miRNA可参与基因表达的调控,从而参与细胞多种生理或病理过程,因此本研究旨在探究miR-214-3p是否能调控凋亡相关蛋白的表达,从而参与调控神经元的凋亡。
本研究首先利用Targetscan 7.2在线数据库进行预测,发现miR-214-3p与野生型的BCL2L2的3′UTR区之间存在结合位点;接着在293T细胞上进行荧光素酶基因报告实验,实验结果显示,与wt+mimic NC组相比,wt+mimic组荧光素酶活性下降,而当BCL2L2 3′UTR位点发生突变时,mut+mimic NC组和mut+mimic 组荧光素酶活性均未发生明显变化。这近一步说明miR-214-3p能靶向结合并下调BCL2L2表达。
为了进一步验证设想,本研究在PC12细胞上进行以下实验。首先对PC12细胞进行缺糖缺氧再灌注处理,成功构建脑卒中细胞模型后,实时荧光定量结果显示,与Control组比较,经OGD/R处理后的PC12细胞中miR-214-3p表达上调,而抗凋亡基因BCL2L2 mRNA表达下调,同时免疫印迹结果显示BCL2L2蛋白表达均下调。BCL2L2作为Bcl2的家族成员之一,同样具有抗凋亡的作用[25],当BCL2L2的表达受到抑制后,抗凋亡作用减弱,细胞凋亡增加。因此推测,miR-214-3p的异常表达可能与脑卒中的发生相关,且miR-214-3p很有可能是通过靶向调控BCL2L2来参与疾病的发生。
Fan等[26]研究表明,下调miR-214-3p表达能减轻脊髓神经元的凋亡。本研究结果显示,与Control组相比,OGD/R组PC12细胞的BCL2L2表达下调,同时还检测到抗凋亡蛋白Bcl2的表达也发生下调,凋亡蛋白Bax和Cleaved-caspase3的表达增加;在PC12细胞中转染miR-214-3pmimic再进行OGD/R处理后,与OGD/R组相比,BCL2L2和Bcl2的表达下调,凋亡蛋白Bax和Cleaved-caspase3的表达增加。这一结果表明,过表达miR-214-3p,可以减少抗凋亡蛋白的表达,上调凋亡蛋白的表达,从而促进神经元的凋亡,这与前述报道一致。
综上所述,本研究表明miR-214-3p可能通过靶向抑制抗凋亡蛋白BCL2L2的表达,继而上调凋亡蛋白的表达,使神经元的凋亡加重,从而参与脑卒中的发生。虽然本研究仅在细胞层面进行,未深入到动物层面,但这一探讨为后续的研究提供了新思路。
