PD-1免疫检查点与膀胱癌灌注药物疗效的研究〔1〕
2021-07-31张文圣杨洋卢依刚邓新喜万滨张卓李勋刚
张文圣,杨洋,卢依刚,邓新喜,万滨,张卓,李勋刚
(九江市第一人民医院,江西 九江 332000)
膀胱癌是泌尿系统恶性肿瘤之一。近年来,全世界死于膀胱癌的人数逐年增加[1]。美国2017年报道的数据显示大约有79 000多例新发膀胱癌病例,其中死亡人数约为16 870 例[2]。膀胱癌的治疗在临床实践中仍然面临许多挑战,治疗后患者预后不理想。当前,手术联合放化疗是膀胱癌的主要治疗方式。近年来,肿瘤免疫疗法的飞速发展从根本上改变了临床抗肿瘤方式,为治疗肿瘤打开了新的大门。美国癌症研究中心在2016年年度报告中表示,免疫疗法被评为既往癌症相关研究重要进展[3]。免疫检查点包括PD-1/PD-L1,CTLA-4,BTLA,Tim-3等,属于免疫抑制分子的一种,通过调节免疫反应来保护正常的组织。PD-1免疫检查点特异性强,分布广泛,作用持久,近年来已广泛用于肿瘤免疫治疗的研究[4],研究热点集中于免疫学检查点抑制剂。大量研究证实,对于卵巢癌、膀胱癌、肾细胞癌、恶性黑色素瘤、宫颈癌等恶性肿瘤的治疗,PD-1免疫检查点抑制剂均有效。Durvalumab属人源化PD-1 IgGlk单克隆抗体,可与PD-1蛋白结合,进而影响T细胞表面CD80与PD-1的结合,从而解除对免疫应答的抑制,使肿瘤细胞逃避T细胞追杀时,不能利用PD-L1/PD-1途径逃脱追杀[5-6]。也有报道[7]称PD-L1蛋白单克隆抗体对缺乏PD-L1表达但没有检测到毒性的相邻癌细胞具有一定的细胞杀伤作用以及旁观者杀伤作用。
吉西他滨(GEM)是抑制DNA合成的抗癌药物,可抑制抗脱氧胞苷核苷酸代谢过程,属脱氧胞苷类似物[8]。GEM可在一定条件下,在人体内转化为具有一定活性的三磷酸核苷、二磷酸核苷,发挥其杀伤肿瘤细胞的作用;并可干扰DNA聚合酶工作过程,影响DNA正常配对,进而影响DNA合成进程、抑制肿瘤细胞生长。GEM应用于人体内治疗可增强自身作用强度,进一步增强其药物活性[9-10]。GEM具有低毒性的特点,在与其他化疗药物合用时,毒性反应、药物交叉耐药性均无叠加作用,因此被广泛用于膀胱癌术后灌注治疗及其他恶性肿瘤治疗中。本研究旨在分析PD-1免疫检查点抑制剂Durvalumab对吉西他滨诱导膀胱癌T24细胞凋亡的作用,从而为膀胱癌的治疗提供理论依据。
1 材料与方法
1.1 材料

1.2 方法
1.2.1 细胞培养
人膀胱癌T24细胞培养方法:常规传代培养于1640细胞培养基(10%胎牛血清),培养条件为37 ℃,5% CO2;实验正式开始时间为对数生长期。将其分为对照组、吉西他滨组和吉西他滨+Durvalumab组。
1.2.2 定量聚合酶链反应检测Caspase-3基因的表达
采用定量聚合酶链反应(Q-PCR)检测Caspase-3基因的表达,3组均严格依据试剂盒说明书操作,达到时间后对处理的细胞进行收集,按照Trizol法步骤提取总的RNA,之后取出1 μg RNA进行逆转录,Q-PCR法扩增cDNA片段。Q-PCR反应体系:Mix10μL,primer F0.4μL,primer R0.4μL,Rox 0.4 μL,CDNA 2 μL,ddH2O 6.8 μL。反应条件:94 ℃ 5min;94 ℃ 15s,60 ℃1min,共循环40次,95 ℃ 15 s,60 ℃ 1 min,95 ℃ 30 s,60 ℃ 15 s。
1.2.3 蛋白质印迹法检测Caspase-3蛋白的表达
细胞处理完成后以胰酶消化,收集细胞于1.5 mL离心管中,1 200 r/min离心5 min,取下层细胞,行2次清洗[1 mL磷酸缓冲液(PBS)],1 200 r/min离心5 min,取下层细胞,加裂解和提取缓冲液(RIPA)漩涡震荡,然后行30 min冰浴(4 ℃),离心(12 000 r/min,15 min),转移上清到1.5 mL离心管中,用双辛酸(BCA)定量。加入6×Lodding buffer,混匀,煮沸(100 ℃,5 min)。准备电泳凝胶,结合最终定量,取样量为50 μg,80 V跑至浓缩胶底部,后设置120 V直至跑至凝胶底部;转膜(300 mA,1.5 h),脱脂奶粉(TBST)封闭(含有5%BSA),兔单抗Caspase-3(1∶2 000),鼠单抗β-actin(1∶1 000),4 ℃反应,过夜,后摇床上行3次TBST清洗(每次5 min);行室温孵育(羊抗兔和羊抗鼠二抗(1∶3 000),行3次TBST清洗(每次5 min),电化学发光(ECL)显色;扫描分析仪以化学发光法进行。
1.2.4 细胞代谢活性比色法检测细胞的增殖能力
正常培养T24细胞,使细胞密度超过80%,将浓度调整为5×104/mL,接种96孔培养板,每孔150 μL,等待细胞黏附好,然后开始稀释药物,细胞处理方法与之前相同。另外,阴性对照为未添加药物的正常组,并且将没有细胞的培养基用作为空白对照。每组有6个复合孔。用细胞代谢活性比色法(MTT)检测药物对细胞活性的影响,到达作用时间后,每个孔均加入10 μL 5 g/L MTT溶液,再培养3 h,在观察过程中,用移液管小心吸出培养液,每个孔加150 μL二甲基亚砜(DMSO);吸光度波长为490 nm,计算细胞抑制率。
1.2.5 膜联蛋白V凋亡检测试剂双染法检测细胞凋亡
用膜联蛋白V凋亡检测试剂(AnnexinV-FITC/PI)双染法检测细胞凋亡。将细胞在六孔板中分组接种,并用药物处理,到达作用时间后收集细胞,PBS洗涤2次,取3×105个细胞,加入195 μL结合液重悬细胞,之后加入5 μL AnnexinV-FITC,混匀,在黑暗中于室温下孵育10 min,然后离心并丢弃上清液。加入200 μL结合溶液使细胞轻柔地重悬,加入20 μL PI充分混合,将样品包裹在锡箔中,并于1 h内在流式细胞仪上进行检测。
2 结 果
2.1 Q-PCR法检测Caspase-3的基因表达量
吉西他滨+Durvalumab组Caspase-3基因表达水平明显高于吉西他滨组和对照组,且对照组为最低(P<0.001;P<0.01),说明Durvalumab可以促进吉西他滨对T24的凋亡作用(见图1)。

**表示吉西他滨+Durvalumab组与对照组比较,P<0.01;***表示吉西他滨组与对照组比较P<0.001
2.2 蛋白质印迹法检测Caspase-3蛋白的表达水平
吉西他滨+Durvalumab组Caspase-3蛋白的表达水平明显高于吉西他滨组和对照组,而对照组与吉西他滨组比较差异无统计学意义,说明Durvalumab可以促进吉西他滨对T24的凋亡作用(见图2和图3)。

图2 各组Caspase-3蛋白表达水平

***表示吉西他滨+Durvalumab组分别与对照组和吉西他滨组比较,P均<0.001
2.3 MTT法检测三组T24细胞的增值能力
吉西他滨组和吉西他滨+Durvalumab组与对照组相比细胞增殖水平明显降低,且吉西他滨+Durvalumab组为最低,差异有统计学意义(P<0.001;P<0.01)(见图4)。

**表示吉西他滨+Durvalumab组与对照组比较,P<0.01,***表示吉西他滨+Durvalumab组与吉西他滨比较P<0.001
2.4 流式细胞仪检测细胞的凋亡
吉西他滨+Durvalumab组凋亡表达水平明显高于吉西他滨组和对照组,吉西他滨组与对照组比较差异无统计学意义(见图5和图6)。
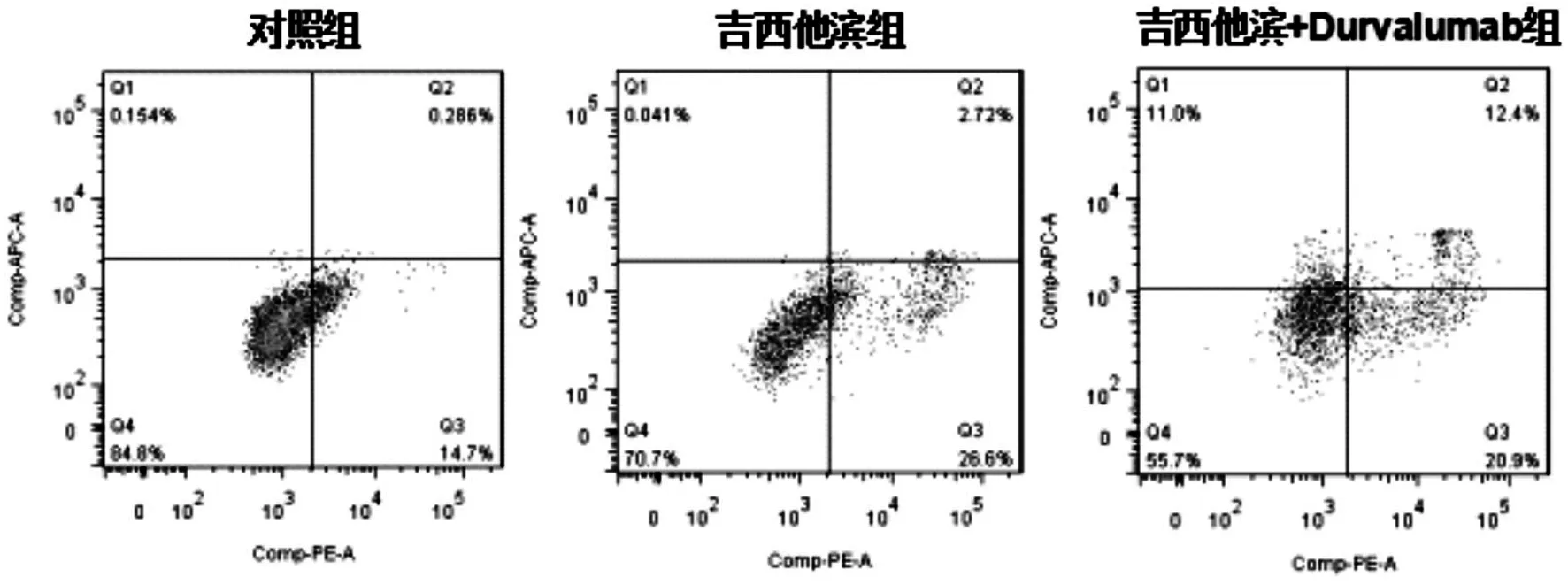
图5 药物处理后三组细胞的凋亡水平

***表示吉西他滨+Durvalumab组与对照组比较,吉西他滨组与对照组比较,P均<0.001
3 讨 论
近年来,膀胱癌是泌尿系统常见肿瘤,其发病率和病死率逐年升高,且具有高复发率和高进展率。多项研究证实[11-12],膀胱癌与免疫逃逸密切相关,膀胱癌免疫逃逸的原因是多个负性共刺激分子(免疫检查点)(例如PD-1)的异常表达,导致特异性T细胞应答下调,造成肿瘤细胞逃逸。化学疗法是治疗膀胱癌的一种重要手段。Kilani等[13]发现吉西他滨有选择地对人和小鼠膀胱移行细胞癌细胞系产生细胞毒性作用。吉西他滨是一种嘧啶核苷酸类似物,已被广泛用于膀胱癌,尤其肌层浸润性膀胱癌的化学疗法已经将吉西他滨列为一线治疗方案。但目前肿瘤化疗治疗中,患者耐药性提升是影响化疗效果和肿瘤控制能力的重要因素,因此如何减轻化疗药物耐药性、提升药物敏感性是肿瘤治疗领域研究重点。免疫检查点分子是机体调节免疫应答和建立对自身抗原免疫耐受的重要“刹车”分子,其中PD-1为研究热点。PD-1属免疫制剂受体,由凋亡性T细胞杂交瘤消减杂交获得,其表达情况与T淋巴细胞免疫缺陷密切相关。当PD-1与它的配体PD-L1结合时,可以激活负调节途径,抑制T细胞增殖,进而抑制肿瘤细胞。临床研究发现,除晚期膀胱癌外,PD-1免疫检查点抑制剂用于其他部位肿瘤也可获得理想疗效,甚至可超过晚期膀胱癌的治疗效果。PD-1抗体的直接靶点是PD-1,PD-1是最直接的预测指标,具有非常好的预测效果,但是目前利用PD-1作为检测指标,在组织中还存在一些技术性的问题。本研究表明,在对膀胱癌T24细胞凋亡干预中(吉西他滨诱导),PD-1免疫检查点抑制剂Durvalumab对其具有促进作用。肿瘤细胞免疫反应期间,其肿瘤抗原的呈递过程需依靠免疫系统,并激活特异性T细胞,以应对免疫杀伤作用。T淋巴细胞工作过程需接受共刺激信号、抗原呈递信号完成激活过程,而共刺激信号参与人体免疫反应需依靠向淋巴细胞提供调节信号(阴性或阳性)。人体共刺激分子中,PD-1/PD-L1是关键分子,其中PD-1表达于不同活化后T细胞表面,PD-L1可以在诸如造血细胞和胰岛的组织和器官表面上以及各种人类实体肿瘤细胞的表面上表达,通过探索免疫检查点PD-1对癌症治疗的相关影响,可为癌症的早期根治及用药方案提供理论依据。
癌症免疫疗法使我们了解了恶性肿瘤的治疗方法,并为癌症患者带来了希望。虽然在膀胱癌免疫抑制剂研究中效果显著,但仍有许多未知领域有待探索。我们不仅要探索其深度,而且必须扩大研究宽度。在接下来相关研究中,我们应积极探索更多免疫检查点,以研发、探索更具特异性的肿瘤治疗药物。
