白三烯B4在蛛网膜下腔出血后血管痉挛中作用的实验研究
2021-07-30熊平张涛李峥
熊平 张涛 李峥
随着蛛网膜下腔出血治疗的不断进步,致死率和致残率有所下降,但其导致损伤的具体机制目前仍不十分清楚[1-3]。白三烯是一类具有高度生物活性的炎性介质,其合成主要有中性粒细胞、肥大细胞、嗜酸性及嗜碱性粒细胞等。其中白三烯B4(leukotriene B4,LTB4)被证实为具有高度活性的中性粒细胞趋化因子,通过与白三烯B4受体1(BLT1)结合发挥趋化作用[4-6]。研究表明LTB4及BLT1可能参与了蛛网膜下腔出血后脑血管痉挛的发生发展[7-8],具体机制不十分清楚。因此,本实验探讨LTB4在蛛网膜下腔出血后脑血管痉挛中的作用及其相关机制。
1 材料与方法
1.1 实验动物及其分组SD大鼠由川北医学院动物实验中心提供。先将60只SD大鼠随机分为正常组(NM组,6只),蛛网膜下腔出血组(SAH组,18只),蛛网膜下腔出血+LTB4抑制剂组(SAH+U75302 组,18 只),假手术组(Sham 组,18 只),其中SAH组、Sham组及SAH+U75302组依据时间节点又分为出血后1 d、3 d及5 d三个亚组,每组6只。采用枕大池二次注血法建立SAH模型,正常组不予任何处理,标准饲养,SAH组建模成功后予以标准饲养,SAH+U75302组建模成功后每天腹腔注射U75302(20 ng/d),Sham组建模成功后每天腹腔注射0.9%生理盐水。本次造模中SD大鼠死亡8只,用SD大鼠进行补充。
1.2 标本采集各组分别于造模成功后1 d、3 d及5 d采集标本。先抽取血液标本,后采用4%多聚甲醛灌注,留取大鼠脑桥段(包含基底动脉)脑组织标本固定,后期行HE染色、免疫组化及血液中LTB4含量的测定。
1.3 HE染色常规行HE染色,并测量基底动脉管壁厚度及直径。为减少误差,采用校正直径及校正血管壁厚度。校正直径=(最长内径×最短内径)1/2,校正血管壁厚度=[(最长外径-最长内径)+(最短外径-最短内径)]/4[9-10]。
1.4 免疫组化染色采用二步法进行免疫组化染色,抗体选用Abcam公司的鼠抗单克隆NF-κB抗体,以核内棕黄色为染色阳性,在高倍镜下选取5个视野,分别计算染色阳性细胞占所有细胞的阳性百分率,后取平均值作为NF-κB的表达情况。
1.5 大鼠血液中LTB4含量检测采用ELISA法,按照试剂盒操作说明书检测。
1.6 统计学方法采用SPSS 22.0进行分析。定量资料以均数±标准差(±s)表示,采用方差分析,多组均数间的两两比较采用SNK-q检验,检验水准 α=0.05。
2 结果
2.1 脑组织的大体观察NM组及Sham组大鼠蛛网膜下腔未见血液,SAH组(图1)及SAH+U75302组大鼠的脑沟、脑干腹侧、基底池均可见有血液或血凝块。
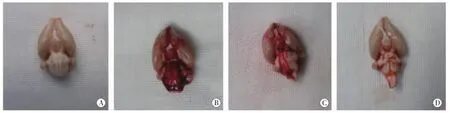
图1 各组各时间点大脑组织的大体观察 A.正常组,蛛网膜下腔未见明显血液;B、C、D.分别为蛛网膜下腔出血组1 d、3 d及5 d脑沟、脑干腹侧、基底池均可见有血液或血凝块,且随时间逐渐减少。
2.2 血管壁的病理学改变Sham组与NM组基底动脉内膜及外膜管壁平整,内皮细胞结构完整,内弹力膜未见明显皱褶、断裂。平滑肌细胞排列规整。SAH组及SAH+U75302组内膜出现皱褶呈现波浪状改变,局部可有断裂,中膜平滑肌细胞增生,平滑肌层增厚,可见粒细胞浸润(图2)。

图2 各组各时间点基底动脉HE染色结果 A、H.NM组及Sham组 HE染色内膜及外膜管壁平整,内皮细胞结构完整,内弹力膜未见明显皱褶、断裂。平滑肌细胞排列规整。B、C、D.SAH组1 d、3 d、5 d 内膜出现皱褶呈现波浪状改变,局部可有断裂,中膜平滑肌细胞增生,平滑肌层增厚,可见粒细胞浸润。E、F、G.SAH+U75302组1 d、3 d、5 d,血管壁的改变程度较SAH组轻。
2.3 基底动脉直径见表1。各时间点Sham组与NM组比较,基底动脉直径无明显差异 (P均>0.05)。各时间点Sham组、SAH组及SAH+U75302组基底动脉直径有统计学差异(F=58.63、189.63、159.53,P均<0.05),Sham 组基底动脉直径均大于SAH组和SAH+U75302组,SAH组基底动脉直径均小于SAH+U75302组。
2.4 基底动脉管壁厚度见表1。各时间点Sham组与NM组基底动脉管壁厚度无统计学差异(P均>0.05)。各时间点 Sham组、SAH组及 SAH+U75302组基底动脉管壁厚度有统计学差异(F=22.93、314.01、490.94,P 均<0.05),Sham 组基底动脉管壁厚度均小于SAH组、SAH+U75302组,SAH组基底动脉直径均大于SAH+U75302组。

表1 各时间点大鼠基底动脉校正直径及血管壁厚度(n=6)
2.5 大鼠血液中LTB4含量见表2。各时间点Sham组与NM组血液中LTB4含量无明显差异(P均>0.05);各时间点 Sham组、SAH组及 SAH+U75302组血液中LTB4的含量有统计学差异(F=59.86、259.17、280.79,P 均<0.05),SAH 组、SAH+U75302组大鼠血液中LTB4的含量较Sham组增高,SAH+U75302组LTB4的含量较SAH组减少。
2.6 基底动脉血管壁中NF-κB阳性细胞表达情况见表2。各时间点Sham组与NM组基底动脉血管壁中NF-κB阳性细胞百分率无统计学差异(P均>0.05)。各时间点Sham组、SAH组及SAH+U75302组NF-κB阳性细胞百分率有统计学差异(F=198.32、854.57、1024.27,P 均 <0.05),SAH 组及 SAH+U75302组 NF-κB的表达较 Sham组增高,SAH+U75302组 NF-κB的表达较 SAH组减少。

表2 各时间点大鼠血液中LTB4含量及血管壁NF-kB阳性细胞百分率(n=6)
3 讨论
目前越来越注重蛛网膜下腔出血患者早期脑损伤及血管痉挛机制的研究。其中蛛网膜下腔出血后血管痉挛的作用机制十分复杂。导致其出现血管痉挛的主要机制[11-13]目前公认的有:①免疫炎症反应;②血管壁的结构和功能障碍;③血管舒张因子调节失衡;④血管内皮细胞凋亡;⑤血管活性物质的释放,如血管紧张素、5-羟色胺、儿茶酚胺等;⑥自由基大量的生成,打破了自由基产生和清除的动态平衡。其中蛛网膜下腔出血后炎症反应可能发挥主导作用[14-16]。近年来研究表明蛛网膜下腔出血后血液及脑脊液中LTB4含量明显升高,BLT1在血管内皮细胞内有明显表达,提示LTB4可能参与了蛛网膜下腔出血后的血管反应,但具体的作用机制不清楚[17]。

图3 各组各时间点基底动脉 NF-κB 免疫组化染色结果 A、H.NM 组及 Sham;B、C、D.SAH 组 1 d、3 d、5 d;E、F、G.SAH+U75302组 1 d、3 d、5 d组血管壁NF-κB的表达情况。NM组表达较少,SAH组随时间增加表达逐渐增加,SAH+U75302各组也随时间表达逐渐增加,在内皮细胞,平滑肌层及外膜均有表达,SAH组与SAH+U75302组各时间点相比较,SAH+U7530组表达明显减少(P<0.05)。
本实验表明,各时间点SAH组基底动脉管壁厚度比NM组及Sham组厚(P<0.05),血管直径均较NM组及Sham组小(P<0.05),表明蛛网膜下腔出血后大鼠基底动脉出现了血管痉挛,Sham组血管痉挛程度较SAH组明显减轻,抑制LTB4能够明显改善血管痉挛程度。同时也在SAH组大鼠基底动脉壁中发现有大量粒细胞的浸润,表明粒细胞可能参与了蛛网膜下腔出血后血管痉挛的发生。研究[18-19]表明粒细胞激活后会释放大量的炎症因子,如肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α),白介素-1β(Interleukin-1β,IL-β),髓过氧 化 物 酶 (myeloperoxidase,MPO)以及核因-κB(nuclear-transcription factor-Kappa B,NF-κB)等。因而我们推测血管壁中大量存在的粒细胞可能是受到了LTB4的诱导趋化,使其血管内的粒细胞大量浸润血管壁,粒细胞释放大量的炎症介质,促使多种炎症通路激活,从而导致血管痉挛的发生。抑制LTB4,减少粒细胞的诱导趋化,从而改善血管痉挛。
LTB4作为一种具有高度活性的粒细胞趋化因子,而NF-κB在神经炎症中处于中心地位,那么LTB4及NF-κB是否参与了血管痉挛的发生?在SAH组与SAH+U75302组各时间点中,血液中LTB4的含量及NF-κB的表达均比NM组及Sham组增加(P<0.05),SAH+U75302组与 SAH组相比LTB4的含量及NF-κB的表达减少(P<0.05)。我们推测蛛网膜下腔出血后,血液中的LTB4大量表达,趋化大量粒细胞通过某种途径进入血管壁,具体途径需进一步研究,同时粒细胞释放大量NF-κB,激活NF-κB信号通路,导致血管痉挛的发生。炎症介质导致血管痉挛机制不明确,有研究表明炎症介质可导致血管平滑肌细胞发生表型转化和血管重塑,从而导致血管痉挛[20-24],但具体机制也需进一步研究。本研究表明,SAH+U75302组血管痉挛程度减轻可能是通过使用LTB4抑制剂,阻断LTB4与BLT1结合,导致LTB4的趋化作用减弱,粒细胞进入血管壁减少,从而NF-κB释放减少,抑制NF-κB介导的炎症反应信号通路,从而减轻血管痉挛。
蛛网膜下腔出血后脑血管痉挛目前还没有特异的治疗方案,抑制BLT4能够改善血管痉挛程度,从而为临床提供一种新的治疗方式,与此同时BLT1特异性拮抗剂也具有潜在的临床应用价值。
