基于cAMP/PKA/CREB信号通路独参汤对衰老模型大鼠认知功能障碍的影响
2021-07-30王继凤刘晓冉郭文军明思彤曲晓波
王继凤,刘晓冉,隋 欣,阚 默,李 辉,郭文军,杨 擎,张 壮,明思彤,李 娜,曲晓波
(1.长春中医药大学分子药理实验室,吉林 长春130117;2.吉林省前卫医院普外科,吉林 长春130012)
中草药对多种疾病表现出独特的治疗作用。独参汤(Dushen Tang,DST)始记载于《十药神书》,由单味人参煎煮而成[1],并已在《世界药典》上出版,其中所述的提取方法是水煎煮[2-3],其应用历史悠久,已被广泛使用,特别是其可用于增强记忆能力[4]。现代药理研究[5]证实:人参具有多种药理作用,包括增强记忆力、免疫调节、抗氧化应激和抗衰老。人参可通过增强海马溶血磷脂酸受体蛋白1受体的表达和改善神经元存活进而改善D-半乳糖(D-galactose,D-gal)诱导的大鼠记忆缺陷[4]。研究[6-8]表明:DST主要有效成分为人参皂苷等,对阿尔茨海默病(Alzheimer’s disease,AD)和衰老相关的神经退行性疾病均有良好的疗效。环磷酸腺苷(cyclic adenosine monophosphate,cAMP)/蛋白激酶A(protein kinase A,PKA)/cAMP反应元件结合蛋白(cAMP-response element binding protein,CREB)信号转导通路在中枢神经系统中起着关键的作用,能促进神经细胞的存活、再生和分化等,然而DST对该信号通路的作用尚未见报道。本研究基于cAMP/PKA/CREB信号通路探讨DST对D-gal诱导衰老模型大鼠认知功能障碍的改善作用,为进一步深入研究其作用机制提供参考。
1 材料与方法
1.1 实验动物、主要试剂和仪器SPF级雄性SD大鼠40只,体质量(200±10)g,购于长春市亿斯实验动物技术有限责任公司,动物生产许可证号:SCXK(吉)-2018-0007。大鼠饲养于长春中医药大学动物饲养中心,温度20℃~22℃,相对湿度50%±10%。人参购自吉林省芝恩堂参茸特产有限公司,经长春中医药大学中药资源学教研室鉴定,为15年以上五加科植物人参(Panax ginseng)。D-gal(上海源叶生物科技有限公司,批号H17M 7C14868),丙二醛(malondialdehyde,MDA)试剂盒、超氧化物歧化酶(superoxide dismutase,SOD)试剂盒和谷胱甘肽(glutathione,GSH)试剂盒(南京建成科技有限公司,批号分别为20200629、20200630和20200630),超敏ECL发光检测试剂盒(中国Proteintech公司,批号071119200916)。Morris水迷宫视频跟踪分析系统(成都泰盟科技有限公司),透射电子显微镜(美国Tecnai公司),凝胶成像仪(美国Aplegen公司)。
1.2 实验动物分组和给药40只SD大鼠随机分为对照组、模型组、阳性药组和DST组,每组10只。除对照组外,其余各组大鼠按照500 mg·kg-1·d-1剂量腹腔注射D-gal 40 d建立衰老模型[9-10]。在注射D-gal第5天,阳性药组大鼠给予维生素E 0.027 g·kg-1·d-1[11],DST组 大 鼠 给 予 独 参 汤5 mL(按照传统工艺提取,相当于生药量0.3 g·kg-1·d-1,该剂量根据药典规定人参的最低服用剂量3 g·d-1折算所得)至造模结束,对照组大鼠给予等容量生理盐水。
1.3 观察大鼠一般状况并记录体质量实验期间观察大鼠的毛发、精神和活动情况,每7 d用电子秤测定一次体质量,并绘制生长曲线。
1.4 Morris水迷宫实验检测大鼠学习记忆能力
①定位航行实验:随机将平台摆放在其中一个象限的中间位置,水面高于平台以上,并且将水迷宫中加入足够的二氧化钛,充分搅拌混匀,便于仪器捕捉大鼠的位置。随机将大鼠放入水池。计时开始后,仪器根据大鼠轨迹自动记录运动总距离、游泳轨迹和到达平台时间(即逃避潜伏期),若大鼠2 min没有找到平台则大鼠的潜伏期定为120 s。
1.5 生化试剂盒检测大鼠脑组织中SOD、GSH活性和MDA水平大鼠按“1.2”中的方法进行分组给药。实验结束后将大鼠戊巴比妥钠麻醉取全脑,将生理盐水预冷置于培养皿中,快速冲洗全脑,用滤纸吸干脑组织表面残存液体,精密称质量,按试剂盒测定说明书检测大鼠脑组织中SOD、GSH活性和MDA水平。
1.6 酶联免疫吸附测定法(enzyme linked immunosorbent assay,ELISA)检测大鼠脑组织中cAMP水平取各组大鼠脑组织,精密称质量,按试剂盒说明书中1∶9的比例进行脑组织匀浆,2 500 r·min-1离心10 min,取上清液,按ELISA试剂盒测定说明书检测大鼠脑组织中cAMP水平。
1.7 透射电镜观察大鼠海马超微结构表现各组大鼠戊巴比妥钠麻醉后,取大鼠海马组织,于4%多聚甲醛中固定。进行切片处理,在透射电镜下观察大鼠海马神经元超微结构表现。
1.8 刚果红染色观察大鼠海马组织老年斑形成情况将各组大鼠脑组织置于4%多聚甲醛进行固定,制备石蜡切片,进行刚果红染色,采用Image Scop软件对刚果红染色图片进行观察,并通过Image J软件测定老年斑面积。
1.9 Western blotting法检测大鼠脑组织中cAMP/PKA/CREB信号通路相关蛋白表达水平取各组大鼠脑组织,精密称质量后进行破碎,采用组织裂解液试剂盒提取总蛋白,并用考马斯亮蓝法进行蛋白定量,采用SDS-PAGE垂直电泳分离50 min,转膜70 min,脱脂奶粉封闭2 h,一抗4℃过夜,二抗孵育1 h,采用ECL法进行显色,拍照。凝胶成像系统分析各样本灰度值,进行定量分析。目的蛋白表达水平=目的蛋白条带灰度值/β-actin蛋白条带灰度值。
1.10 统计学分析采用SPSS 20.0统计软件进行统计学分析。大鼠水迷宫实验检测指标,大鼠脑组织中SOD、GSH活性及MDA和cAMP水平,大鼠脑组织中cAMP/PKA/CREB信号通路相关蛋白表达水平均符合正态分布,以±s表示,多组间样本均数比较采用单因素方差分析,组间样本均数两两比较采用SNK-q检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 各组大鼠体质量和行为活动D-gal注射28 d后,与对照组比较,模型组大鼠毛色逐渐发黄,枯槁无光泽,掉毛明显,皮肤弹性差,伴精神萎靡、倦怠、行动和反应迟缓,出现明显衰老体征。根据大鼠每7 d体质量分析,与对照组比较,模型组大鼠体质量有下降趋势;与模型组比较,阳性药组和DST组大鼠体质量更接近于对照组,且阳性药组和DST组大鼠相对活泼好动、毛发光亮、皮肤弹性较好。见图1。
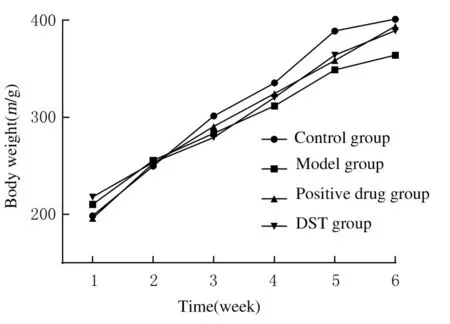
图1 各组大鼠体质量Fig.1Body weights of rats in various groups
2.2 各组大鼠水迷宫实验检测指标与对照组比较,模型组大鼠逃避潜伏期明显延长(P<0.05),总运动距离明显增加(P<0.05),穿越平台有效区域次数明显减少(P<0.05);与模型组比较,阳性药组和DST组大鼠逃避潜伏期和运动总距离明显缩短(P<0.05),穿越平台有效区域次数明显增加(P<0.05)。见图2。

图2 各组大鼠水迷宫实验检测图(A-D)和直条图(E-G)Fig.2Detection chart(A-D)and histogram(E-G)of water maze experiment of rats in various groups
2.3 各组大鼠海马神经元超微结构表现对照组大鼠海马神经元结构完整,排列规则,轮廓分明,核仁清晰,核膜平滑,线粒体大小正常,染色质均匀分布,细胞器丰富;模型组大鼠海马神经元水肿,排列不规则,核膜破裂,轮廓不清,线粒体肿胀,细胞器扩大;与模型组比较,阳性药组和DST组大鼠海马神经元上述病理改变明显改善。见图3。

图3 各组大鼠海马神经元超微结构表现Fig.3Morphological manifestations of ultrastructures of hippocampal neurons of rats in various groups
2.4 各组大鼠脑组织海马区老年斑形成情况对照组大鼠海马区刚果红染色呈阴性,具有丰富清晰的尼氏小体。模型组大鼠海马区细胞密度降低,散在分布少量的橘红色沉积物,具有嗜红色和砖红色淀粉样物质沉积,形成老年斑。阳性药组和DST组大鼠海马区仍有少量橘红色沉积物包绕蓝色细胞带,细胞体积小,排列稀疏。见图4。
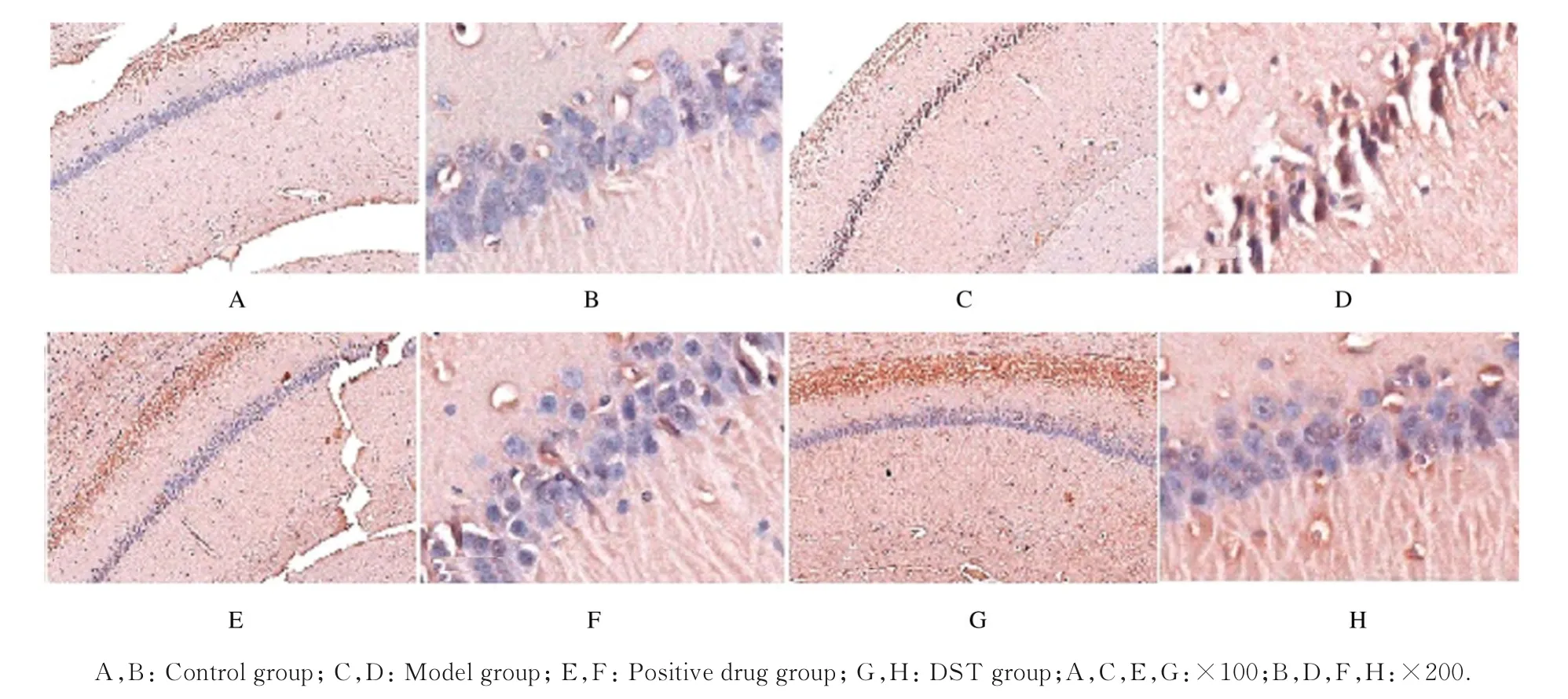
图4 各组大鼠脑组织海马区老年斑形态表现(刚果红)Fig.4Morphological manifestations of age spots in hippocampus of rats in various groups(Congo red)
采用Image J软件进行对各组大鼠海马区老年斑进行定量检测,与对照组比较,模型组大鼠海马区老年斑面积明显增加(P<0.01);与模型组比较,阳性药组和DST组大鼠海马区老年斑面积明显减少(P<0.01),与图片观察结果一致。见表1。
表1 各组大鼠海马区老年斑面积Tab.1Areas of age spots in hippocampus of rats in various groups (n=8,±,A/μm2)

表1 各组大鼠海马区老年斑面积Tab.1Areas of age spots in hippocampus of rats in various groups (n=8,±,A/μm2)
*P<0.01 compared with control group;△P<0.01 compared with model group.
Group Control Model Positive drug DST Area of age spots 0.00±0.00 1 885.00±100.13*380.00±27.22△546.33±16.62△
2.5 各组大鼠脑组织中SOD和GSH活性及MDA和cAMP水平与对照组比较,模型组大鼠脑组织中SOD和GSH活性及cAMP水平明显降低(P<0.05或P<0.01),MDA水 平 明 显 升 高(P<0.01);与模型组比较,阳性药组和DST组大鼠脑组织中SOD和GSH活性及cAMP水平明显升高(P<0.05或P<0.01),MDA水平明显降低(P<0.05)。见图5。
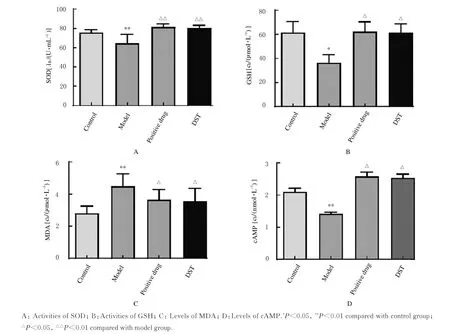
图5 各组大鼠脑组织中SOD和GSH活性及MDA和cAMP水平Fig.5Activities of SOD and GSH and levels of MDA and cAMP in brain tissue of rats in various groups
2.6 各组大鼠海马组织中cAMP/PKA/CREB通路相关蛋白表达水平与对照组比较,模型组大鼠海马组织中鸟嘌呤核苷酸结合蛋白α抑制剂(guanine nucleotide binding protein alpha inhibitor,
GNAI)蛋白表达水平明显升高(P<0.01),cAMP和腺苷酸环化酶(recombinant adenylate cyclase,ADCY)蛋白表达水平明显降低(P<0.01);与模型组比较,阳性药组和DST组大鼠海马组织中GNAI蛋白表达水平明显降低(P<0.01),cAMP和ADCY蛋白表达水平明显升高(P<0.05)。与对照组比较,模型组大鼠海马组织中PKA、CREB和脑源性神经营养因子(brainderived neurotrophic factor,BDNF)蛋白表达水平明显降低(P<0.01);与模型组比较,阳性药组和DST组大鼠海马组织中PKA、CREB和BDNF蛋白表达水平明显升高(P<0.05或P<0.01)。见图6。
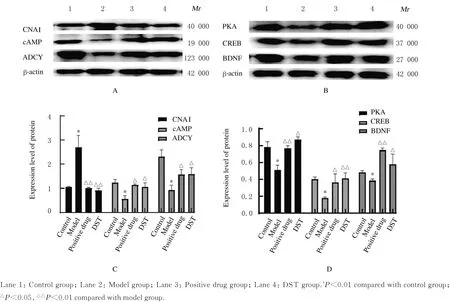
图6 各组大鼠海马组织中cAMP/PKA/CREB通路相关蛋白表达电泳图(A,B)和直条图(C,D)Fig.6Electrophoregram(A,B)and histogram(C,D)of expressions of cAMP/PKA/CREB pathway related proteins in hippocampus tissue of rats in various groups
3 讨 论
衰老是导致大脑功能逐渐衰退的主要因素,并与记忆丧失、痴呆症和认知障碍有密切关联[12-13]。本研究结果显示:DST能够改善衰老大鼠神经元受损程度,对海马区神经元修复具有明显效果,且对海马区老年斑形成具有明显改善作用;D-gal可使大鼠脑组织中SOD、GSH活性和cAMP水平明显降低,MDA水平明显升高,且DST治疗后能够校正由D-gal导致的上述改变,表明DST能够通过清除自由基,发挥抗氧化的作用,改善能量代谢,提高衰老大鼠认知功能。在生理条件下,SOD和GSH抗氧化防御系统能够清除高活性分子[14]。然而,如果活性氧的生成和细胞防御系统之间存在失衡,就会发生氧化损伤,从而启动细胞凋亡,引发神经退行性疾病。GSH是重要的抗氧化剂,具有缓解体内氧化损伤的功效,常作为重要指标来衡量机体的抗氧化能力。SOD作为体内的抗氧化酶,能够有效清除超氧阴离子自由基,产生过氧化氢,使细胞免受破坏。MDA作为自由基引发脂质过氧化形成的产物,其水平降低说明氧化应激得到改善[15]。DST对上述指标的调节,表明其可通过清除自由基和抗氧化来改善衰老模型大鼠的认知障碍。
近年来研究[16]显示:cAMP/PKA/CREB信号转导通路在中枢神经系统中起关键的作用,能促进神经细胞的存活、再生和分化等,而DST可通过激活该通路修复神经元损伤。
PKA和CREB蛋白是cAMP/PKA/CREB信号通路的关键因子,DST可促进其表达,在中枢神经系统内帮助神经元存活,促进其生长,对长期学习记忆的形成具有重要意义[17]。PKA催化丝氨酸133位点亚基磷酸化后,促进CREB与DNA结合和基因转录,从而促进BDNF蛋白合成,抑制神经元凋亡和促进其修复[18]。
本研究结果显示:DST治疗后大鼠海马组织中cAMP的水平明显升高。cAMP是由磷酸二脂酶催化形成的,是cAMP/PKA/CREB信号通路中的第二信使[19],细胞内升高的cAMP活化PKA,cAMP/PKA信号通路被激活后可刺激一系列下游因素,促进神经再生[20-21]。
CREB是真核生物细胞核内的调控因子,与神经生长、损伤、再生、突触可塑性及学习和记忆能力有密切关联[22]。CREB信号在调节神经元成熟过程中起着至关重要的作用,且CREB磷酸化可促进海马依赖性长期记忆的形成。研究[23]显示:增加CREB活性可以缓解AD转基因小鼠的记忆缺陷。本研究结果显示:DST治疗后大鼠海马组织中BDNF蛋白表达水平明显升高。BDNF是CREB的下游靶基因之一,在神经元存活中发挥重要作用,能够促进中枢神经系统的突触传递和发生[24],BDNF在脑衰老中具有多种作用[25],主要调节与学习、记忆和运动恢复相关的突触及轴突的可塑性,可减轻中枢神经系统神经元的损伤[26]。此外,BDNF促进AD后血管生成和神经再生,防止氧化损伤,并促进功能恢复[27]。
综上所述,DST可保护D-gal所致衰老大鼠海马神经元,减少大鼠海马区老年斑形成,改善学习记忆功能,其机制可能与DST清除氧自由基和发挥抗氧化作用有关,并可进一步通过激活cAMP/PKA/CREB信号通路,修复神经元损伤,从而发挥其改善衰老的作用。
