雌二醇联合1,25-二羟维生素D3对绝经后骨质疏松症大鼠的治疗作用
2021-07-30李希宁沈哲源豆晓杰闵继康
李希宁,翁 伟,沈哲源,豆晓杰,闵继康
(1.湖州师范学院医学院病理学教研室,浙江 湖州313000;2.湖州师范学院附属第一医院骨科,浙江 湖州313000)
绝经后骨质疏松症(postmenopausal osteoporosis,PMOP)是一种常见的代谢性骨疾病,是绝经后女性卵巢功能减退及雌激素水平下降导致,雌激素通过影响骨细胞的活性进而导致骨密度降低[1]。在绝经后女性中,雌激素水平降低可促进破骨细胞分化,诱导骨细胞凋亡,并抑制成骨细胞分化功能[2-3]。临床常用激素替代疗法来治疗PMOP,但单纯口服雌二醇效果有限,用量过大容易产生如肿瘤、肥胖和消化系统症状等不良反应[4]。维生素D是一种微量营养素,可代谢为多功能类固醇激素,在体内具有广泛的生物学功能[5]。活性维生素D3在体内转化为1,25-二羟基维生素D3[1,25-dihydroxyvitamin D3,1,25(OH)2D3],1,25(OH)2D3可诱导钙蛋白合成,促进小肠对钙离子的吸收,促进钙盐的更新及新骨生成,也可促进磷吸收及肾小管细胞对钙和磷的重吸收,进而提高血钙和血磷水平,有利于新骨生成和钙化[6-7]。临床上骨质疏松症治疗的目的是改善骨的负性重塑平衡,因此使骨代谢平衡变为正性至关重要[8],建议患者在服用治疗骨质疏松的药物时补充活性维生素D3[9],但其具体机制有待进一步研究。本研究通过复制大鼠PMOP模型,对比单纯应用雌二醇和雌二醇联合1,25(OH)2D3对大鼠血清生化指标和骨组织的影响,为临床预防和治疗PMOP提供新的理论依据。
1 材料与方法
1.1 实验动物、主要试剂和仪器40只SD雌性大鼠购于上海杰思捷实验动物有限公司,动物生产许可证号:SCXK(沪)2018-0004,饲养于浙江省湖州市食品药品检验研究院SPF级动物房。苯甲酸雌二醇注射液(广州白云山制药股份有限公司),1,25(OH)2D3(美国Sigma公司),碱性磷酸酶(alkaline phosphatase,ALP)、骨钙素(osteocalcin,OC)、骨保护素(osteoprotegerin,OPG)、Ⅰ型前胶原氨基端原肽(procollagen type i n-terminal propeptide,PINP)、抗酒石酸酸性磷酸酶(tartrate resistant acid phosphatase,TRACP)和核因子κB受体活化因子配体(receptor activator of nuclear factor-κB ligand,RANKL)抗体(美 国Abcam公司),逆转录(reverse transcription,RT)试剂盒(美国ThermoFisher公司),其他试剂均为国产分析纯。双能X射线骨密度仪(韩国Osteosys公司),三点力学生物仪(上海能共实业有限公司),倒置显微镜及照相系统(日本Olympus公司),PCR仪(美国ThermoFisher公司),凝胶电泳仪和成像系统(美国Bio-Rad公司)。
1.2 实验动物分组和模型建立40只雌性SD大鼠适应性喂养7 d后,随机分为对照组(10只)和手术组(30只)。手术组大鼠用10%水合氯醛0.3 mL·100 g-1腹腔注射麻醉,打开腹腔,摘除双侧卵巢,术后每只大鼠立即肌注青霉素50 000 U,每天肌注1次,持续3 d。术后喂养1周,将手术组大鼠随机分为模型组、雌二醇组和雌二醇联合1,25(OH)2D3组,每组10只。雌二醇组大鼠每周肌肉注射苯甲酸雌二醇0.05 mg·kg-13次;雌二醇联合1,25(OH)2D3组大鼠肌肉注射苯甲酸雌二醇的同时每天腹腔注射1,25(OH)2D31μg·kg-1。连续喂养24周,实验期间大鼠自由进食和进水。
1.3 大鼠血清学检测和骨组织形态表现观察实验结束后,乙醚麻醉大鼠,采血、分离血清,按照ELISA试剂盒说明书进行操作,全自动生化分析仪检测大鼠血清中ALP、OC、OPG、PINP、TRACP和RANKL水平。取大鼠左侧股骨用4%多聚甲醛溶液固定,EDTA脱钙液脱钙,以长针可刺入为准。流水过夜冲洗,定量浓度乙醇浸泡,石蜡包埋,切片,HE染色和TRACP染色,光镜下观察大鼠骨组织形态表现。
1.4 大鼠股骨骨密度(bone mineral density,BMD)检测和生物力学分析实验结束后取大鼠右侧股骨,采用双能X射线骨密度仪检测大鼠整只股骨BMD。BMD检测结束后,采用CTM 2050S万能拉力试验机,取大鼠右侧股骨全长,放入室温下的生理盐水当中浸泡3 h,取出恢复室温,两端用黏胶浇铸后放在间距为22 mm三点压缩实验台上,标本横截面短轴的方向与加速度方向一致,最大加载速度为2 mm·min-1,启动压力架开关,待股骨断裂后计算机得出各生物力学数据,包括骨组织弹性模量(elastic modulus)、刚度(stiffness)、最大应力(maximum stress)和最大承受力(maximum lord)。
1.5 采用RT-PCR法和Western blotting法检测大鼠骨组织中骨代谢指标m RNA和蛋白表达水平实验结束后取大鼠双侧胫骨,剥离肌肉和骨膜后快速置于液氮中冷冻60 min取出,置于研钵中磨碎。一侧胫骨加入TRIzol提取总RNA,并用Nano-Drop分光光度计测定RNA含量。按照High-Capacity cDNA Reverse Transcription Kit和Power SYBR®Green PCR Master Mix说明书合成cDNA并进行PCR扩增。采用StepOnePlus System software导出循环值(Ct),采用相对定量2-△△Ct法计算目的基因mRNA表达水平。引物序列见表1。
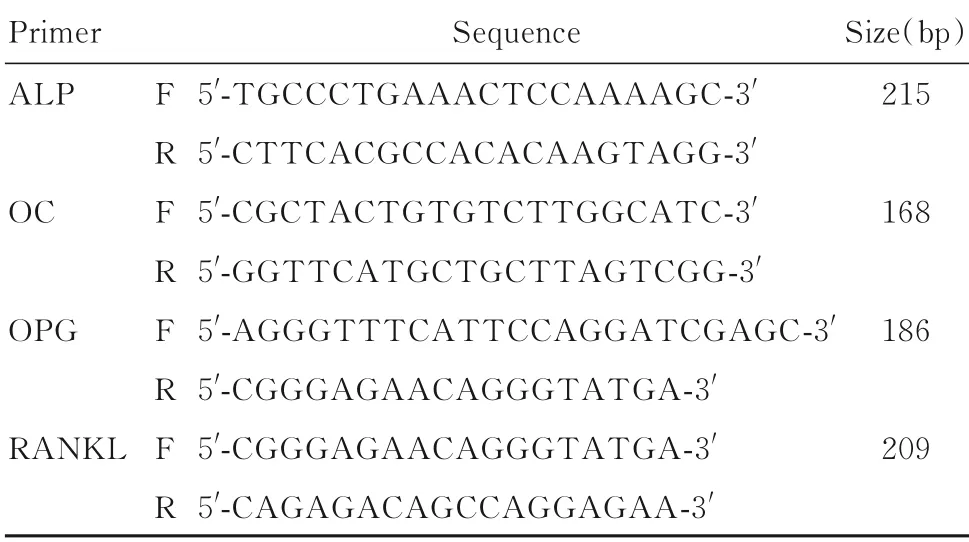
表1 ALP、OC、OPG和RANKL引物序列Tab.1Primer sequences of ALP,OC,OPG and RANKL
一侧胫骨磨碎后加入RIPA裂解液提取总蛋白,BCA法测定蛋白质浓度,上样进行聚丙烯酰胺凝胶电泳(SDS-PAGE),电泳后转到聚偏氟乙烯(PVDF)膜,5%脱脂奶粉封闭PVDF膜2 h后,加入一抗4℃孵育过夜,辣根过氧化物酶标记的二抗37℃孵育1 h,增强化学发光法(enhanced chamilium-inescence,ECL)显影,应用Gel Image System-1600凝胶成像系统采集图像并进行定量分析,计算目的蛋白表达水平,目的蛋白表达水平=目的蛋白条带灰度值/内参条带灰度值。
1.6 统计学分析采用SPSS 20.0统计软件进行统计学分析。各组大鼠血清中ALP、OC、OPG、PINP、TRACP和RANKL水平,各组大鼠股骨BMD、弹性模量、刚度、最大应力和最大承受力,各组大鼠骨组织中ALP、OC、OPG和RANKL mRNA及蛋白表达水平,均符合正态分布且方差齐,以±s表示,多组间样本均数比较采用单因素方差分析,组间样本均数两两比较采用SNK-q检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 各组大鼠血清中成骨和破骨相关指标水平
与对照组比较,模型组大鼠血清中ALP、OC、OPG、PINP、TRACP和RANKL水平均明显升高(P<0.01);与模型组比较,雌二醇组大鼠血清中ALP、OC、OPG、PINP、TRACP和RANKL水平明显降低(P<0.01),雌二醇联合1,25(OH)2D3组大鼠血清中ALP、PINP、TRACP和RANKL水平明显降低(P<0.01)且OPG/RANKL比值明显升高(P<0.01);与雌二醇组比较,雌二醇联合1,25(OH)2D3组大鼠血清中OC和OPG水平及OPG/RANKL比值明显升高(P<0.01),TRACP和RANKL水平明显降低(P<0.01)。见表2。
表2 各组大鼠血清中成骨和破骨相关指标水平Tab.2Levels of osteogenesis-and osteoclast-related indexes in serum of rats in various groups (n=6,±s)
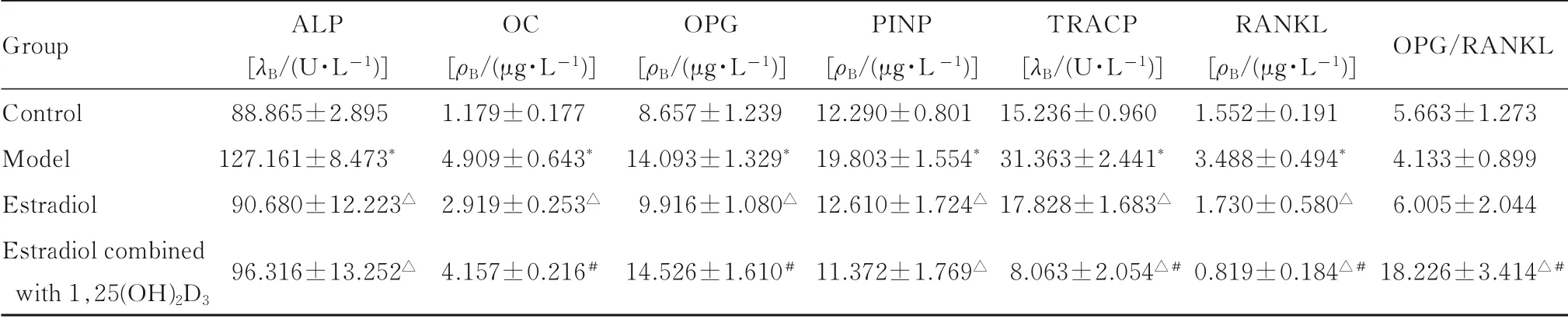
表2 各组大鼠血清中成骨和破骨相关指标水平Tab.2Levels of osteogenesis-and osteoclast-related indexes in serum of rats in various groups (n=6,±s)
*P<0.01 vs control group;△P<0.01 vs model group;#P<0.01 vs estradiol group.
Group Control Model Estradiol Estradiol combined with 1,25(OH)2D 3 ALP[λB/(U·L-1)]88.865±2.895 127.161±8.473*90.680±12.223△96.316±13.252△OC[ρB/(μg·L-1)]1.179±0.177 4.909±0.643*2.919±0.253△4.157±0.216#OPG[ρB/(μg·L-1)]8.657±1.239 14.093±1.329*9.916±1.080△14.526±1.610#PINP[ρB/(μg·L-1)]12.290±0.801 19.803±1.554*12.610±1.724△11.372±1.769△TRACP[λB/(U·L-1)]15.236±0.960 31.363±2.441*17.828±1.683△8.063±2.054△#RANKL[ρB/(μg·L-1)]1.552±0.191 3.488±0.494*1.730±0.580△0.819±0.184△#OPG/RANKL 5.663±1.273 4.133±0.899 6.005±2.044 18.226±3.414△#
2.2 各组大鼠骨组织形态表现HE染色光镜下观察:对照组大鼠股骨骨外膜以纤维和成纤维细胞为主,骨膜厚度均匀;模型组大鼠骨膜厚度明显增加,破骨细胞数量增多且骨外膜下可见少许点状虫蚀状缺损,呈现典型骨质疏松症特点;雌二醇组大鼠骨膜厚度较模型组明显变薄,成骨与破骨细胞数量接近正常,骨组织形态特点接近正常骨组织;雌二醇联合1,25(OH)2D3组大鼠骨外膜填充着活跃的成骨细胞,其厚度明显增加,骨膜下无虫蚀状缺损,与对照组比较骨组织无明显变化(图1)。TRACP染色光镜下观察:对照组大鼠只有极少量功能活跃破骨细胞;模型组大鼠骨外膜下破骨细胞数量增多并且功能活跃;雌二醇组大鼠后骨外膜下破骨细胞数量较模型组减少,无虫蚀状缺损;雌二醇联合1,25(OH)2D3组大鼠骨外膜破骨细胞数量进一步减少,成骨细胞数量增多。见图2。
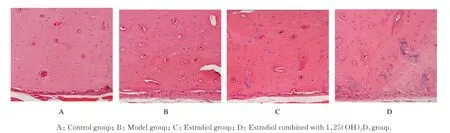
图1 HE染色观察各组大鼠骨组织形态表现(×200)Fig.1Morphology of bone tissue of rats in various groups observed by HE staining(×200)

图2 TRACP染色观察各组大鼠骨组织形态表现(×200)Fig.2Morphology of bone tissue of rats in various groups observed by TRACP staining(×200)
2.3 各组大鼠股骨BMD和生物力学指标与对照组比较,模型组大鼠股骨BMD、弹性模量、刚度、最大应力和最大承受力均明显降低(P<0.01);与模型组比较,雌二醇组和雌二醇联合1,25(OH)2D3组大鼠大鼠股骨上述指标明显升高(P<0.01);与雌二醇组比较,雌二醇联合1,25(OH)2D3组大鼠股骨BMD、弹性模量和最大应力明显升高(P<0.01)。见表3。
表3 各组大鼠股骨BMD和生物力学指标Tab.3Femoral BMD and biomechanical indexes of rats in various groups (n=5,±s)
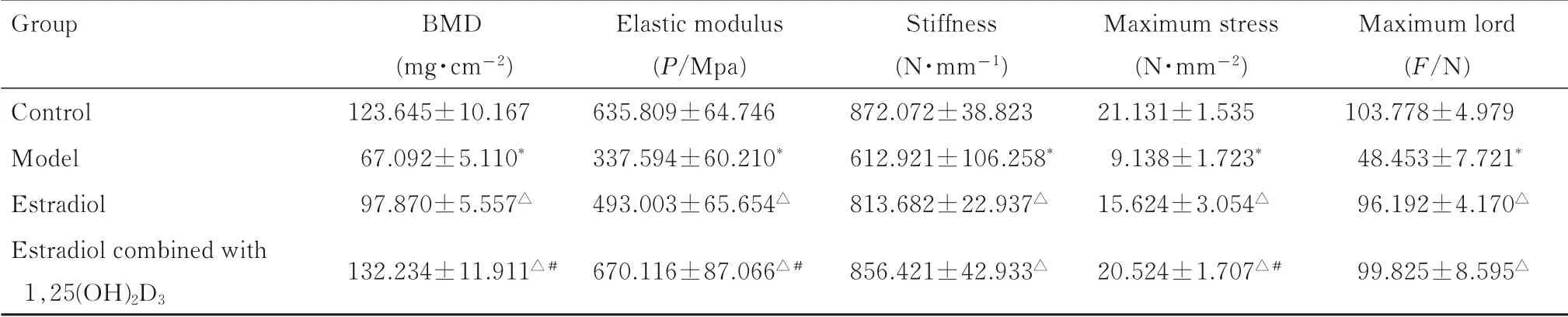
表3 各组大鼠股骨BMD和生物力学指标Tab.3Femoral BMD and biomechanical indexes of rats in various groups (n=5,±s)
*P<0.01 vs control group;△P<0.01 vs model group;#P<0.01 vs estradiol group.
Group Control Model Estradiol Estradiol combined with 1,25(OH)2D 3 BMD(mg·cm-2)123.645±10.167 67.092±5.110*97.870±5.557△132.234±11.911△#Elastic modulus(P/Mpa)635.809±64.746 337.594±60.210*493.003±65.654△670.116±87.066△#Stiffness(N·mm-1)872.072±38.823 612.921±106.258*813.682±22.937△856.421±42.933△Maximum stress(N·mm-2)21.131±1.535 9.138±1.723*15.624±3.054△20.524±1.707△#Maximum lord(F/N)103.778±4.979 48.453±7.721*96.192±4.170△99.825±8.595△
2.4 各组大鼠骨组织中成骨和破骨相关指标mRNA和蛋白表达水平与对照组比较,模型组大鼠骨组织中ALP、OC、OPG及RANKL mRNA和蛋白表达水平均明显升高(P<0.01);与模型组比较,雌二醇组大鼠骨组织中ALP、OC、OPG及RANKL mRNA和蛋白表达水平均明显降低(P<0.01),雌二醇联合1,25(OH)2D3组大鼠骨组织中ALP、OC和RANKL mRNA和蛋白表达水平均明显降低(P<0.01);与雌二醇组比较,雌二醇联合1,25(OH)2D3组大鼠骨组织中ALP及OC mRNA和蛋白表达水平无明显变化(P>0.05),OPG mRNA和蛋白表达水平明显升高(P<0.01),RANKL mRNA和蛋白表达水平明显降低(P<0.01)。见表4、图3和图4。
表4 各组大鼠骨组织中成骨和破骨相关指标mRNA表达水平T ab.4Expression levels of mRNA of osteogenesis-and osteoclast-related indexes in bone tissue of rats in various groups(n=3,±s)

表4 各组大鼠骨组织中成骨和破骨相关指标mRNA表达水平T ab.4Expression levels of mRNA of osteogenesis-and osteoclast-related indexes in bone tissue of rats in various groups(n=3,±s)
*P<0.01 vs control group;△P<0.01 vs model group;#P<0.01 vs estradiol group.
Group Control Model Estradiol Estradiol combined with 1,25(OH)2D 3 ALP 1 1.551±0.173*1.041±0.102△1.060±0.279△OC 1 2.806±0.647*1.543±0.371△1.622±0.615△OPG 1 3.148±0.061*1.340±0.307△3.479±0.618#RANKL 1 2.598±0.407*1.085±0.160△0.390±0.223△#

图3 各组大鼠骨组织中成骨和破骨相关指标蛋白表达电泳图Fig.3Electrophoregram of expressions of osteogenesisand osteoclast-related index proteins in bone tissue of rats in various groups
3 讨 论
骨组织在体内具有新陈代谢特点,表现为破骨细胞吸收旧骨、成骨细胞生成等量新骨取代以完成骨转换[10]。雌激素缺乏是引起PMOP的主要原因之一,雌激素能促进早期成骨细胞分化,刺激胶原蛋白并抑制破骨细胞活性[11]。绝经后女性雌激素严重不足,成骨细胞功能减弱而破骨细胞活性增加,BMD降低,增加骨转化率,影响钙盐沉积,使骨消融增加,大量骨质丢失,最终导致各类骨折的发生[12-13]。临床上常以激素替代(雌二醇)疗法治疗PMOP,但由于剂量依赖性常导致比较严重不良反应发生。因此,如何增强雌二醇调节PMOP中骨平衡功能,促进成骨细胞增殖和分化,并减少雌二醇用药剂量是亟需解决的问题。
维生素D是一种脂溶性维生素,也被看作是一种作用于钙、磷代谢的激素前体,通过体内转化转变成有活性的1,25(OH)2D3。在1,25(OH)2D3不足或缺乏的情况下,肠道钙吸收减少,导致血清钙细微减少,引起甲状旁腺激素(parathyroid hormone,PTH)分泌增加[14]。持续升高的PTH不仅能增强维生素骨化三醇的活性,而且还能促进骨吸收[15]。因此,在1,25(OH)2D3不足或缺乏的情况下,骨重塑平衡变成负值[16]。研究[17]表明:1,25(OH)2D3可诱导破骨细胞形成,并发挥骨吸收活性,但1,25(OH)2D3对PMOP中成骨细胞的作用尚未见详细报道,尤其是其与雌激素的联合作用。本研究结果显示:与雌二醇组比较,雌二醇联合1,25(OH)2D3治疗后可明显促进大鼠骨组织中成骨细胞增殖,增加骨膜厚度,增强骨形成过程,同时抑制破骨细胞数量从而减弱绝经后骨质疏松中的骨转换加速。在骨转换过程中,骨代谢生化指标发挥重要调节作用[18]。临床专家共识中常用骨形成指标包括ALP、OC、PINP和OPG等,骨吸收指标包括TRACP、RANKL、Ⅰ型胶原C端肽(CTX)和I型胶原N端肽(NTX)等[19-20]。本研究结果显示:与雌二醇组比较,雌二醇联合1,25(OH)2D3组大鼠血清中代表骨形成的OC和OPG水平明显升高,代表骨吸收的TRACP和RANKL水平明显降低,说明1,25(OH)2D3能够明显增强大鼠体内成骨细胞功能,增强成骨活性,明显促进骨形成的同时明显抑制骨吸收。临床上将BMD低于绝经前女性绝对值2.5个或以上标准差作为骨质疏松症的诊断标准[21]。本研究通过进一步生物力学分析显示:雌二醇和1,25(OH)2D3联合用药比单纯雌二醇治疗能更好地增加PMOP大鼠的BMD,并增强骨组织承受能力,从而缓解骨质疏松进展。

图4 各组大鼠骨组织中成骨和破骨相关指标蛋白表达水平Fig.4Expression levelsof osteogenesis-and osteoclast-related index proteinsin bonetissueof ratsin variousgroups
综上所述,PMOP发生后补充雌二醇可以减弱PMOP中骨转换加速,在一定程度上增强骨形成并抑制骨吸收从而平衡骨代谢,而雌二醇联合1,25(OH)2D3治疗后能更加明显促进成骨细胞的增殖和成骨活性,从而延缓PMOP的发生。临床中可以以低剂量雌二醇联合1,25(OH)2D3治疗PMOP,降低过量激素替代导致的不良反应发生率。
