腹部推拿疗法对慢性应激所致慢性疲劳综合征模型大鼠海马神经重塑及其海马-HPA轴的负反馈机制
2021-07-30潘明柱李华南
潘明柱,李 建,荣 兵,贾 峻,李华南
(天津中医药大学第一附属医院推拿科,天津300193)
慢性疲劳综合征(chronic fatigue syndrome,CFS)是不明原因所致的严重疲劳,具有持续发作或反复发作特征,伴有记忆力下降、头痛、睡眠障碍和免疫功能下降等症状[1]。CFS的发病机制尚未确定,但慢性应激反应是其病理基础[2]。在应激反应下,容易导致机体神经内分泌功能异常,出现激素分泌增多等现象。下丘脑-垂体-肾上腺皮质(hypothalamus-pituitary-adrenal,HPA)轴是神经内分泌系统中枢,研究[3]显示:HPA轴是外界环境应激反应的主要通道,并在应激反应中起重要作用。海马是HPA轴的高级调控中枢,研究[4]显示:海马-HPA轴负反馈失衡是CFS的致病基础。腹部推拿作为中医常用疾病治疗手法,被认为对海马神经具有重塑作用,但对其如何调控海马-HPA轴负反馈机制尚不明确。本文作者采用腹部推拿的方式干预CFS模型大鼠,探讨其对大鼠海马-HPA轴的影响,以了解该治疗方法对CFS大鼠海马神经重塑的作用机制。
1 材料与方法
1.1 实验动物、主要试剂和仪器成年健康Wistar雌性大鼠60只,体质量190~260 g,由北京华阜康生物科技股份有限公司提供,实验动物生产许可 证 号:SCXK(京)2014-004。TRIzol(美国Invitrogen公司),鼠单克隆抗FK506结合蛋白4(FK506 binding protein 4,FKBP4)和抗FK506结合 蛋 白51(FK506 binding protein 51,FKBP51)抗体(美国Bethyl公司),鼠单克隆抗糖皮质激素受体(glucocorticoid receptor,GR)抗体[圣克鲁斯生物技术(上海)有限公司],鼠单克隆抗N-甲基-D-天冬氨酸受体 (N-methyl-D-aspartate receptor,NMDAR)抗体(美国Abcam公司)、M-MLV逆转录酶和RNA酶抑制剂(日本TaKaRa公司),苏木素染液、伊红染液和PBS缓冲液(上海未尔晟生物技术有限公司),DBA试剂盒(北京中杉金桥公司),鼠促肾上腺皮质激素(adrenocorticotropic hormone,ACTH)酶联免疫吸附测定法(ELISA)试剂盒(上海西塘生物科技有限公司),鼠皮质醇(cortisol,CORT)和促肾上腺皮质激素释放激素(corticotropin releasing hormone,CRH)ELISA试剂盒(上海江莱生物科技有限公司),鼠糖皮质激素(glucocorticoid,GC)ELISA试剂盒(上海研生科技有限公司)。Super RX感光胶片(日本FUJIFILM公司),高速冷冻离心机(TGL 16M,广州沪瑞明仪器有限公司),DYCP-31BM型水平和垂直电泳装置(北京市六一仪器厂),Image-Pro-Plus图像分析软件(Media Cybernetics,美国元奥仪器有限公司),LabWorksTM凝胶成像及分析系统(美国UVP公司)。
1.2 实验动物分组和CFS大鼠模型制备大鼠饲养1周后随机分为正常组、模型组和实验组,每组20只。实验组和模型组大鼠制备CFS模型,正常组大鼠不进行任何处理。造模方法:上午悬吊,每悬吊3 d,加量1次,延长悬吊时间0.5 h;下午负重游泳,前3 d进行适应性游泳,每天30 min,以后采取力竭性训练,增加3%负重。以上训练持续12 d,通过鼠尾悬挂实验、力竭游泳实验和鼠尾悬挂实验确定动物模型出现与临床相似表现(包括躯体和心理慢性疲劳、体力改变、记忆力下降及绝望状态等)判断为建模成功[5]。
1.3 腹部推拿方法实验组大鼠给予腹部推拿治疗。采用YF-3手法测定仪评测推拿手法力度和频率,待其力度大小及频率波形与手法模型一致,开始对实验大鼠进行操作。①选取关元穴和中脘穴,用右手食指、中指按关元穴,余指并拢,食、中二指向耻骨联合脊柱方向按下,力量自轻至重,待大鼠腹部动脉轻微搏动,停止发力,该过程一般30 s完成,随后维持当前压力,1 min后指部徐徐上提,此过程大约持续30 s,反复以上操作2次。②食指、中指并拢,指面着于术部,以腕关节为中心,作环形摩动,每分钟20~28次,反复操作6 min。以上推拿治疗每天1次,持续治疗2周。
1.4 大鼠行为学效应指标检测①鼠尾悬挂实验:将距大鼠尾端1 cm部位穿过离地面1 m高的水平有机玻璃板中央孔,将其倒挂,大鼠挣扎活动时会出现间断性停止挣扎状态,记录5 min内停止挣扎时间即悬挂不动时间。②力竭游泳实验:游泳池水温(25±1)℃、水深50 cm,力竭时间是大鼠从入水游泳至头部沉入水中10 s不能浮出水面的时间。③旷场实验:将大鼠放入长宽高均为80 cm的木质旷场箱,内壁涂黑,将大鼠放置于箱底中心位置,观察5 min内大鼠行为,计算水平运动速度。
1.5 电镜观察大鼠海马神经元超微形态表现实验结束后,从3组大鼠中各抽取3只,取脑组织,分离海马,并包埋切片,使用OPTONEM 10C透射电镜观察大鼠海马神经元超微形态表现。
1.6 免疫组织化学法检测大鼠海马组织中FKBPs、GR和NMDAR阳性表达率取大鼠海马脑段切片,常规脱蜡、水化,采用免疫组织化学技术分析并计算FKBPs(包括FKBP4和FKBP51)、GR和NMDAR阳性表达率。阳性表达标准:光镜下,每100个细胞中阳性细胞数≥30个即为阳性表达,阳性细胞数超过60个表示强阳性,采用系统软件观察阳性细胞平均表达强度并计算阳性表达率[6]。
1.7 ELISA法检测大鼠血清中ACTH、CORT、CRH和GC水平取大鼠腹腔静脉血5 mL,于4℃条件静止0.5 h后,3 000 r·min-1、离 心 半 径2 cm条件下离心处理10 min,分离血清,于-70℃冰箱保存备用;采用ELISA试剂盒检测大鼠血清中ACTH、CORT、CRH和GC水平,严格按照试剂盒说明书进行操作。
1.8 统计学分析采用SPSS 22.0统计软件进行统计学分析。大鼠悬挂不动时间、力竭游泳时间和水平运动时间,血清中ACTH、CORT、CRH和GC水平,以±s表示,多组间样本均数比较采用单因素方差分析,组间样本均数两两比较采用SNK-q检验;大鼠海马组织中FKBPs、GR和NMDAR阳性表达率以百分率(%)表示,组间比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 各组大鼠行为学效应指标模型组和干预前实验组大鼠行为学效应指标比较差异无统计学意义(P>0.05)。与正常组比较,模型组和干预前实验组大鼠悬挂不动时间明显延长(P<0.05),力竭游泳时间明显缩短(P<0.05),水平运动速度明显降低(P<0.05)。与模型组比较,干预后实验组大鼠悬挂不动时间明显缩短(P<0.05),力竭游泳时间明显延长(P<0.05),水平运动速度明显增加(P<0.05)。见表1。
表1 各组大鼠行为学效应指标Tab.1Behavioral effect indicators of rats in various groups (n=20,±s)
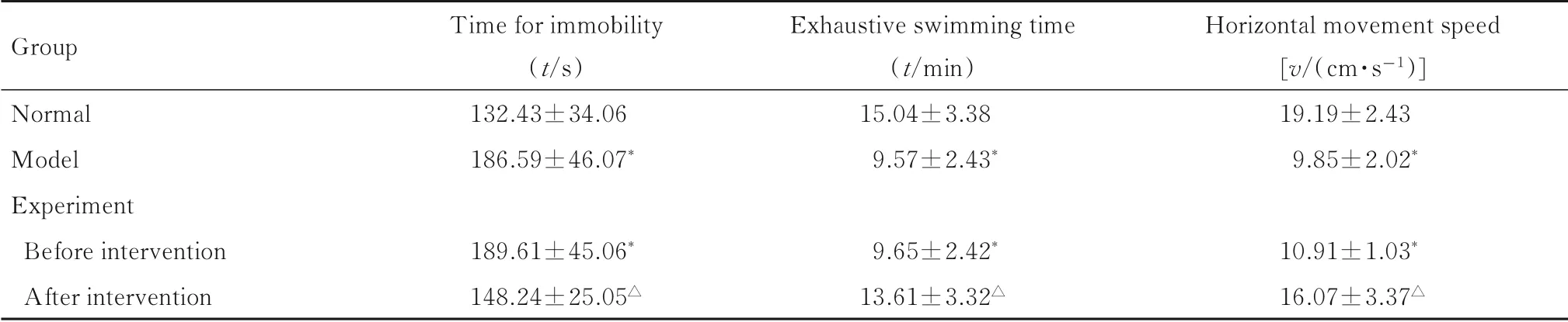
表1 各组大鼠行为学效应指标Tab.1Behavioral effect indicators of rats in various groups (n=20,±s)
*P<0.05 vs normal group;△P<0.05 vs model group.
Group Normal Model Experiment Before intervention After intervention T ime for immobility(t/s)132.43±34.06 186.59±46.07*189.61±45.06*148.24±25.05△Exhaustive swimming time(t/min)15.04±3.38 9.57±2.43*9.65±2.42*13.61±3.32△Horizontal movement speed[v/(cm·s-1)]19.19±2.43 9.85±2.02*10.91±1.03*16.07±3.37△
表1 各组大鼠行为学效应指标Tab.1Behavioral effect indicators of rats in various groups (n=20,±s)

表1 各组大鼠行为学效应指标Tab.1Behavioral effect indicators of rats in various groups (n=20,±s)
*P<0.05 vs normal group;△P<0.05 vs model group.
Group Normal Model Experiment Before intervention After intervention T ime for immobility(t/s)132.43±34.06 186.59±46.07*189.61±45.06*148.24±25.05△Exhaustive swimming time(t/min)15.04±3.38 9.57±2.43*9.65±2.42*13.61±3.32△Horizontal movement speed[v/(cm·s-1)]19.19±2.43 9.85±2.02*10.91±1.03*16.07±3.37△
2.2 各组大鼠海马神经元超微形态表现透射电镜下观察,正常组大鼠海马神经元形态、大小正常,细胞核、线粒体和内质网的结构形态正常,染色质分布均匀,细胞膜完整。模型组大鼠海马神经元胞体缩小,细胞胞膜出现皱褶,细胞核不规则,核异染色质增多,部分核膜破裂,核周间隙变大;部分神经元细胞膜内陷,细胞质出现空亮区,内质网扩张,有凋亡小体形成。实验组大鼠海马神经元胞体相对正常,可见到异染色质聚集,核周间隙轻度增大,内质网轻度扩张,少数线粒体轻度扩张。见图1。

图1 各组大鼠海马神经元超微形态表现(TEM,×1 000)Fig.1Ultramicromorphology of hippocampal neurons of rats in various groups(TEM,×1 000)
2.3 各组大鼠海马组织中FKBPs、GR和NMDAR阳性表达率与正常组比较,模型组大鼠海马组织中FKBP4、FKBP51、GR和NMDAR阳性表达率明显降低(P<0.05);与模型组比较,实验组大鼠海马组织中FKBP4、FKBP51、GR和NMDAR阳性表达率明显升高(P<0.05)。见表2和图2。

表2 各组大鼠海马组织中FKBPs、GR和NMDAR阳性表达率Tab.2Positive expression rates of FKBPs,GR and NMDAR in hippocampus tissue of rats in various groups[n=20,n(η/%)]
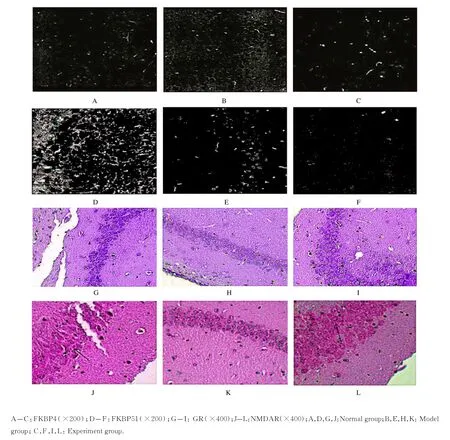
图2 各组大鼠海马组织中FKBPs、GR和NMDAR免疫组织化学染色情况Fig.2Positive expression rates of FKBPs,GR and NMDAR in hippocampus tissue of rats in various groups
2.4各组大鼠血清中ACTH、CORT、CRH和GC水平与正常组比较,模型组大鼠血清中ACTH、CORT、CRH和GC水平明显升高(P<0.05);与模型组比较,实验组大鼠血清中ACTH、CORT、CRH和GC水平明显降低(P<0.05)。见表3。
表3 各组大鼠血清中ACTH、CORT、CRH和GC水平Tab.3Levels of serum ACTH,CORT,CRH and GC of rats in various groups [n=20,±s,ρB/(μg∙L-1)]

表3 各组大鼠血清中ACTH、CORT、CRH和GC水平Tab.3Levels of serum ACTH,CORT,CRH and GC of rats in various groups [n=20,±s,ρB/(μg∙L-1)]
*P<0.05 vs normal group;ΔP<0.05 vs model group.
Group Normal Model Experiment F P ACTH 31.39±4.35 56.90±5.65*36.88±3.78△166.070<0.01 CORT 270.64±36.26 401.99±60.46*312.04±45.34△38.510<0.01 CRH 10.68±2.32 21.19±3.51*4.23±1.08△233.030<0.01 GC 38.26±4.57 53.15±3.74*43.28±4.65△60.950<0.01
3 讨 论
CFS归属中医“虚劳”范畴,脾胃升降失调是其主要发病原因,脾胃受损在先,继而导致其运化升降失司,经络和气机阻滞,最终使气血运行受阻所致[7-8]。腹部是人体气机升降枢纽,中医认为,腹部推拿能够调节脾胃升降功能,增强脾胃运化,促进气血畅行[9-10]。有研究[11-12]显示:腹部推拿可以影响海马神经重塑,但对其如何调控海马-HPA轴负反馈机制尚不明确。
本研究模拟人体生理和精神应激状态,复制应激反应下的CFS大鼠模型,采用行为学效应指标验证模型,结果显示:与对照组比较,模型组和干预前实验组大鼠悬挂不动时间明显延长,力竭游泳时间明显缩短,水平运动速度明显降低,说明大鼠体力下降,自发活动减少,出现心理和躯体疲劳状态;经腹部推拿干预后,实验组大鼠悬挂不动时间明显缩短,力竭游泳时间明显延长,水平运动速度明显增加,说明腹部推拿能改善CFS大鼠的体力及心理状态,增强对新环境的学习及适应能力。海马具有调控单胺类神经递质释放功能,研究[13-14]表明:慢性应激状态下海马体积缩小,海马神经元出现萎缩现象,进而影响对HPA轴的调控。本研究通过电镜观察各组大鼠海马神经元超微形态结构,结果显示:模型组大鼠海马神经元胞体缩小,部分神经元胞膜内陷,有凋亡小体形成,而实验组大鼠海马神经元胞体相对正常,形态结构接近正常组,有轻度异染色质聚集、内质网扩张现象,说明腹部推拿对海马萎缩及其损伤的神经元起到修复作用。HPA轴过度的应激反应会使HPA轴亢进,海马是调节HPA轴功能的高级中枢[15]。研究[16]表明:GC在脑的老化过程起重要作用,海马结构功能对GC的水平变化很敏感,高水平GC会对海马结构产生损害,对学习和记忆造成影响,降低GC水平可以修复空间记忆障碍。海马中富含的一种肾上腺激素受体GR参与HPA轴调解,能够抑制应激条件所致的HPA轴过度反应[17],而NMDAR介导的突触传递与GR对HPA轴的调节作用有紧密联系[18]。NMDAR受体通道活性增强会增强各种应激反应所致的GR水平降低程度[19-20]。GR敏感性受FKBPs蛋白分子调控,FKBPs能降低GR与配体的结合力,减少其核转移。本研究结果显示:与正常组比较,模型组大鼠海马组织中FKBPs、GR和NMDAR阳性表达率明显降低,血清中GC水平明显升高,而干预后实验组CFS大鼠海马组织中FKBPs、GR、NMDAR阳性表达率明显升高且血清中GC水平明显降低,表明提高海马神经中GR和NMDAR的表达水平,可借助FKBPs-GRNMDAR通路抑制应激反应所致的HPA轴过度反应。当机体受到应激刺激时,会将刺激信息汇聚于下丘脑CRH神经元,提高HPA轴的兴奋性,进而引起垂体-肾上腺皮质系统反应[21-22]。本研究结果显示:模型组大鼠血清中ACTH、CORT和CRH较正常组明显升高,说明CFS模型大鼠处于HPA轴亢进状态;经腹部推拿干预后,实验组大鼠血清中ACTH、CORT和CRH水平与模型组比较明显下降,并趋于正常水平,提示腹部推拿对HPA轴亢奋有一定调节作用,进而改善HPA轴功能,促进病情恢复。
综上所述,腹部推拿疗法可以促进应激反应所致的CFS大鼠损伤性海马神经重塑,降低ACTH、CORT和CRH激素水平,通过FKBPs-GR-NMDAR通路维持海马-HPA轴负反馈平衡,进而达到治疗CFS的目的。
