血管紧张素(1-7)对小鼠肢体缺血再灌注所致肾损伤的改善作用及其机制
2021-07-30朱丽艳王耀明赵欢欢王增颖杨秀红
朱丽艳,王耀明,秦 政,赵欢欢,王增颖,杨秀红
(1.华北理工大学基础医学院机能实验室,河北 唐山063000;2.河北省唐山市慢性疾病重点实验室,河北 唐山063000)
肢体缺血再灌注(limb ischemia-reperfusion,LIR)是骨科手术和血管创伤等临床中极为常见的病理生理过程,其发生后可导致多脏器功能障碍,较为严重的LIR可以诱发急性肾功能障碍[1],但具体作用机制尚未完全明确。本课题组前期研究[2]显示:LIR后存在肾素-血管紧张素系统(reninangiotensin system,RAS)过度激活,并且肾组织局部RAS稳态失衡参与了远隔组织器官损伤的发生发展。已有研究[3-5]表明:在慢性肾脏疾病、梗阻性肾病和糖尿病肾病等疾病中血管紧张素Ⅱ(angiotensinⅡ,AngⅡ)参与了肾脏纤维化及肾损伤的炎症反应,血管紧张素(1-7)[angiotensin-(1-7),Ang-(1-7)]能够通过激活Mas受体抑制Toll样受体4(Toll-like receptor 4,TLR4)信号通路和核因子κB(nuclear factor kappa B,NF-κB)信号通路以及减弱Janus酪氨酸蛋白激酶2(Janus kinase-2,JAK 2)/信号转导和转录激活因子3(signal transducer and activator of transcription 3,STAT 3)炎症介导途径拮抗AngⅡ介导的炎症反应,而Ang-(1-7)在C57BL/6小鼠LIR后肾损伤中炎症反应中的作用尚不明确。本研究通过观察外源性Ang-(1-7)干预LIR小鼠对肾损伤和肾组织中肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)及NF-κB表达的影响,进一步探讨Ang-(1-7)在LIR致肾损伤中的作用及其可能的炎症机制。
1 材料与方法
1.1 实验动物、主要试剂和仪器清洁级C57BL/6小鼠30只,10周龄,雄性,体质量25~30 g,动物生产许可证号:SCXK(京)2014-0004,由中国医学科学院实验动物研究所提供,在华北理工大学实验动物中心SPF级动物房饲养,自由进食和饮水。动物实验获得华北理工大学伦理委员会批准。Ang-(1-7)(南京肽业生物科技有限公司),Ang-(1-7)酶联免疫吸附测定法(enzyme linked immunosorbent assay,ELISA)试剂盒(武汉华美生物工程有限公司),兔抗NF-κB p65抗体(上海创亚化工有限公司),兔抗Mas受体抗体(北京傲锐东源生物科技有限公司),兔抗β-actin抗体(美国ABclonal公司),免疫组织化学染色试剂(北京中杉金桥公司),血清肌酐(serum creatinine,Scr)和 尿 素 氮(blood urea nitrogen,BUN)检测试剂盒(中生北控生物科技股份有限公司),ECL发光剂、山羊抗兔辣根过氧化物酶标记二抗、BCA蛋白浓度检测试剂、RIPA组织蛋白裂解液和彩色预染蛋白分子量标准(碧云天生物技术研究所)。iMark酶标仪(美国Bio-Rad公司),微量渗透泵1002型(美国Alza公司),全自动生化分析仪(深圳雷杜生命科学股份有限公司)。
1.2 LIR模型制备小鼠随机分为对照组、LIR组和LIR+Ang-(1-7)组,每组10只。LIR组和LIR+Ang-(1-7)组小鼠于制备模型前行渗透泵皮下置入术:严格按照产品说明书埋置生理盐水和Ang-(1-7)的 微 量 渗 透 泵(24μg·kg-1·h-1)持 续14 d,所有操作均严格按照外科无菌术原则,术后将动物置于37℃恒温热垫上直至苏醒。LIR组和LIR+Ang-(1-7)组小鼠建立LIR模型:小鼠腹腔注射3%水合氯醛(3 mg·kg-1)麻醉,双后肢根部行橡皮套结扎术,缺血2 h后用手术剪剪断橡皮圈,双手按摩双侧后肢血流进行血流灌注4 h。麻醉状态下摘眼球处死小鼠,收集血浆和双侧肾组织,肾组织分别于甲醛固定液和-80℃条件下保存备用。
1.3 小鼠肾功能指标检测各组小鼠血清离心并取上清,全自动生化分析仪检测小鼠血清中Scr和BUN水平。
1.4 HE染色观察小鼠肾组织病理形态表现将一侧小鼠肾组织浸泡于10%甲醛中,常规病理组织切片制备,HE染色,光镜下观察肾组织组织病理形态表现。根据肾小管间质半定量评分法对肾炎症细胞浸润、肾间质水肿和肾小管损伤分别进行半定量分析的标准评分[6],即肾组织病理损伤评分:肾小管上皮细胞扁平化的存在(1分),小管刷状缘消失(1分),细胞膜泡出现(1分或2分),间质水肿(1分),胞浆空泡化(1分),细胞坏死(1分或2分),管腔梗阻出现管型或碎片(1或2分),正常肾小管为0分。每张组织切片镜下选10个区域的100个完整的肾小管进行评分,最高为10分取平均值。
1.5 ELISA法检测小鼠肾组织和血清中Ang-(1-7)水平剪取适量肾组织,称质量;放置在预冷PBS缓冲液中清洗,去除组织中血液;按组织与PBS缓冲液的质量体积比为1∶10加入PBS缓冲液;剪碎,超声匀浆,置于-20℃过夜,反复冻融2次,将组织匀浆4℃、5 000 r·min-1离心5 min,取上清;取全血标本4℃过夜放置,4℃、1 000 r·min-1离心15 min,取上清;按照ELISA试剂盒说明书操作,酶标仪测定450 nm波长处吸光度(A)值,绘制标准曲线,通过A值和浓度曲线计算小鼠肾组织和血清中Ang-(1-7)水平。
1.6 免疫组织化学染色法检测小鼠肾组织中NF-κB、TNF-α和Mas受体蛋白表达分布情况和表达水平应用免疫组织化学链霉菌抗生物素蛋白-过氧化物酶连结法(SP法),按免疫组织化学试剂说明书步骤进行,NF-κB一抗稀释浓度为1∶200,TNF-α一抗稀释浓度为1∶100,Mas受体一抗稀释浓度为1∶100,封片后镜下分别观察NF-κB、TNF-α和Mas受体蛋白表达分布情况,采用专业图像分析软件Image ProPlus 6.0选取图片上具有染料色调的区域,检测该区域累计光密度(integrated option density,IOD)值,选择并测量有效统计区域的面积,同时计算IOD平均值(IOD/area),代表目的蛋白表达水平。
1.7 Western blotting法检测小鼠肾组织中NF-κB、TNF-α和Mas受体蛋白表达水平称取适量肾组织研磨,加入预冷的蛋白裂解液,采用冰上超声匀浆,4℃、12 000 r·min-1离心15 min,取上清。BCA法测定上清液中的蛋白浓度,将蛋白浓度用RIPA调整为5 g·L-1,按4∶1比例与5×上样缓冲液混匀,煮沸10 min;10%SDS-PAGE电泳,90 V转移至硝酸纤维膜,5%脱脂奶粉封闭1 h,一抗(NF-κB抗体1∶1 500,TNF-α抗体1∶1 000,Mas受体抗体1∶1 000,β-actin抗体1∶10 000)4℃冰箱孵育过夜,次日TBST洗膜4次,每次10 min,辣根过氧化物酶标记的二抗37℃孵育1 h,TBST洗膜4次,每次10 min。ECL发光剂显影、成像,以β-actin作为内参,利用Image J软件分析处理条带灰度值,计算目的蛋白相对表达水平,以目的蛋白条带灰度值与内参条带灰度值比值表示目的蛋白相对表达水平。
1.8 统计学分析采用SPSS 19.0统计软件进行统计学分析。各组小鼠血清中SCr和BUN水平,肾组织病理损伤评分,肾组织中Ang-(1-7)水平及NF-κB、TNF-α和Mas受体蛋白表达水平,均以±s表示,多组间样本均数比较采用单因素方差分析,组间样本均数两两比较采用LSD-t法。以P<0.05为差异有统计学意义。
2 结 果
2.1 各组小鼠肾功能指标与对照组比较,LIR组小鼠血清中SCr和BUN水平明显升高(P<0.05);与LIR组比较,LIR+Ang-(1-7)组小鼠血清中SCr和BUN水平明显降低(P<0.05)。见表1。
表1 各组小鼠肾功能指标和肾组织病理损伤评分Tab.1Indexes of kidney function and pathological injury scores of kindey tissue of mice in various groupsn=10,±s)

表1 各组小鼠肾功能指标和肾组织病理损伤评分Tab.1Indexes of kidney function and pathological injury scores of kindey tissue of mice in various groupsn=10,±s)
*P<0.05 vs control group;△P<0.05 vs LIR group.
Group Control LIR LIR+Ang-(1-7)Scr[c B/(μmol·L-1)]19.92±1.96 30.35±5.09*24.94±2.72△BUN[c B/(mmol·L-1)]7.95±2.06 13.36±2.45*9.91±1.69△Pathological injury score 14.67±3.54 55.20±9.13*36.80±4.02△
2.2 各组小鼠肾组织病理形态表现和肾组织病理损伤评分光镜下观察,对照组小鼠肾组织中肾小球和肾小管结构正常,未见炎症细胞浸润;与对照组比较,LIR组小鼠肾组织损伤严重,可见肾小球毛细血管扩张充血,肾小管管腔明显扩张,出现肾小管上皮细胞水肿和脱落,部分肾小管上皮细胞空泡变性、坏死,肾间质存在炎性细胞浸润,部分扩张的管腔见大量上皮细胞碎片和红细胞管型,肾组织病理损伤评分明显升高(P<0.05);与LIR组比较,LIR+Ang-(1-7)组小鼠肾小球毛细血管扩张充血减轻,偶见肾小管管腔扩张、肾间质炎性细胞浸润和肾小管上皮细胞碎片等损伤表现,肾组织病理损伤评分明显降低(P<0.05)。见图1和表1。
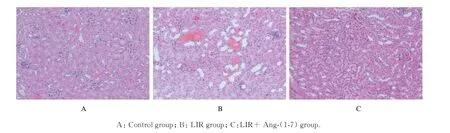
图1 各组小鼠肾组织病理形态表现(HE,×200)Fig.1Pathomorphology of kidney tissue of mice in various groups(HE,×200)
2.3 各组小鼠肾组织和血清中Ang-(1-7)水平与对照组比较,LIR组小鼠肾组织和血清中Ang-(1-7)水平明显降低(P<0.05);与LIR组比较,LIR+Ang-(1-7)组小鼠肾组织和血清中Ang-(1-7)水平明显升高(P<0.05)。见表2。
表2 各组小鼠肾组织和血清中Ang-(1-7)水平Tab.2Levels of Ang-(1-7)in kidney tissue and serum of mice in various groupsn=10,±s)

表2 各组小鼠肾组织和血清中Ang-(1-7)水平Tab.2Levels of Ang-(1-7)in kidney tissue and serum of mice in various groupsn=10,±s)
*P<0.05 vs control group;△P<0.05 vs LIR group.
Group Control LIR LIR+Ang-(1-7)Ang-(1-7)Kindey tissue[w B/(ng·g-1)]14.05±1.44 11.99±1.29*16.53±3.15△Serum[c B/(mmol·L-1)]1.76±0.13 1.39±0.29*2.10±0.29△
2.4免疫组织化学染色法检测各组小鼠肾组织中NF-κB、TNF-α和Mas受体蛋白表达分布和表达水平NF-κB、TNF-α及Mas受体蛋白均主要表达于肾小管上皮细胞,肾小球中有少量表达。与对照组比较,LIR组小鼠肾组织中NF-κB、TNF-α和Mas受体蛋白表达水平明显升高(P<0.05);与LIR组比较,Ang-(1-7)组小鼠肾组织中NF-κB和TNF-α蛋白表达水平明显降低(P<0.05),Mas受体蛋白表达水平明显升高(P<0.05)。见图2和表3。
表3 各组小鼠肾组织中TNF-α、NF-κB和Mas受体蛋白表达水平Tab.3Expression levelsof TNF-α,NF-κB,and Masreceptor proteins in kidney tissue of mice in various groups(n=10,±s)

表3 各组小鼠肾组织中TNF-α、NF-κB和Mas受体蛋白表达水平Tab.3Expression levelsof TNF-α,NF-κB,and Masreceptor proteins in kidney tissue of mice in various groups(n=10,±s)
*P<0.05 vs control group;△P<0.05 vs LIR group.
Group Control LIR LIR+Ang-(1-7)TNF-α 0.08±0.02 0.21±0.03*0.13±0.02△NF-κB 0.10±0.01 0.22±0.02*0.19±0.02△Mas receptor 0.16±0.01 0.21±0.01*0.28±0.01△

图2 各组小鼠肾组织中TNFα、NF-κB和Mas受体蛋白表达情况(免疫组织化学,×200)Fig.2Expressions of TNF-α,NF-κB,and Mas receptor proteins in kidney tissue of mice in various groups(Immunohistochemistry,×200)
2.5 Westernblotting法检测各组小鼠肾组织中NF-κB、TNF-α和Mas受体蛋白表达水平与对照组比较,LIR组小鼠肾组织中NF-κB、TNF-α和Mas受体蛋白表达水平明显升高(P<0.05);与LIR组比较,LIR+Ang-(1-7)组小鼠肾组织中NF-κB和TNF-α蛋白表达水平明显降低(P<0.05),Mas受体蛋白表达水平明显升高(P<0.05)。见图3。
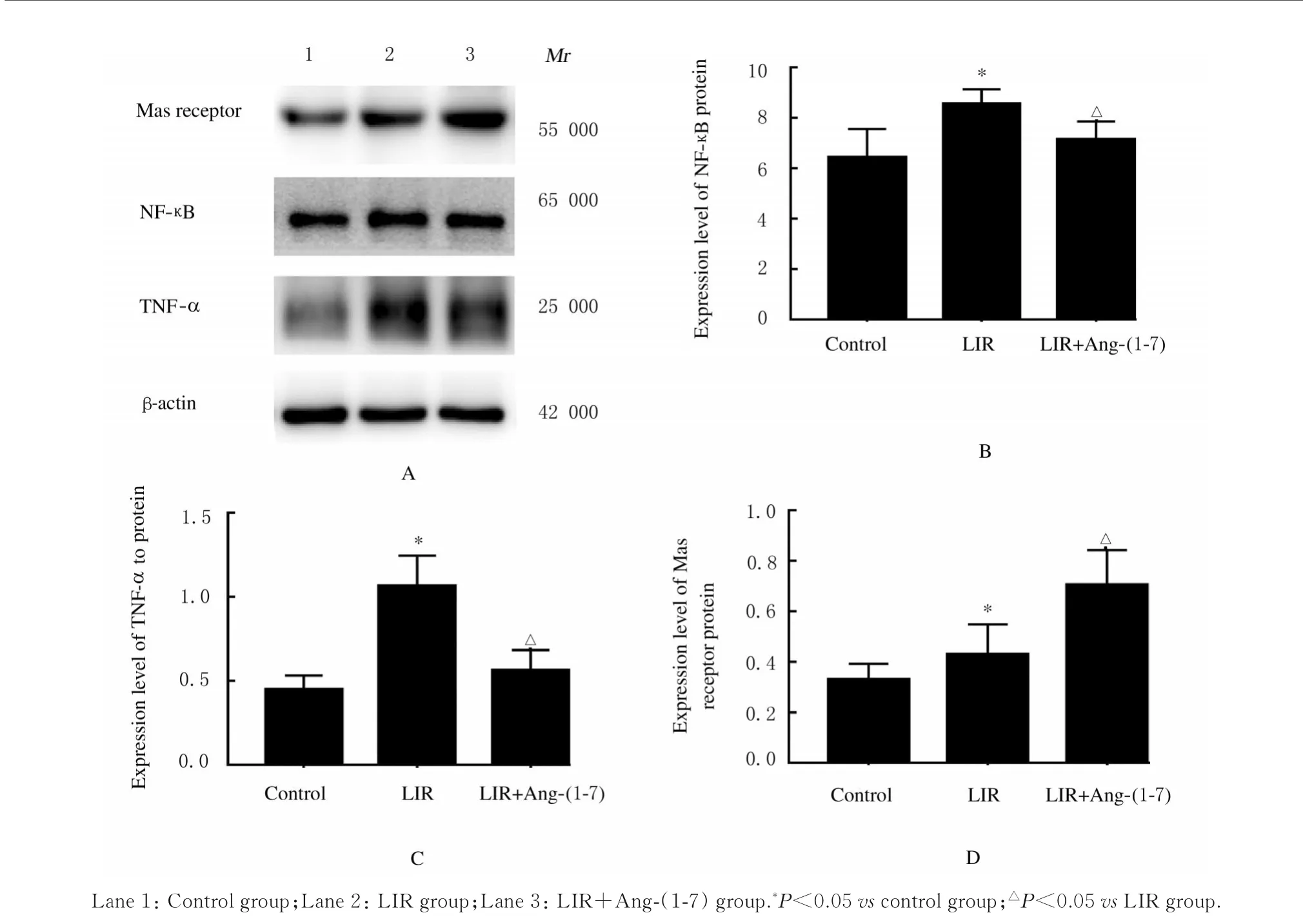
图3 各组小鼠肾组织中NF-κB、TNF-α和Mas受体蛋白表达电泳图(A)和直条图(B-D)Fig.3 Electrophoregram(A)and histogram(B-D)of expressions of NF-κB,TNF-αand Mas receptor proteins in kidney tissue of mice in various groups
3 讨 论
急性肾损伤是缺血再灌注损伤最为严重并发症之一,其发病率和死亡率逐年升高,但其确切机制尚不清楚。大量研究[7-9]已经证实:在RAS作用相反的2条轴中,血管紧张素转化酶(angiotensin converting enzyme,ACE)-AngⅡ-血管紧 张 素Ⅱ1型受体(angotensinⅡtype 1 receptor,AT 1)是引起肾损伤的重要因素,而血管紧张素转换酶2(angiotensin converting enzyme 2,ACE2)-Ang-(1-7)-Mas轴在参与调节肾组织的氧化应激、炎症和纤维化等多种病理生理学过程中起拮抗作用。
TNF-α是参与炎症反应的重要细胞因子,NF-κB是炎症的关键调节因子,可上调炎症基因产物,在炎症中扮演重要的角色,炎症因子的表达水平能够反映LIR时组织损伤的严重程度。研究[10-12]显示:缺血再灌注损伤的病理过程中,AngⅡ可通过AT 1受体诱导休克动物TNF-α和NF-κB的激活而启动炎症反应,导致水钠潴留及肾小管上皮增生等,最终诱导细胞的凋亡,加重缺血再灌注损伤,而针对RAS靶向轴的阻断多能够抑制肾组织损伤的病变程度。有研究[13]表明:Ang-(1-7)可明显降低Alport综合征小鼠TNF-α和单核细胞趋化蛋白1(monocyte chemoattractant protein-1,MCP-1)等炎症因子和黏附分子水平,并上调ACE2的表达,从而延缓Alport综合征小鼠肾病的进展。研究[14]显示:应用Ang-(1-7)治疗后,通过降低TNF-α和IL-6的表达水平可使ACE2敲除肥胖小鼠炎症表现明显改善。研究[15-16]显示:长期慢性输注Ang-(1-7)能够降低急性缺血再灌注导致的NF-κB活性增强和IL-1和IL-6的表达,Ang-(1-7)能够减轻瘦素缺乏db/db小鼠的肾脏质量、肾小球系膜扩张和尿白蛋白排泄,表明Ang-(1-7)在炎症反应过程中具有一定的炎症抑制作用。Ang-(1-7)可以刺激内皮型一氧化氮合酶磷酸化,抑制磷酸肌醇激酶途径,从而增加一氧化氮(NO)和前列环素释放,减少TNF-α等炎症因子的释放[17]。研究[18-20]显示:长期输注Ang-(1-7)能够降低AngⅡ水平,发挥AT 1的生理拮抗作用。Ang-(1-7)可以通过抑制Mas受体降低AngⅡ所致的人肾小球内皮细胞凋亡、减少活性氧(reactive oxygen species,ROS)生成和TNF-α等炎症因子表达,从而发挥肾脏保护作用。NIE等[21]研究显示:Ang-(1-7)能够通过作用Mas受体增加抗炎因子的产生,抑制Th1细胞分化,减少促炎因子的产生。JIANG等[22]也已证实:Mas受体的激活明显抑制了磷酸化核因子κB抑制蛋白α(NF-kappa-B inhibitor alpha,IKBα)和NF-κB p65的增加。长期输注AngⅡ,ACE2和Mas双重缺失小鼠NF-κB炎症信号可明显激活,促进炎症及纤维化等肾脏损伤[23]。推测Mas受体在LIR造成的肾损伤炎症作用中可能起到保护作用。本课题组前期研究[24]显示:LIR后急性肾损伤与局部组织RAS失衡有密切关联,但Ang-(1-7)是否可通过降低LIR后炎症因子而减轻肾脏损伤尚未见报道。
本研究结果显示:LIR组小鼠肾组织中NF-κB、TNF-α和Mas受体蛋白表达水平明显升高,血清中Scr和BUN水平明显升高,肾组织中肾小球和肾小管等出现相应的病理变化,同时LIR组小鼠肾脏组织及血清中Ang-(1-7)水平降低,说明LIR组小鼠在LIR后肾脏出现严重损伤,但LIR+Ang-(1-7)组 小 鼠 肾 脏 炎 症 因 子(NF-κB、TNF-α)水平和血清中Scr及BUN水平明显降低,肾组织中Mas受体蛋白表达水平明显升高,推测在ACE2-Ang-(1-7)-Mas保护性通路中,Ang-(1-7)可能通过增加Mas受体表达水平,间接拮抗AngⅡ水平,并增加抗炎因子和减少促炎因子的产生,从而对LIR诱导的肾脏损伤具有保护作用。
综上所述,Ang-(1-7)在C57BL/6小鼠LIR造成的肾损伤的炎症反应中可能具有降低NF-κB和TNF-α水平从而减轻肾脏损伤的作用,但其具体抑制炎症反应的通路仍需进一步研究。本研究结果为解决LIR肾损伤抗炎药物的研究提供了新的思路。
