天冬酰胺合成酶对移植黑色素瘤APP/PS1小鼠骨骼肌减少的影响
2021-07-30郭家女王力可陈昌捷孙连坤于春艳
董 营,吕 航,郭家女,郑 鸿,郭 丹,王力可,王 丹,陈昌捷,孙连坤,张 勇,于春艳
(1.北华大学基础医学院病理教研室,吉林 吉林132013;2.北华大学附属医院检验科,吉林 吉林132013;3.吉林大学基础医学院病理生理学系,吉林 长春130021)
随着慢性和增龄疾病的进展,患者常表现为骨骼肌质量、力量和运动功能的进行性下降,最终发展为肌肉减少症,伴随肌肉功能丧失,往往是行动不便,生活质量的降低,以及各种疾病的死亡率增加。肌肉减少症是阿尔茨海默病和恶性肿瘤等慢性疾病的主要并发症之一[1-2],而且随着肿瘤的不断增殖,肌肉质量和肌力的变化可能早于典型恶病质症状的出现,肌肉减少症被认为是影响晚期肿瘤患者生存期的独立预后指标之一。研究[3-4]提示:阿尔茨海默病与恶性肿瘤发病风险的降低有关,研究肌肉减少症是否发生对于理解二者之间的关系可能具有重要意义,可为疾病的预后评价和防治提供理论依据。
阿尔茨海默病和肿瘤细胞在发生发展过程中不可避免地遭受应激。细胞针对饥饿等应激进化出氨基酸反应等多种适应性机制[5]。天冬酰胺合成酶(asparaginesynthetase,ASNS)是氨基酸反应之一,以ATP依赖的氨基转移酶反应方式催化天冬氨酸与谷氨酰胺合成天冬酰胺和谷氨酸[6],被未折叠蛋白反应所激活[7],并参与肿瘤生物学过程[8]。骨骼肌是最大的蛋白质储存库,氨基酸稳态被严格调控,而且骨骼肌拥有丰富的肌浆网。ASNS在同时患有阿尔茨海默病和恶性肿瘤的动物骨骼肌组织中是否被影响,以及内质网未折叠蛋白反应是否参与ASNS活性调节尚未见报道。
本研究利用C57BL/6J小鼠和淀粉样蛋白前体蛋白/早老素1(amyloid precursor protein/presenilin 1,APP/PS1)小鼠移植黑色素瘤细胞后,观察小鼠肌肉组织中ASNS mRNA和蛋白表达水平的变化,并检测内质网应激相关蛋白的表达,旨在探讨ASNS对移植黑色素瘤APP/PS1小鼠骨骼肌减少的影响及其调控机制。
1 材料与方法
1.1 实验动物、主要试剂和仪器健康C57BL/6J(C57)小鼠14只及APP/PS1小鼠14只,体质量约为16~20 g,均为雄性,购自北京华阜康股份有限公司,SPF级,动物生产许可证号:SCXK(京)2014-0004。ASNS、葡萄糖调节蛋白78(glucose regulated protein 78,GRP78)、活化转录因子4(activating transcription factor 4,ATF4)、真核细胞起始因子2α(eukaryotic cell translation initiation factor 2α,eIF2α)、磷酸化eIF2α(p-eIF2α)和GAPDH单克隆抗体均购自美国Santa Cruz公司。ASNS、小鼠肌肉组织特异萎缩相关基因E3泛素连接酶1(E3 ubiquitin ligases-1,Atrogin-1)、肌肉环指蛋白1(muscle ring finger protein 1,MuRF1)和GAPDH引物由上海生工生物有限公司合成,TRIzol试剂(美国Invitrogen公司),PureLink RNA mini试剂盒(美国Ambion公司)。CFX 96实时荧光定量PCR(Real-time fluorescence quantitiative PCR,RTqPCR)仪、蛋白质电泳装置及转移系统、蛋白浓度分析仪和凝胶成像系统(美国Bio-Rad公司)。
1.2 小鼠黑色素瘤模型的建立和动物分组小鼠分为C57对照组、C57移植瘤组、APP/PS1对照组和APP/PS1移植瘤组,每组7只,饲养于通风、安静环境中,定时喂食,饮水不限。黑色素瘤B16细胞来自吉林大学病理学与病理生理学系。培养B16细胞,当细胞生长处于对数期时收集细胞,采用不含EDTA的0.25%胰酶消化。无菌PBS缓冲液清洗2次,再用PBS缓冲液重悬,细胞密度为1×107mL-1,用无菌注射器将100μL细胞悬液接种到C57移植瘤组和APP/PS移植瘤组小鼠背部右侧皮下[1]。小鼠饲养在22℃~24℃恒温环境、湿度为40%~60%的动物房中,每天观察小鼠的状态及肿瘤生长状况。
1.3 小鼠肌肉减少症指数(siarcopenia index,SI)计算用10%水合氯醛麻醉小鼠,分离腓肠肌并用手术刀剔除肌腱等结缔组织,取出腓肠肌后浸入生理盐水以清洗去掉附着的血液,并且称量前用滤纸吸除多余的生理盐水和组织液,称量骨骼肌质量,记录数值并保留小数点后2位,计算小鼠腓肠肌质量(mg)与体质量(g)的比值,即SI。
1.4 HE染色观察小鼠腓肠肌形态表现用10%水合氯醛麻醉小鼠,剪开胸廓,心脏暴露,将灌注针头经左心室刺入至主动脉,并用止血钳固定,剪开右心房,先用生理盐水快速灌注冲洗直至肝脏变白,然后用4%多聚甲醛磷酸盐缓冲液(pH 7.4)对其进行灌注固定,取出两侧完整的腓肠肌,并放置在4%多聚甲醛中固定24 h。用常规方法经过脱水、透明、包埋和切片制作石蜡切片,接着进行HE染色,封片,Olympus显微镜下观察并拍摄图片。
1.5 RT-qPCR法检测小鼠腓肠肌组织中ASNS、Atrogin-1和MuRF1 mRNA水平取每个冻存的小鼠腓肠肌组织30 mg,加入液氮充分研磨,应用TRIzol试剂提取总RNA,用PureLink RNA mini试剂盒纯化。纯化后经Nanodrop分光光度计NP-1000测定260 nm和280 nm波长处的吸光度(A)值,并计算样本总RNA浓度及评估纯度。应用预混型逆转录试剂(中国TRANS公司),以RNA为模板,反转录合成cDNA第一条链。每个样本取5 ng cDNA,应用RT-qPCR试剂盒进行PCR扩增,采用CFX96 RT-qPCR仪进行检测,引物序列见表1。反应条件:50℃、2 min,95℃、2 min预变性;95℃、15 s,64℃、15 s,72℃、45 s,共40个循环;72℃、10 min。以熔解曲线和产物电泳结果判断反应产物特异性。采用2-ΔΔCt法计算目的基因mRNA表达水平,ΔCt=目的基因Ct-内参照基因Ct。

表1 基因引物序列Tab.1Primer sequence of genes
1.6 Western blotting法检测小鼠腓肠肌组织中ASNS、GRP78、ATF4、eIF2α和p-eIF2α蛋白表达水平小鼠腓肠肌组织按1 mL/100 mg的量加入RIPA组织裂解液,提取总蛋白。蛋白浓度测定采用Bio-Rad方法,先配制12%聚丙烯酰胺凝胶,以β-actin的水平作为等量蛋白质上样对照,取30μg蛋白质样品,SDS-PAGE电泳,并用恒压100 V将蛋白转至PVDF膜上,之后用10%脱脂奶粉室温封闭1 h转至硝酸纤维素膜上;5%奶粉室温封闭2 h后,用含0.01%Tween 20的TBS缓冲液(TBST)漂洗3次,每次10 min;加入相应的抗体ASNS(1∶200)、GRP78(1∶200)、ATF4(1∶200)、eIF2α(1∶200)、p-eIF2α(1∶200)和GAPDH(1∶5 000),4℃孵育过夜,TBST漂洗3次后加入相应的辣根过氧化物酶标记的二抗(1∶2 000),常温摇床孵育2 h;TBST漂洗3次,每次10 min;DAB显色,凝胶图像分析系统拍照。以β-actin为内参照,按照下列公式计算目的蛋白表达水平:目的蛋白表达水平=目的蛋白条带A值/β-actin条带A值。
1.7 统计学分析采用SPSS 20.0统计软件进行统计学分析。各组小鼠腓肠肌SI,小鼠腓肠肌组织中ASNS、Atrogin-1和MuRF1 mRNA表达水平及ASNS、GRP78、ATF4、eIF2α和p-eIF2α蛋白表达水平,均符合正态分布且方差齐,以±s表示,多组间样本均数比较采用单因素方差分析,组间两两比较采用SNK-q检验。以P<0.05为差异有统计学意义。
2 结果
2.1 各组小鼠腓肠肌SI与C57对照组比较,C57移植瘤组小鼠腓肠肌SI明显降低(P<0.05);与APP/PSI对照组比较,APP/PSI移植瘤组小鼠腓肠肌SI明显降低(P<0.05);与C57移植瘤组比较,APP/PSI移植瘤组小鼠腓肠肌SI明显降低(P<0.05)。见图1。
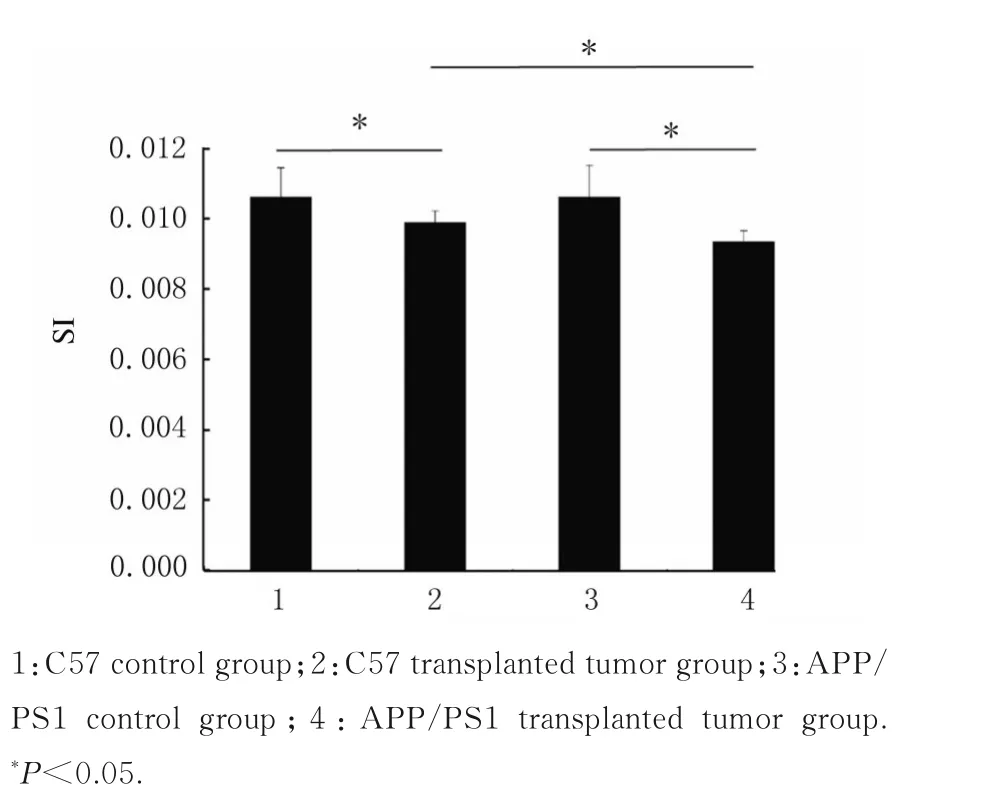
图1 各组小鼠腓肠肌SIFig.1SI of gastrocnemius tissue of mice in various groups
2.2 各组小鼠腓肠肌组织形态表现C57对照组小鼠腓肠肌细胞横断面可见骨骼肌细胞排列规则,细胞核呈扁椭圆形,围绕肌膜下排列,肌浆呈红色和白色肌纤维形态。C57移植瘤组小鼠腓肠肌细胞呈现玻璃样变性,肌浆呈现蓝染,部分细胞核可见核内移现象(箭头所示)。APP/PS1对照组小鼠腓肠肌组织中细胞排列规则,细胞核可见少量核内移现象,肌浆可见红色和白色肌纤维形态。APP/PS1移植瘤组小鼠腓肠肌可见部分肌纤维肿胀,部分肌纤维变细,细胞核内移现象多见,肌浆颜色以红色为主。见图2。
2.3 各组小鼠腓肠肌组织中Atrogin-1和MuRF1 mRNA表达水平与C57对照组比较,C57移植瘤组小鼠腓肠肌组织中Atrogin-1和MuRF1 mRNA表达水平明显升高(P<0.05);与APP/PS1对照组比较,APP/PS1移植瘤组小鼠腓肠肌组织中的Atrogin-1和MuRF1 mRNA表达水平明显升高(P<0.05);与C57移植瘤组比较,APP/PS1移植瘤组小鼠腓肠肌组织中Atrogin-1 mRNA表达水平明显升高(P<0.05),MuRF1 mRNA表达水平明显降低(P<0.05)。见表2。
表2 各组小鼠腓肠肌组织中Atrogin-1和Mu RF1 mRNA表达水平Tab.2Expression levels of Atrogin-1 and MuRF1 mRNA gastrocnemius tissue of mice in various groups (n=7,±s)
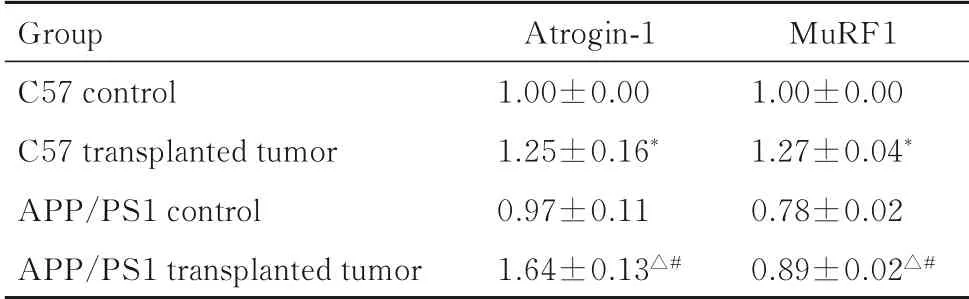
表2 各组小鼠腓肠肌组织中Atrogin-1和Mu RF1 mRNA表达水平Tab.2Expression levels of Atrogin-1 and MuRF1 mRNA gastrocnemius tissue of mice in various groups (n=7,±s)
*P<0.05 compared with C57 control group;△P<0.05 compared with APP/PS1 control group;#P<0.05 compared with C57 transplanted tumor group.
Group C57 control C57 transplanted tumor APP/PS1 control APP/PS1 transplanted tumor Atrogin-1 1.00±0.00 1.25±0.16*0.97±0.11 1.64±0.13△#MuRF1 1.00±0.00 1.27±0.04*0.78±0.02 0.89±0.02△#
2.4 各组小鼠腓肠肌组织中ASNS mRNA表达水平与C57对照组比较,C57移植瘤组小鼠腓肠肌组织中ASNS mRNA表达水平明显升高(P<0.05);与APP/PS1对照组比较,APP/PS1移植瘤组小鼠腓肠肌组织中ASNS mRNA表达水平明显升高(P<0.05);与C57移植瘤组比较,APP/PS1移植瘤组小鼠腓肠肌组织中ASNS mRNA表达水平明显降低(P<0.05)。见图3。
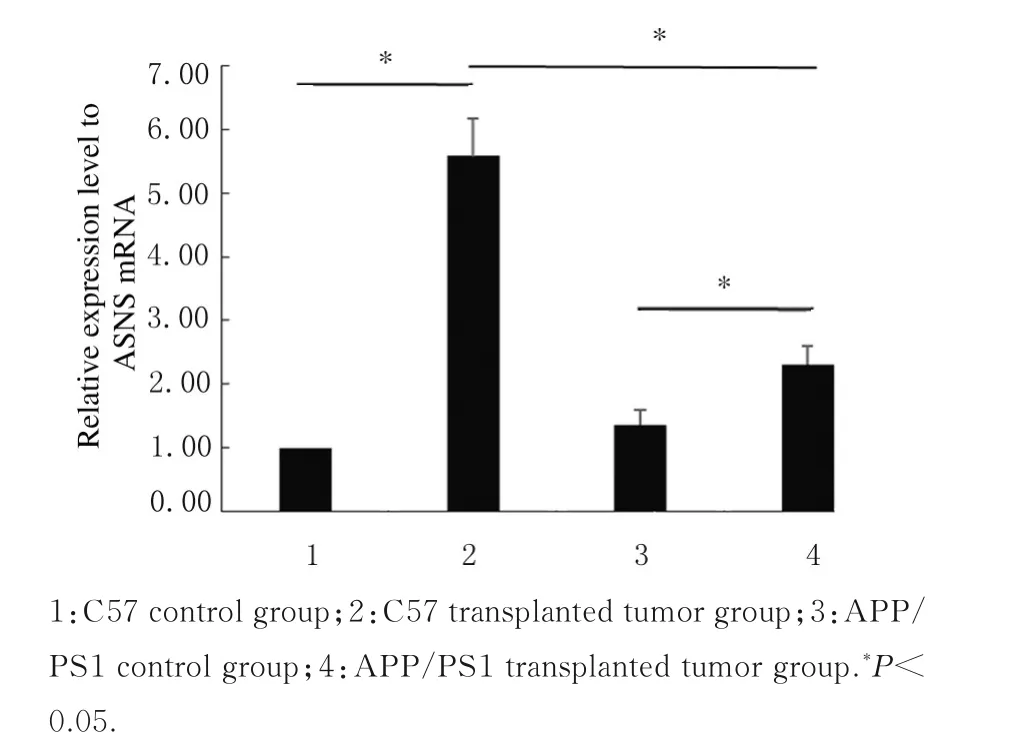
图3 各组小鼠腓肠肌组织中ASNS mRNA表达水平Fig.3Expressionlevelsof ASNSmRNAin gastrocnemius tissue of mice in various groups
2.5 各组小鼠腓肠肌组织中ASNS蛋白表达水平与C57对照组比较,C57移植瘤组小鼠腓肠肌组织中ASNS蛋白表达水平明显升高(P<0.05);与APP/PS1对照组比较,APP/PS1移植瘤组小鼠腓肠肌组织中ASNS蛋白表达水平明显升高(P<0.05);与C57移植瘤组比较,APP/PS1移植瘤组小鼠腓肠肌组织中ASNS蛋白表达水平差异无统计学意义(P>0.05)。见图4。

图4 Western blotting法检测各组小鼠腓肠肌组织中ASNS蛋白表达电泳图(A)和直条图(B)Fig.4Electrophoregram(A)andhistogram(B)of expressions of ASNS protein in gastrocnemius tissue of mice in various groups detected by Western blotting method
2.6 各组小鼠腓肠肌组织中PERK-eIF2α-ATF4信号通路蛋白表达水平与C57对照组比较,C57移植瘤组小鼠腓肠肌组织中GRP78、ATF4蛋白表达水平和p-eIF2α/eIF2α蛋白表达水平比值明显升高(P<0.05);与APP/PS1对照组比较,APP/PS1移植瘤组小鼠腓肠肌组织中GRP78、ATF4蛋白表达水平和p-eIF2α/eIF2α蛋白表达水平比值明显升高(P<0.05);与C57移植瘤组比较,APP/PS1移植瘤组小鼠腓肠肌组织中GRP78、ATF4蛋白表达水平和p-eIF2α/eIF2α蛋白表达水平比值明显降低(P<0.05)。见图5和图6。
3 讨 论
本研究基于同时患有阿尔兹海默病和恶性肿瘤的动物模型,从两者之间氨基酸适应性反应ASNS转录水平及蛋白水平角度,探讨正常组小鼠和患有阿尔兹海默病小鼠移植黑色素瘤后,骨骼肌发生肌肉减少的可能分子机制,以明确两种疾病之间的关系,也为其预防和治疗提供检测指标和理论基础。
本研究结果显示:C57移植瘤组和APP/PS1移植瘤组小鼠部分骨骼肌细胞核可见核内移现象,这是骨骼肌减少的特征性形态学标志。根据疾病的严重程度将肌肉减少症分为3期[9-11]:仅有肌肉质量减少为肌肉减少症前期;肌肉质量减少伴随肌肉力量下降或身体活动能力降低为肌少症期;肌肉质量减少伴随肌肉力量下降和身体活动能力降低为重度肌肉减少症期。本研究结果显示:从小鼠骨骼肌SI和形态学表现方面看,C57移植瘤组和APP/PS1移植瘤组小鼠表现出肌肉减少症前期表型,即骨骼肌肌肉减少;与C57移植瘤组比较,APP/PS1移植瘤组小鼠发生的骨骼肌肌肉减少更明显。
肌肉蛋白质合成和降解途径之间动态平衡被改变时,就会发生肌肉减少[12]。肌肉蛋白合成减少和泛素化降解增多[1]是肌肉蛋白质减少的主要机制。肌肉组织特异泛素-蛋白酶体系统标志物Atrogin-1和MuRF1表达上调与骨骼肌萎缩有关[13-14]。在适应性应激反应中,泛素蛋白酶体途径也被认为适应性反应之一[5]。本研究结果显示:分别与C57和APP/PS1对照组比较,C57移植瘤组和APP/PS1移植瘤组小鼠腓肠肌组织中Atrgin-1和MuRF1 mRNA表达水平均升高。泛素连接酶Atrogin-1和MuRF1是调节蛋白质降解的重要因子,是骨骼肌特异的与萎缩相关的基因,也是肌肉蛋白质降解的标志[15]。本研究结果提示:C57移植瘤组和APP/PS1移植瘤组小鼠腓肠肌组织中Atrgin-1 mRNA和MuRF1 mRNA表达水平与骨骼肌发生肌肉减少有关。
黑色素瘤高度依赖谷氨酰胺水平,骨骼肌的蛋白合成的主要氮源也来自谷氨酰胺,考虑到ASNS催化的反应也影响了其他3个反应物的水平,因此ASNS活性在评价谷氨酰胺稳态时被考虑到。ASNS对实体肿瘤组织具有促进增殖的作用[16-17],具体作用与ASNS的转录水平或蛋白水平有关。本研究结果显示:与C57对照组比较,C57移植瘤组小鼠腓肠肌组织中ASNS mRNA和蛋白表达水平均升高,与APP/PS1对照组比较,APP/PS1移植瘤组小鼠腓肠肌组织中ASNS mRNA和蛋白表达水平均升高,提示移植瘤诱导ASNS mRNA和蛋白表达水平升高,可能与移植瘤组织增殖有关;与C57移植瘤组比较,APP/PS1移植瘤组小鼠腓肠肌组织中ASNS mRNA表达水平降低,蛋白表达水平差异无统计学意义,提示APP/PS1移植瘤组小鼠肌肉减少更明显,且与ASNS mRNA转录活性降低有关,可能减少了蛋白质合成。

图6 各组小鼠腓肠肌组织中PERK-eIF2α-ATF4信号通路蛋白表达水平Fig.6Expression levels of PERK-eIF2α-ATF signal pathway proteins in gastrocnemius tissue of mice in various groups
肿瘤细胞在生长过程中过度的增殖增加了对蛋白合成的需求,最终超过内质网蛋白折叠能力,错误折叠蛋白的堆积导致内质网应激[18]。据报道ASNS由氨基酸反应和内质网未折叠蛋白反应(unfolded rotein response,UPR)所 激 活[19]。内质网应激通过UPR也增加了ASNS转录[20]。有研究[5,21]显示:内质网应激在衰老的小鼠骨骼肌中被诱导,在饥饿时骨骼肌中可见内质网应激和UPR标志物被高度激活。ATF4结合CARE,并诱导ASNS转录[22]。产生的错误折叠蛋白由泛素蛋白酶途径和自噬途径降解。本研究结果显示:与C57移植瘤组比较,APP/PS1移植瘤组小鼠腓肠肌组织中GRP78、p-eIF2α和ATF4蛋白表达水平降低,与ASNS mRNA表达水平降低相一致,提示PERK-eIF2α-ATF4信号途径可能通过诱导ASNS转录,在APP/PS1移植瘤组小鼠的肌肉减少中发挥作用。
