产DHA破囊壶菌Aurantiochytrium sp. HX2019010的筛选及其脂肪酸组成分析
2021-07-28肖玉娟甘美裕林俊杰庄峙厦何少贵
肖玉娟 甘美裕 林俊杰 庄峙厦 何少贵 傅 奇
(厦门华厦学院环境与公共健康学院,厦门 361024)
DHA是一种具有多种生理功能的多不饱和脂肪酸[1-3],在食品、药品以及饲料等领域得到广泛应用[4-6]。DHA的主要来源包括深海鱼类和微生物[7],其中利用微生物发酵生产DHA由于生产周期短、产量高、培养条件简单、可规模化生产等优点,已成为DHA最主要的来源之一[8-10]。
破囊壶菌科(Thraustochytriaceae)包括Aurantiochytrium、Schizochytrium、Oblongichytrium等属[11],其中Aurantiochytrium和Schizochytrium属的多个种可以生产DHA[12, 13],2010年,我国批准了Schizochytrium属生产的DHA藻油作为新资源食品(卫计委2010年第3号令)。Chang等[14]的研究表明,Aurantiochytrium属菌种与Schizochytrium属菌种相比,在培养基利用和脂肪酸生产上具有自身的特色和优势,同一属的不同菌株在DHA表达上也有较大的差异,筛选产DHA的不同种类破囊壶菌具有一定的研究价值。
1 材料与方法
1.1 材料
1.1.1 样本
分离菌株样本为腐木,采集于厦门市集美区红树林,置于4 ℃冷藏[15]。
1.1.2 试剂
2216E(液体);2216E琼脂;葡萄糖(食品级);酵母浸粉;海水晶;谷氨酸钠、维生素B1、维生素B12、泛酸钙、氨水(25%~28%)、乙醇、石油醚:分析纯,DHA甲酯标准品(色谱纯);真菌DNA提取试剂盒;ITS扩增引物ITS1: 5’-TCCGTAGGTGAACCTGCGG-3’、ITS4: 5’-TCCTCCGCTTATTGATATGC-3’。
1.2 仪器与设备
Aeris-bg096型PCR仪,HE99型核酸电泳仪,211B型摇床,LRH-250型生化培养箱,Quanta450型扫描电镜,GC-2010plus型岛津气相色谱,GUJS-50L型发酵罐,BL-18X型真空冷冻干燥器。
1.3 方法
1.3.1 样品处理
取腐木25 g加入225 mL 2216E液体培养基拍打均质,4层纱布过滤后,于外加3%葡萄糖的2216E琼脂平板稀释涂布,28 ℃培养72 h,取细胞直径显著大于酿酒酵母的球状菌菌落划线纯化[15]。
1.3.2 细胞形态观察
纯化后的菌株接种至添加3%葡萄糖的2216E液体培养基,28 ℃培养48 h,0.22 μm滤膜过滤收集细胞,取滤膜进行扫描电镜观察细胞形态。
1.3.3 菌种鉴定
用真菌基因组DNA抽提试剂盒,提取菌株的总DNA;用ITS引物扩增(具体的引物序列),所得PCR产物电泳纯化后进行测序。
ITS扩增条件:94 ℃预变性4 min;94 ℃变性45 s,55 ℃退火55 s,72 ℃延伸60 s,共35个循环;72 ℃延伸10 min。
将测序结果在Genbank进行比对,选择相似度较高的菌种序列,分别用BioEdit[16]和Clustal X[17]进行比对和编辑,取有效区间,采用最大简约算法,用Paup* 4.0构建进化树[18, 19],选择AspergillusnigerATCC 16888[20]作为外群。
1.3.4 发酵
由于破囊壶菌对氧、补料和pH控制要求较高,为了保证脂肪酸组成分析结果与工业生产过程相一致,使用50 L发酵罐进行菌体培养,并结合文献报道与预实验结果选择发酵条件。
种子培养基使用成品2216E液体培养基加入3%葡萄糖,30 ℃,180 r/min培养48 h。
发酵培养基[21, 22]:葡萄糖 5 g/L,酵母浸粉 5 g/L,谷氨酸钠 10 g/L,MgSO4·7H2O 2 g/L,海水晶 12 g/L,维生素B10.009 5 g/L,维生素B120.000 15 g/L,泛酸钙 0.003 2 g/L。
50 L发酵罐中初始装液量为25 L;接种量为10%;发酵温度为30 ℃;4h后流加饱和葡萄糖溶液,控制发酵液残糖在5 g/L,96 h停止补料;10%磷酸和氨水控制pH在5.5~6.5;初始搅拌速度为200 r/min,初始通气比为1∶0.5,通过调节搅拌速度和通气量控制溶解氧(DO)在12 h内不低于20、40 h内不低于5,40 h后保持在0左右[23];98 h放罐,每4 h取样测发酵液残糖,每8 h取样检测发酵液中生物量及细胞中的总脂肪酸和DHA含量。
1.3.5 生物量、残糖与油脂检测
生物量:取发酵液100 mL于8 000 r/min离心,弃上清液后,去离子水振荡洗涤2次,真空冷冻干燥2 d称质量。
残糖:DNS法测定发酵液中葡萄糖[24]。
总脂肪:按照GB 5009.168—2016《食品中脂肪酸的测定》酸水解法测定总脂肪。
脂肪酸测定:提取的总脂肪按照GB 5009.168—2016《食品中脂肪酸的测定》皂化并甲酯化后,按照外标法测定DHA[25]。
2 结果与分析
2.1 菌株分离纯化
从海水腐木中筛选得到一株球状真菌,菌落白色、湿润,编号为HX2019010,细胞形态, HX2019010细胞扫描电镜图如图1所示,放大倍数为6 000倍,左侧为年轻细胞,右侧中褶皱较多的细胞为老龄细胞。
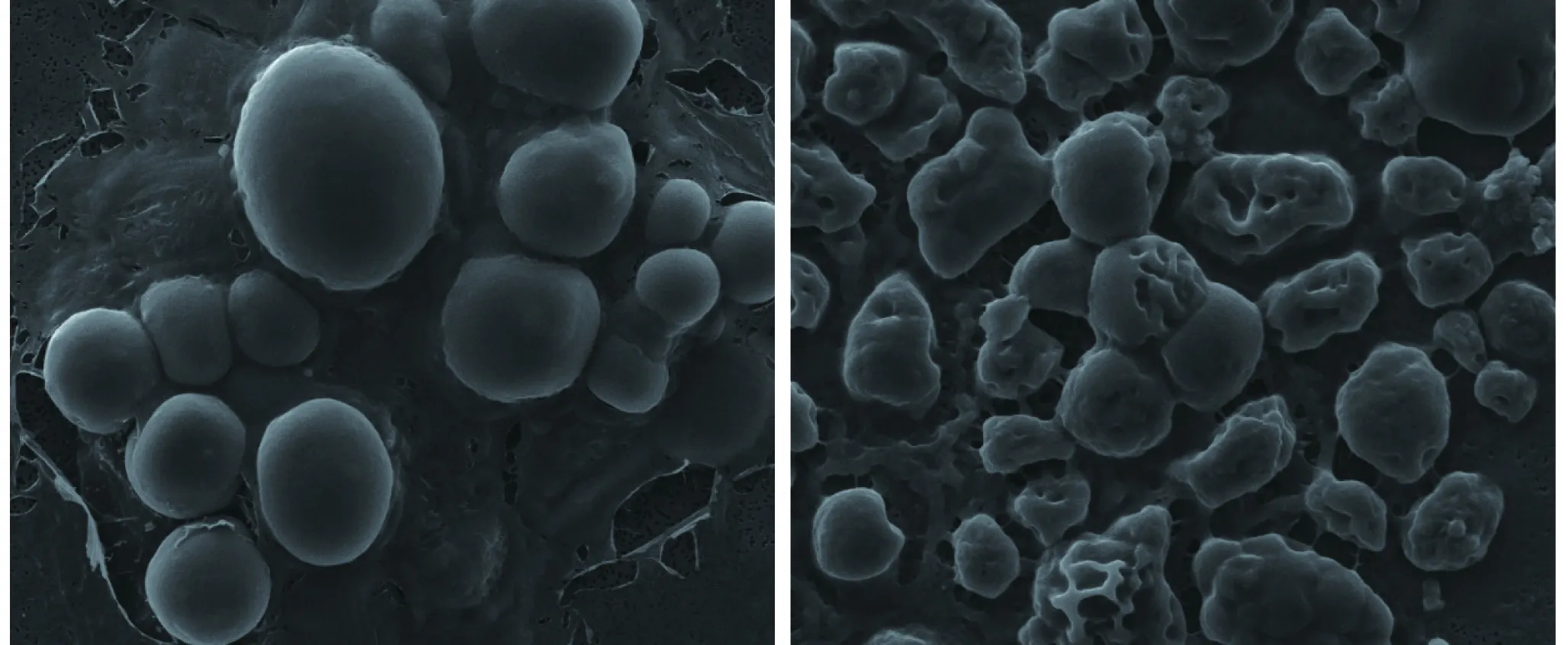
图1 HX2019010细胞扫描电镜图
2.2 菌种鉴定
菌株HX2019010 ITS序列经测序拼接后,得到460 bp有效序列,于Genbank进行比对发现该序列与Aurantiochytrium、Schizochytrium、Thraustochytrium等破囊壶菌科菌株相似度相对较高。选择相似度较高的菌株ITS序列构建进化树, 基于ITS序列的进化树如图2所示。
树长为2 290,一致性指数(CI)为0.527,保留指数(RI)为0.774,同性指数(HI)为0.473。各分枝自展值较高,树形结构可靠,其中HX2019010菌株与Aurantiochytrium聚合在一枝。但值得注意的是该菌株ITS序列与Genbank中现有ITS序列全序列相似度较低,相似度最高的AurantiochytriumlimacinumIMB177、AurantiochytriumlimacinumIMB181菌株也仅有部分区域相似度达92%,不足以判定为同一个种,因此,结合细胞形态,初步鉴定为Aurantiochytriumsp. HX2019010。ITS序列上传至Genbank,序列号为MN931688。
2.3 发酵曲线
发酵过程中pH、DO、残糖、生物量、总脂肪和DHA含量曲线, 菌株HX2019010发酵曲线如图3所示,此批曲线仅用于标示后续用于脂肪酸组成分析所用细胞的制备过程,不代表最优发酵条件。
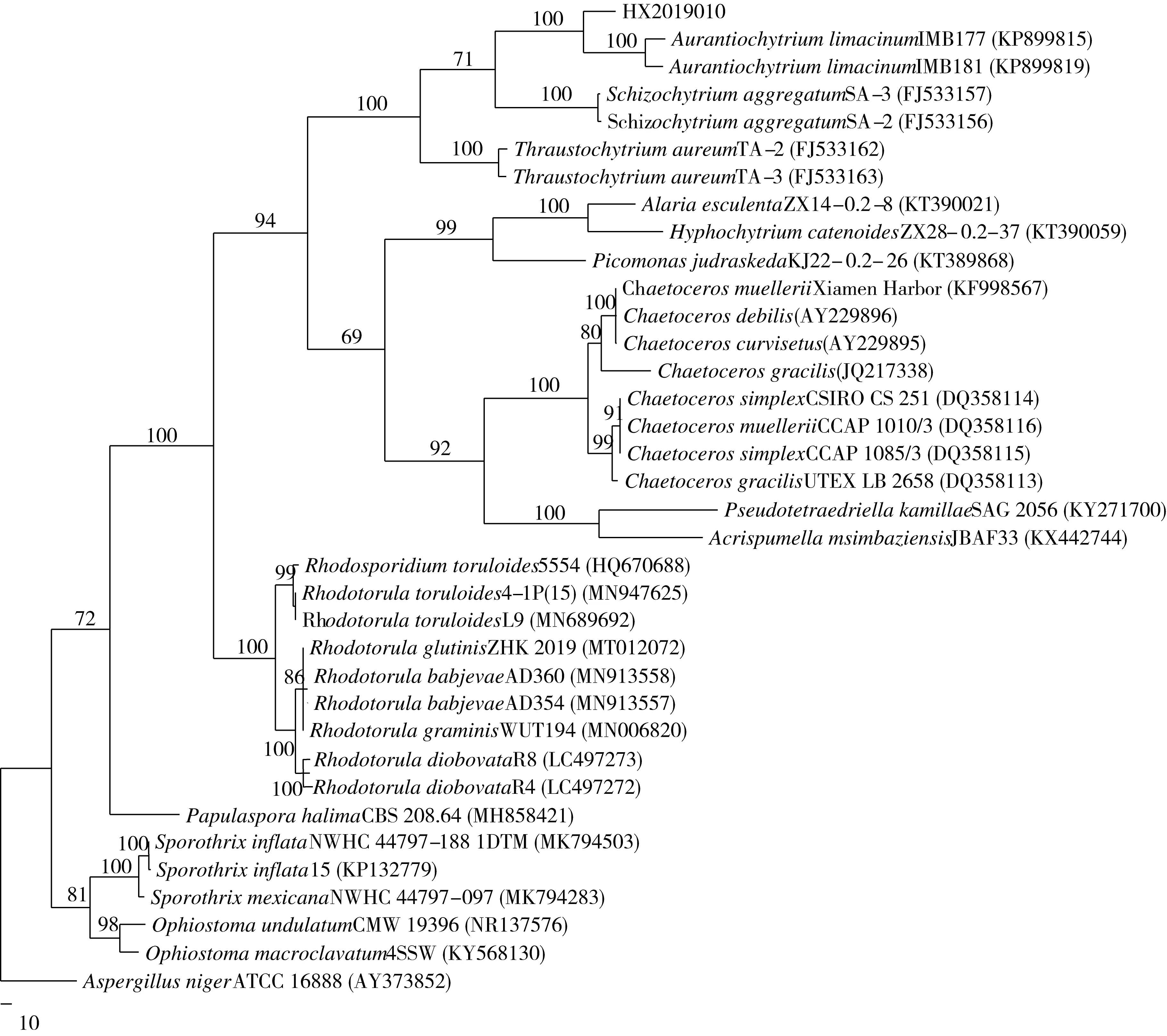
图2 基于ITS序列的进化树
从图3可以看出,菌株HX2019010在此培养条件下快速生长并合成DHA,接种后8 h左右进入对数生长期,56 h后细胞中脂肪大量积累。98 h发酵后,生物量可达108.27 g/L;干细胞中总脂肪含量达26.26%,发酵液中脂肪含量达28.43 g/L;DHA占细胞干质量的8.47%,发酵液中DHA含量达9.17 g/L。
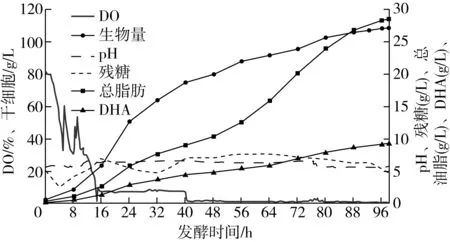
图3 菌株HX2019010发酵曲线
从总脂肪与DHA增长曲线可以看出,后期总脂肪和DHA都在积累,但DHA在脂肪酸中的比例有所降低,与裂殖壶菌发酵过程中后期DHA大量积累有显著差异[26-28],可能系培养条件更有利于Aurantiochytriumsp. HX2019010积累其他脂肪酸组分或不利于其他脂肪酸向DHA转化,后续将继续对其发酵条件进行优化。
2.4 脂肪酸组成
发酵罐中培养48 h和98 h的Aurantiochytriumsp. HX2019010细胞离心、洗涤,真空冷冻干燥48 h后,按照GB 5009.168—2016外标法进行测定,脂肪酸含量以每100 g干细胞中的脂肪酸质量计,Aurantiochytriumsp. HX2019010脂肪酸组成见表1。Aurantiochytriumsp. HX2019010细胞主要脂肪酸组成为棕榈酸(35.57%~37.41%)、DHA(32.25%~45.86%)和肉豆蔻酸(7.43%~9.22%)。发酵98 h后细胞中各种脂肪酸含量普遍高于48 h细胞,总脂肪酸含量增加103.42%,其中棕榈酸增加93.37%,肉豆蔻酸增加152.35%,DHA增加43.07%。在发酵后期,DHA积累相对较少,表明DHA的合成受到抑制,可能与氧、有机氮源和生物素供应不足以及培养温度有关[29]。
菌株Aurantiochytriumsp. HX2019010胞内脂肪酸中DHA比例波动较大,较高值可达45.86%,高于商业化生产DHA的裂殖壶菌SchizochytriumlimacinumSR21中DHA比例(32%~40%),但胞内总油脂含量较低[23]。与牟桐等[30]筛选的6株破囊壶菌相比,饱和脂肪酸棕榈酸和肉豆蔻酸含量较高,但总油脂产量也较高。与李晶晶等[31]筛选的破囊壶菌Sw7菌株脂肪酸组成较为相似,总脂肪酸含量较低,但发酵液中细胞密度显著较高。
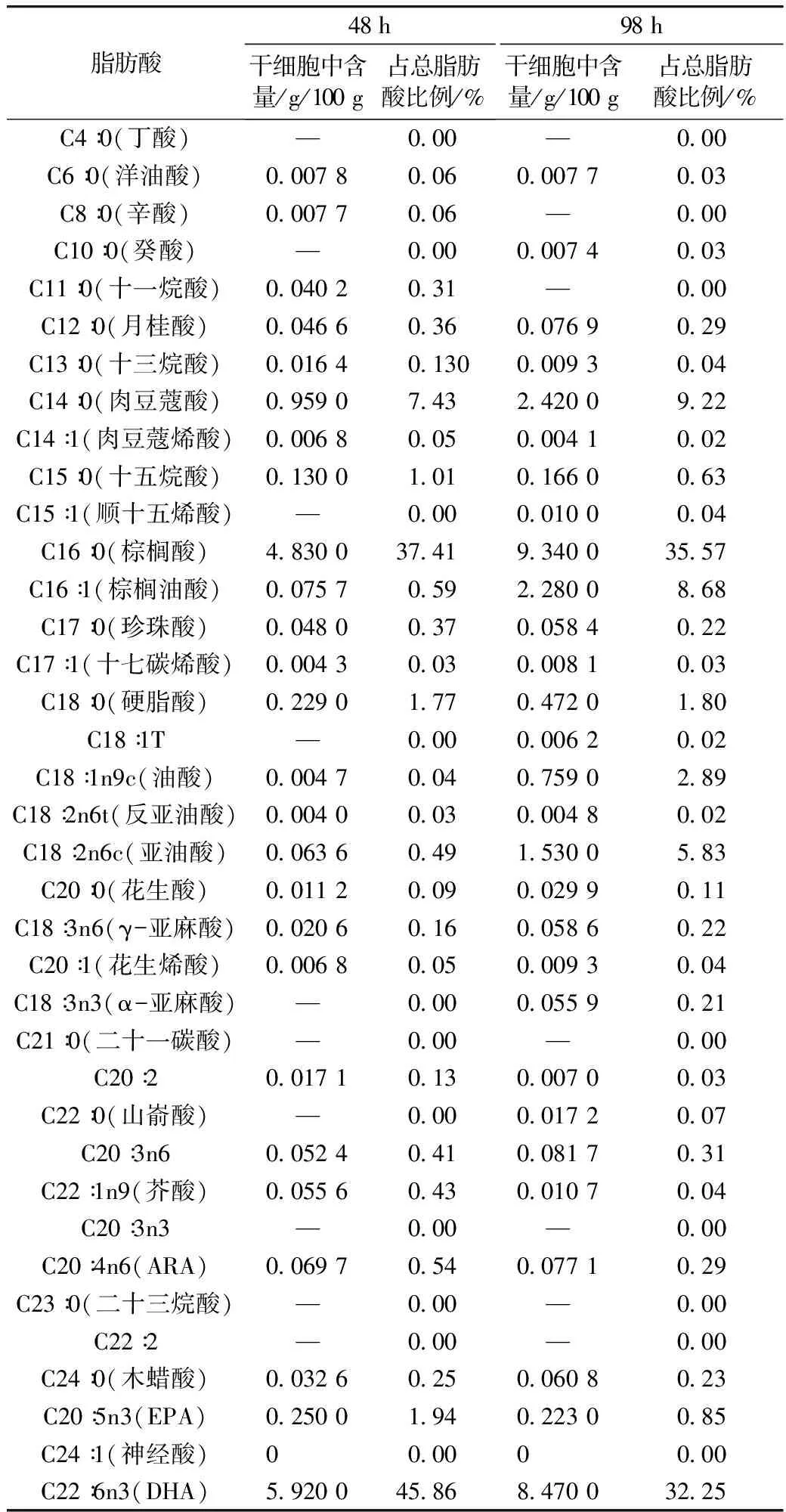
表1 Aurantiochytrium sp. HX2019010脂肪酸组成
综合分析,菌株Aurantiochytriumsp. HX2019010在发酵罐中可实现高密度发酵,且DHA占总脂肪酸含量较高,DHA产量显著高于已报道的Aurantiochytrium属菌株[29],具有进一步研究的价值,但细胞中油脂含量较低,且发酵后期DHA积累较少,有待于进一步优化发酵条件。
3 结论
从厦门市集美区海水腐木中筛选得到一株产DHA的球状真菌HX2019010,经ITS序列比对与系统发育分析,结合扫描电镜观察,初步鉴定为Aurantiochytriumsp. HX2019010。该菌株在50 L发酵罐中可实现较高密度的发酵,98 h培养后发酵液中生物量可达108.27 g/L,脂肪含量达28.43 g/L,DHA含量达9.17 g/L。细胞中脂肪酸主要成分为棕榈酸、DHA和肉豆蔻酸,含量与比例受发酵时间或培养条件的影响,其中DHA占总脂肪酸的32.25%~45.86%,具有进一步研究的价值。该菌株ITS序列与Genbank中现有破囊壶菌序列存在较大差异,不排除其为Aurantiochytrium新种的可能性,有待进行全基因组平均核苷酸一致性(Average Nucleotide Identity, ANI)分析。
