基于上转换纳米颗粒和金纳米颗粒的Cd2+免疫检测新方法
2021-07-28张林威程云辉陈茂龙
邓 晨 , 李 琳 , 张林威 , 程云辉 , 陈茂龙 , 许 宙 *
(1. 长沙理工大学 化学与食品工程学院, 湖南 长沙 410114; 2. 上海理工大学 医疗器械与食品学院, 上海200093)
镉(Cd)是一种重要的金属元素,常被应用于颜料、电池、电镀和荧光涂料加工等领域,因此广泛分布于空气、水、土壤等环境中[1]。同时,Cd 作为一种潜在的有毒重金属元素,可通过食物链进入人体引起慢性中毒,对人体的肾脏、肝脏、心血管、神经等方面都有损害[2-5],严重威胁到了人类健康,已被列为环境与食品污染的主要公害之一[6]。 世界卫生组织规定,饮用水中 Cd2+的限量标准为 3 μg/L[7]。 为了控制环境污染物,保证人类生活质量,探索一种高效的Cd2+分析方法具有重要意义。 目前常用的重金属检测方法主要有原子吸收光谱法[8-9]、电感耦合等离子体质谱法[10]、表面增强拉曼光谱法[11]等。 这些检测方法能够实现对重金属Cd 的高灵敏度分析, 但常需要专业人员操作,而且成本较高,样品预处理复杂耗时。 因此,迫切需要建立一种方便快捷、低成本、高灵敏度的Cd2+快速检测方法。
荧光共振能量转移(fluorescence resonance energy transfer,FRET)是一种均相分析检测技术,其概念最早是由Förster 于1948 年提出的。 他提出在满足两个荧光基团的空间距离在1~10 nm 之间,并且荧光能量供体的发射光谱和荧光能量受体的吸收光谱存在重叠的前提下,如果用入射光激发供体,供体能量就可以传递给受体[12]。 上转换纳米颗粒 (upconversion nanoparticles,UCNPs)的低能量长波经近红外光照射后可以变为高能量短波[13],可作为一种理想的FRET 体系的能量供体; 同时金纳米颗粒(gold nanoparticles,AuNPs) 因其可见光吸收范围宽、猝灭效率和消光系数较高的特点而被广泛用作FRET 体系的能量受体[14]。因此,UCNPs 与 AuNPs 可构成FRET 体系。
本研究基于 UCNPs 和 AuNPs 间的FRET 机制和抗原抗体的识别作用构建了Cd2+的免疫检测平台。 UCNPs 和 AuNPs 通过 Cd-抗原、Cd-抗体组装在一起时,发生FRET 过程,导致UCNPs 荧光猝灭;当体系中目标物Cd2+存在时, 会与Cd-抗原特异性竞争Cd-抗体,使组装体分散,抑制FRET 过程,荧光强度与Cd2+浓度在一定范围内呈正相关, 从而实现对Cd2+的快速定量检测。该方法具有操作简便、灵敏度高、成本较低的特点。
1 材料与方法
1.1 试剂
六水合氯化钇(YCl3·6H2O)、聚丙烯酸(PAA)、六水合氯化镱(YbCl3·6H2O)、油酸(OA)、六水合氯化铒(ErCl3·6H2O)、1-十八烯(ODE):购于北京百灵威科技有限公司;1-乙基-3-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐 (EDC)、 硫代羟基琥珀酰亚胺(sulfo-NHS): 购于上海麦克林生化科技有限公司;氢氧化钠、氟化铵、柠檬酸三钠、氯金酸、磷酸氢二钠、 磷酸二氢钠,4-(2-羟乙基)-1-哌嗪乙磺酸(HEPES):购于国药集团化学试剂有限公司;氯化钠、氯化钾:购于广东光华科技股份有限公司。
1.2 仪器
MDL-Ⅲ-980-2W 型激光发射器: 中国长春新产品光电技术有限公司生产;F96PRO 型荧光分光光度计: 上海棱光技术有限公司生产;ZNCL-TS 型磁力搅拌电热套:河南巩义市宏华仪器设备有限公司生产;JEOLJEM-2100 型透射电子显微镜:日本电子株式会社生产;UV-1800 型紫外可见分光光度计:日本岛津公司生产。
1.3 实验方法
利用Cd-抗原修饰的UCNPs 与Cd-抗体修饰的AuNPs 构建基于FRET 体系的免疫检测平台。 当检测体系中没有目标物Cd2+时,FRET 过程致使UCNPs 的荧光被淬灭;当检测体系中有目标物Cd2+时,FRET 程度降低,UCNPs 的荧光值增加。Cd2+质量浓度越高,Cd-抗原修饰的UCNPs 与Cd-抗体修饰的AuNPs 结合得越少, 荧光强度越高。 通过建立Cd2+质量浓度与荧光强度之间的线性关系即可实现Cd2+的定量检测,实验原理见图1。

图1 荧光共振能量转移体系检测Cd2+原理图Fig. 1 Schematic diagram of Cd2+detected by FRET
1.3.1 水溶性UCNPs 的制备 参照文献[19]的报道来合成油溶性 UCNPs: 称取 0.473 2 g YCl3·6H2O、0.156 0 g YbCl3·6H2O、0.015 0 g ErCl3·6H2O 于100 mL三颈烧瓶中,加入12 mL OA 和30 mL ODE,在氮气保护下于1 500 r/min 进行搅拌的同时逐渐升温至160 ℃,至混合物形成均一溶液后自然冷却至室温;准确称取0.260 0 g NaOH 和0.260 7 g NH4F 溶于10 mL 甲醇中,充分溶解混合,将溶液逐滴加入上述三颈烧瓶中,1 500 r/min 磁力搅拌30 min,随后缓慢加热至300 ℃以蒸发甲醇,并于氮气保护下继续加热1 h。 溶液自然冷却后,用乙醇将其从溶液中沉淀出来,用乙醇和环己烷(体积比为5∶1)的溶液清洗3 次,烘干,即得油溶性UCNPs。
参照文献[15]采用的配体交换法来制备水溶性UCNPs,油溶性UCNPs 在水中的分散性极差,故利用PAA 对该材料表面进行修饰。 于20 mL 乙醇溶液和10 mL 氯仿溶液中分别加入10 mL PAA 和5 mL 油溶性UCNPs,再将两种溶液混合搅拌24 h,乙醇清洗3 次后将得到的UCNPs 分散于水中。
1.3.2 AuNPs 的制备 AuNPs 采用柠檬酸三钠还原氯金酸(HAuCl4)法[16]合成,步骤如下:在锥形瓶中加入 97.5 mL 超纯水及 2.5 mL HAuCl4(10 mmol/L)溶液,搅拌至沸腾。 在沸腾7~8 min 后,于锥形瓶中加入2 mL 质量浓度为1 g/dL 的柠檬酸三钠溶液,待溶液变成酒红色,继续加热10 min 后立即停止加热。继续搅拌15 min 后,取下锥形瓶,得到的酒红色液体即为AuNPs。
1.3.3 能量供体探针的制备 用Cd-抗原对UCNPs 进行功能化修饰制备能量供体探针。取1 mg水溶性 UCNPs 加到 0.1 mL 磷酸盐缓冲液(PBS,pH 7.4) 中, 然后将混合液加到称有 EDC、NHS 各0.2 mg 的锥形瓶中, 摇床孵育 15 min。 准确量取0.01 mL Cd-抗原(0.2 mg/mL)溶于 2 mL PBS 缓冲液, 再加入之前的锥形瓶中,6 000 r/min 离心4 h。用PBS 缓冲液离心洗涤3 次,4 ℃下避光贮存备用。
1.3.4 能量受体探针的制备 用Cd-抗体对AuNPs进行功能化修饰制备能量受体探针。 将Cd-抗体用硼酸盐缓冲液(BB,pH 8.2)稀释至 5 μmol/L,并用0.1 mol/L 碳酸钾溶液将 0.5 mL AuNPs 溶液(2 nmol/L)的 pH 值调至 8.2,摇匀后加入 1 mL 抗体溶液(5 μmol/L)中,缓慢搅拌 50 min 后,在室温下用 50 μL、10 g/dL 的 BSA 溶液封闭 2 h,于 7 000 r/min离心25 min,除去上清液,将沉淀物重悬于1 mL 含有5 g/dL 海藻糖的BB 溶液中供下一步使用。
1.3.5 螯合剂体系 Cd-抗体无法直接识别Cd2+,需先将Cd2+与EDTA 反应生成螯合物, 才能与抗体结合。
50 mmol/L HEPES (pH 7.4)缓冲溶液的配制:将 HEPES (2.38 g,10 mmol)溶于 180 mL 去离子水中,摇晃至全溶,一边搅拌一边慢慢滴加0.1 mol/L的NaOH 溶液至pH 为7.4,然后用去离子水定容至200 mL。
螯合剂体系:将0.02~0.1 mol/L 的HEPES 缓冲液(pH 7.2~8)和 1 mmol/L 的 EDTA 按体积比 10∶1混合摇匀。取100 mL 的待测样品液加到2 mL 锥形瓶中,并向锥形瓶中加入100 μL 终浓度为1 mmol/L 的螯合剂,室温条件下摇床孵育2 h。
1.3.6 标准曲线的绘制 用超纯水把1 mg/mL 的Cd2+标准样品稀释成各个梯度:0.1、0.2、0.5、1、5、10、50、100 ng/mL。于 500 μL UCNPs-抗原溶液中,分别加入10 μL 以上不同质量浓度的Cd2+标准液,混合均匀,再加入500 μL AuNPs-抗体溶液,终体系中Cd2+的质量浓度分别为:0.01、0.02、0.05、0.1、0.5、1、5、10 ng/mL。 常温下孵育 30 min 后,6 000 r/min 离心10 min 除去多余的AuNPs,并用荧光分光光度计检测543 nm 波长处的荧光强度。
1.3.7 特异性实验 分别配制10 ng/mL 的Cu2+、Hg2+、Zn2+、Pb2+、Co2+标准品溶液。 利用上述免疫检测新方法测定荧光强度,通过比较,评价该Cd2+免疫传感器的特异性。
1.3.8 加标回收实验 对自来水样品进行加标回收实验。 将 0.1、1、10 ng Cd2+标准液分别添加到1 mL 自来水中,得到待测样品溶液。 利用上述免疫检测新方法检测Cd2+浓度,计算回收率。
2 结果与讨论
2.1 功能化UCNPs 和功能化AuNPs 的表征
纳米材料的分散性会直接影响到材料的功能化修饰与特异性竞争结合的效果。 由图 2(a)、(c)透射电镜图可看出, 制备的UCNPs、AuNPs 分散性较好,颗粒大小相对均匀,其平均粒径分别为200、13 nm。 如图 2(e)所示,功能化 AuNPs 和功能化UCNPs 顺利组装, 得到UCNPs-AuNPs 复合物的平均粒径为250 nm,且满足FRET 过程空间距离的要求。 材料的水合粒径表征也再次证实了功能化UCNPs 和功能化 AuNPs 的顺利组装,图 2(b)、(d)、(f)分别为功能化 UCNPs、功能化 AuNPs 和 UCNPs-AuNPs 复合物的水合粒径图,材料平均粒径分别为227、60、302 nm,比透射电镜表征结果略大,这是由于DLS 测得的结果是流体动力学直径[17]。

图 2 UCNPs、AuNPs、UCNPs-AuNPs 复合物 的透射电 镜和水合粒径图Fig. 2 The TEM and DLS images of UCNPs,AuNPs and UCNPs-AuNPs nanocomposites
2.2 UCNPs 与 AuNPs 的能量转移
如图3 所示,UCNPs 在 980 nm 激发光照射下的荧光发射光谱在 525、543、659 nm 附近有 3 个吸收峰,分别对应掺杂 Er3+离子2H11/2→4I15/2(绿光区)、4S3/2→4I15/2(绿光区)和4F9/2→4I15/2(红光区)的能级跃迁[18]。543 nm 处的发射峰表明,UCNPs 可作为 FRET体系中的能量供体, 而AuNPs 在520 nm 附近显示出强而宽的吸收带, 可作为能量受体或猝灭剂,且UCNPs 的荧光发射光谱与AuNPs 的紫外-可见光吸收光谱有较好的重叠, 说明UCNPs 和AuNPs 之间能发生FRET 过程。
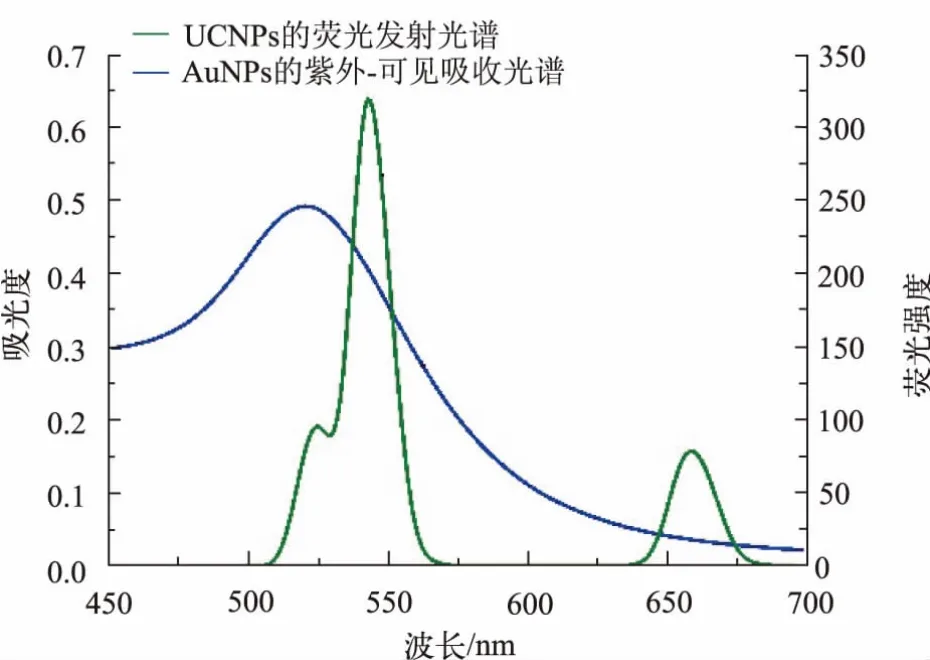
图3 UCNPs 的荧光发射光谱与AuNPs 的紫外-可见吸收光谱图Fig. 3 Fluorescence spectra of UCNPs and UV -vis absorption spectra of AuNPs
2.3 工作曲线与检出限
通过Cd2+与UCNPs-抗原竞争性地结合AuNPs-抗体来抑制FRET 过程,考察不同质量浓度Cd2+对体系荧光强度的影响。 如图4 所示,随着Cd2+质量浓度的增加,543 nm 波长处的荧光强度逐渐提高, 荧光强度与Cd2+质量浓度呈正相关。 如图5 所示, 荧光强度与Cd2+的质量浓度在0.01~10 ng/mL范围内存在线性关系:y=18.771 ln(x)+280.23(R2=0.993 8),检测限为 0.01 ng/mL。如表 1 所示,与检测Cd2+的其他方法比较,该方法的检测限较低,具有一定的优势。
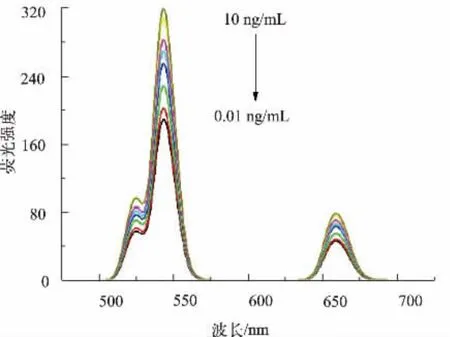
图4 不同Cd2+质量浓度反应体系对应的荧光发射光谱Fig. 4 Fluorescence spectra corresponding to different Cd2+concentrations reaction systems

图5 Cd2+质量浓度与543 nm 处的荧光信号强度的线性关系Fig. 5 Linear relationship between the fluorescence intensity and the Cd2+concentration at 543 nm

表1 几种检测Cd2+的方法比较Table 1 Comparison of several detection methods of Cd2+
2.4 特异性试验
选用 Cu2+、Hg2+、Zn2+、Pb2+、Co2+作为可能存在的共存重金属离子进行特异性实验。结果显示,10 ng/mL的其他重金属元素不能起到恢复反应体系荧光强度的作用,该Cd2+免疫检测方法特异性良好,见图6。

图6 检测不同重金属离子的反应体系在543 nm 处的荧光信号强度Fig. 6 Fluorescence signal intensity of reaction system at 543 nm when different heavy metal ions were detected
2.5 加标回收试验
选用自来水样品进行加标回收实验,结果见表2。 当加标水平为 0.1、1、10 ng/mL 时,回收率分别为109%、98%、101%。
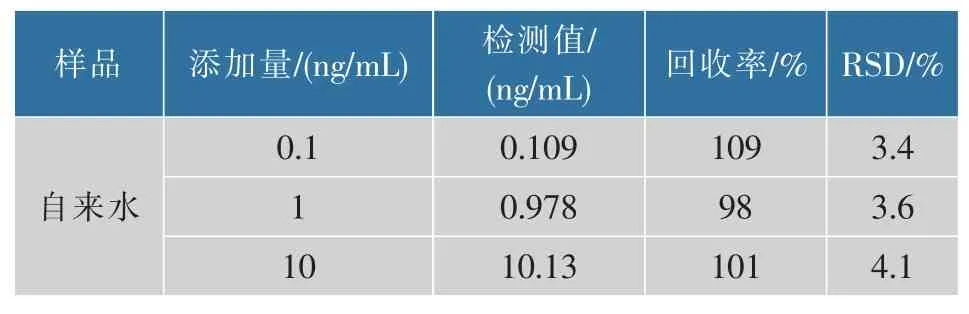
表2 自来水样品中Cd2+的加标回收实验(n=3)Table 2 Recovery results of added standard Cd2+in samples(n=3)
3 结 语
作者基于UCNPs 和AuNPs 间的 FRET 机制和抗原抗体的识别作用建立了一种Cd2+的免疫检测新方法。 体系中的荧光强度信号值与Cd2+质量浓度在0.05~20 ng/mL 的范围内呈线性正相关:y=18.771 ln(x)+280.23(R2=0.993 8),检测限为 0.01 ng/mL。 将该方法用于实际样品分析时可获得较好的回收率,具有操作简便、灵敏度高、成本较低的特点,有望用于水、土壤等环境中Cd2+的快速定量检测。
