红甜菜色素稳定性影响因素研究进展
2021-07-28闫明哲
王 萍 , 闫明哲
(1. 东北林业大学 林学院,黑龙江 哈尔滨 150040;2. 黑龙江省森林食品资源利用重点实验室,黑龙江 哈尔滨150040)
红甜菜色素是红甜菜的次生代谢产物,属生物碱类,可为人体健康带来诸多益处[1]。 在传统医学中,红甜菜色素已被用于治疗便秘、肠胃和关节疼痛、鳞片状头皮屑等疾病[2];现代药理学研究表明,红甜菜色素在动物和人类体内具有抗氧化[3-6]、抗炎[7-9]、减少肥胖[10-12]、降血压[13-15]、降血糖[16-18]、降血脂[19-21]和预防心脑血管疾病[22-24]等生物活性和保健功能[25]。
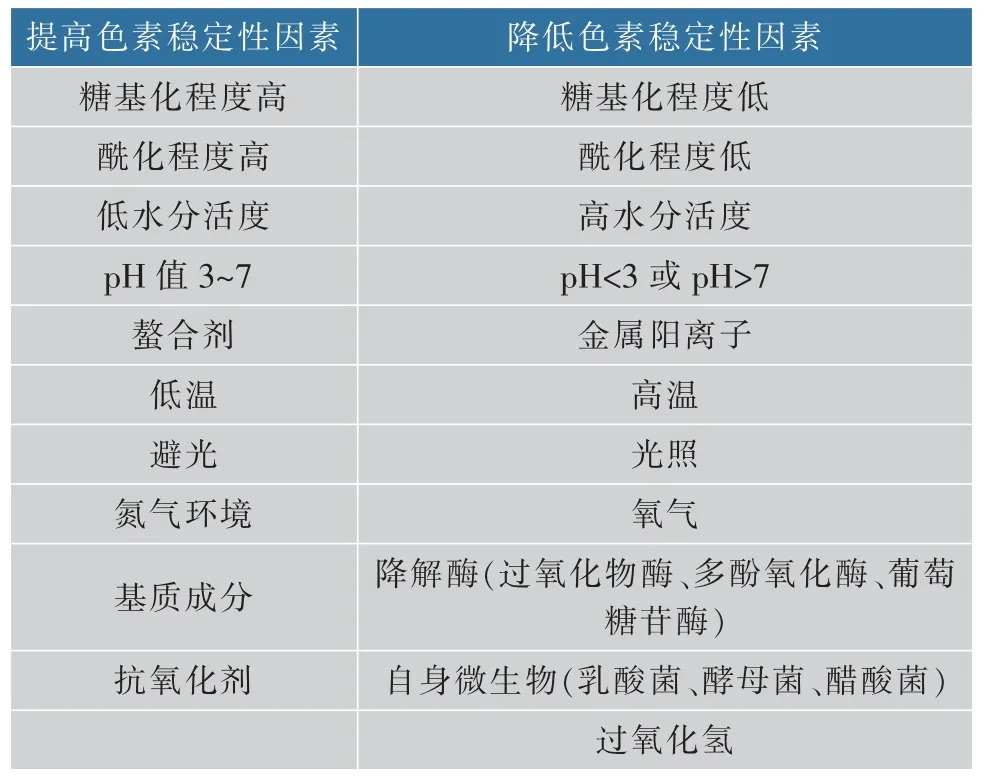
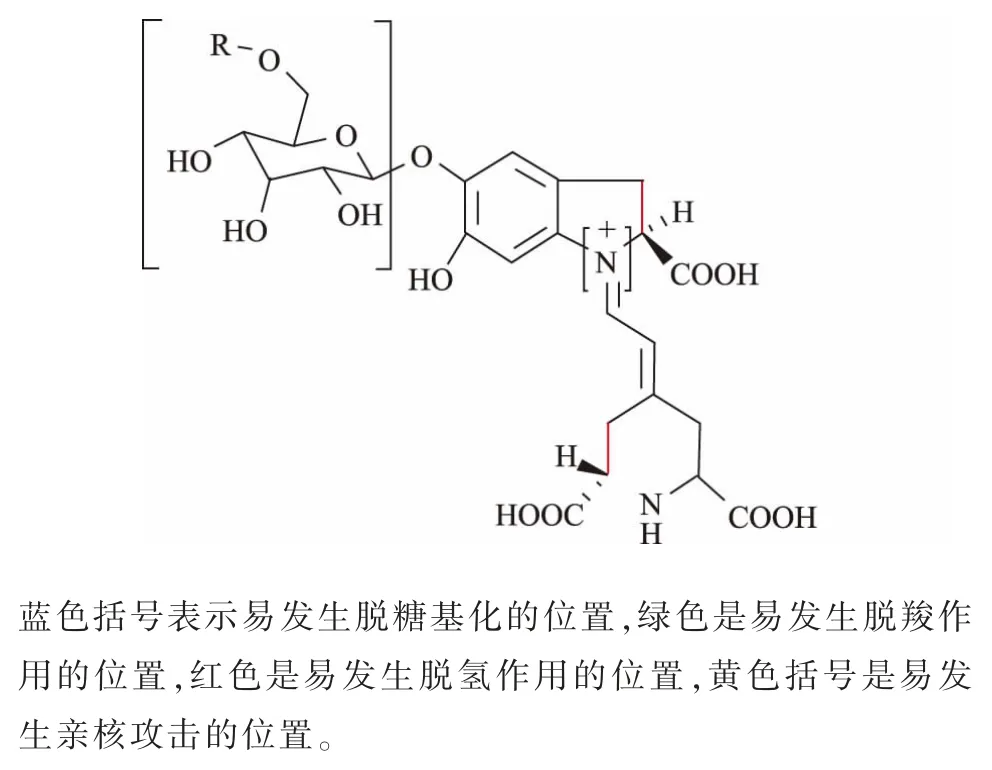
在我国, 甜菜红色素在1987 年被正式列入国家批准允许使用的食用天然色素名录[26]。 红甜菜色素的亲水性使之具有较稳定的pH 值, 在食品工业中常作为低酸[27](5.0 深入研究影响红甜菜色素稳定性因素有助于改善红甜菜色素稳定性, 拓展其应用范围和利用率,为探索增强该类天然色素稳定性的方法和技术手段提供理论依据。 红甜菜色素是一类水溶性含氮色素,不溶于有机溶剂,在细胞质和(或)细胞核中生物合成,贮存于液泡中[32],是红甜菜在生长过程中产生的一类次生代谢物质[33]。 该类色素主要存在于红甜菜[34-35]中,还存在于苋菜[36-37]、仙人掌果实[38-40]、火龙果[41-42]和三角梅属植物的苞片、三尖杉属植物的叶、茎等多种植物结构的表皮和表皮下组织中以及一些真菌中(如毒蝇鹅膏菌)[43-45]。 红甜菜色素是基于甜菜醛氨酸(betalamic acid)与环多巴结合或与氨基酸(或胺)结合的不定共轭物[46],根据其化学结构可分为甜菜红素(betacyanins)和甜菜黄素(betaxanthins)[47],红甜菜色素的一般结构见图1[48]。 图1 红甜菜色素的一般结构Fig. 1 General structures of betalains 甜菜红素和甜菜黄素均属于季胺型生物碱[49],其中以氨基酸或胺为辅基类型的甜菜黄素呈黄色至橙色,糖苷化类型的甜菜红素呈红色至紫色[50]。甜菜色素其核心结构是质子化的 1,2,4,7,7-五取代的 1,7-二偶氮庚甲碱(1,7-diazaheptamethin),该结构负责色度,亦称“发色团”[51],甜菜红素与甜菜黄素颜色的不同是由于发色团所含的共轭双键结构谐振所产生的[52],甜菜色素的共振结构见图2[53-54]。 图2 甜菜色素的共振结构Fig. 2 Sympathetic vibration formula betalains R 和R′可以是氢或芳香族取代基,如果R′与发色团不共振,化合物颜色为黄色,则为甜菜黄素;如果R′与发色团共振,化合物颜色则为红色,即甜菜红素。 根据结构特征,甜菜红素包括甜菜苷和异甜菜苷 (betanin、iso-betanin)、 前甜菜苷及异前甜菜苷(probetanin、iso-probetanin), 占红甜菜色素总质量分数的75%~95%; 甜菜黄素包括仙人掌黄素I、仙人掌黄素Ⅱ(vulgaxanthin I、vulgaxanthin II),占甜菜色素总质量分数的5%~25%[55]。其中,甜菜苷占甜菜红素质量分数的75%~95%[56],仙人掌黄素I 是甜菜黄素的主要部分,甜菜苷、异甜菜苷和仙人掌黄素I占红甜菜色素质量分数的95%以上[57]。 甜菜红素和甜菜黄素的吸收光谱分别为532~550 nm 和457~485 nm[58]。甜菜红素易溶于水,水溶液呈红色至紫红色,难溶于醋酸、丙二醇,不溶于无水乙醇、甘油、丙酮、氯仿、油脂、乙醚等有机溶剂[59]。 与甜菜黄素相比,甜菜红素能被糖基或酰基部分修饰[60],因为甜菜苷配基(betanidin)是大多数甜菜红素(如甜菜苷)的苷元,位于甜菜苷配基C-5 或C-6 的一个或两个羟基的不同取代(糖基化和酰基化)模式生成了不同结构的甜菜红素,大多数是5-O-β-葡萄糖苷,极少数是6-O-葡萄糖苷[61]。 红甜菜色素作为一种天然色素,其稳定性与人工合成色素相比较差, 从而限制了该色素的应用。红甜菜色素稳定性主要受pH 值、光照、温度、氧气和降解酶及微生物等因素影响,具体影响因素见表1[62]。 表1 影响红甜菜色素稳定性的因素Table 1 Factors governing betalains stability 受降低色素稳定性的因素影响,红甜菜中甜菜红素在易降解位置发生脱糖基化、脱羧作用、脱氢作用和亲核攻击(胺键断裂和异构化)等化学变化,具体降解位置见图3[63]。 图3 甜菜红素的易降解位置Fig. 3 Easy degradable position of betacyanins 当发生上述降解反应时,红甜菜中甜菜红素按照相应的途径降解并产生不同的色素结构,使色素颜色由紫红色转变为黄橙色。 红甜菜中甜菜红素(甜菜苷和异甜菜苷)的降解条件、途径和产物见图 4[62,64]。 图4 甜菜苷及异甜菜苷的降解条件、途径和产物Fig. 4 Degradation conditions,pathways and products of betanin and iso-betanin 红甜菜中甜菜色素受pH 值影响, 其降解的活化能随pH 值升高而降低, 在pH 5.0~6.0 时色素较稳定,颜色几乎不会发生改变[65-66]。 研究表明,在25 ℃、pH 5.0 时的甜菜色素溶液稳定性最佳, 其半衰期可达19 d;在4 ℃贮藏时,其半衰期超过1 年[67]。 当pH<3.0 时,红甜菜色素由红色变为紫红色,即甜菜苷C-15 发生异构化或脱氢, 生成异甜菜苷或新甜菜苷,产生红色到紫红色的可见颜色变化[68-69]。红甜菜酶粗提液含有降解酶(β—葡萄糖苷酶、多酚氧化酶、过氧化物酶);在pH 3.4 时,酶粗提液会分解红甜菜色素,对甜菜黄素的脱色活性要强于甜菜红素,这可能是因为降解酶的脱色效果与红甜菜自身所含色素含量有关[70];在pH 4.0 时,甜菜苷和异甜菜苷主要发生脱羧和脱氢反应,分别生成2-脱羧基甜菜苷、2-脱羧基异甜菜苷、17-脱羧基甜菜苷、17-脱羧基异甜菜苷、15-脱羧基甜菜苷和新甜菜苷;在 pH 6.0 时,红甜菜汁经热处理(95 ℃、5 min)使甜菜苷和异甜菜苷的醛亚胺键水解,生成亮黄色的甜菜醛氨酸、 异甜菜醛氨酸和无色的环多巴5-O-β-葡萄糖苷[71-73];当 pH>7.0 时,甜菜苷和异甜菜苷的醛亚胺键水解增强,不仅紫红色颜色强度降低,而且颜色还向黄色方向移动,使色素溶液逐渐变黄[64];当 pH>10.0 时,溶液颜色迅速变黄,是因为甜菜苷在碱性溶液条件下的氢或芳香族取代基与甜菜红素的发色团“1,7-二偶氮庚甲碱”不共振,使色素溶液由红色变为黄色,此时甜菜苷经过脱氢反应生成新甜菜苷[74]。 Mikolajczyk-Bator 等[75]研究了红甜菜色素溶液在加热(90 ℃、30 min)过程中pH 值对色素含量的影响,发现在pH 4.0~9.0 的条件下,随着溶液pH 值的升高, 甜菜色素液中黄色色素的含量随pH 值的升高而增加,而红色色素含量则相反,且pH 6.5 和pH 7.0 时黄色色素含量增加最为明显。研究认为[76],红甜菜色素含量变化的原因是甜菜苷的醛亚胺键水解, 水解产物中的氨基化合物与环多巴5-O-β-葡萄糖苷竞争甜菜醛氨酸,通过氨基化合物与甜菜醛氨酸的结合生成甜菜黄素, 这也是经90 ℃处理后甜菜红素溶液变黄的原因。 此时,因甜菜黄素的形成消耗了部分甜菜醛氨酸,减少了甜菜醛氨酸与环多巴5-O-β-葡萄糖苷结合生成甜菜红素的机会,使甜菜红素含量少于甜菜黄素。 在自然光或者紫外光的条件下,光照可加速红甜菜色素氧化和降解。 甜菜色素的发色团“1,7-二偶氮庚甲碱”吸收了光,电子激发到了更高的能量状态, 导致更高的反应性或更低的分子活化能,降低了甜菜色素分子的稳定性,使甜菜色素降解速度加快[77]。 甜菜红素的稳定性在2 200~4 400 lx 范围内与光强呈负相关[78],经紫外照射120 h 后可完全褪色[79]。 将pH 7.0 甜菜苷溶液置于15 ℃下6 d,观察光和氧的共同作用,光照和氧气分别导致甜菜苷的半衰期缩短了15.6%和14.6%, 二者同时存在使甜菜苷的半衰期缩短了28.6%, 表明在光照时氧气的存在会使甜菜色素降解加快[80]。 学者研究光照对含有不同浓度色素溶液在厌氧条件下的含量变化[81],将pH 5.0 不同浓度的甜菜苷溶液贮存在 25 ℃下50 h,发现在厌氧条件下,单独增加色素浓度对溶液中色素的整体稳定性没有影响。 研究发现,不同光源的光照对甜菜红素溶液的含量也会产生影响[82],将等量甜菜红素溶液分别置于自然光、20 W 紫外灯(30 cm)下8 h 后测得甜菜红素保留率,甜菜红素在自然光比紫外光下稳定,当光照8 h 时,甜菜红素溶液在自然光下的色素保留率在80%以上,紫外光下的色素保留率在50%以上。研究认为[83],甜菜红素光照后易分解,将甜菜红素水溶液置于阳光下10 d,与避光处理的样品相比,色素保留率为74.3%,说明光照对甜菜红素影响较大,应避光保存。 有学者研究了 pH 值[84-86]、氧气[87-88]、光照[89-90]对甜菜色素稳定性的影响,大多强调了温度对色素保留率的重要性,表明高温是导致甜菜色素在贮藏和加工过程中稳定性降低的重要因素。 关于甜菜红素与甜菜黄素结构的稳定性,一些学者[91-93]认为在室温下或加热后,甜菜红素要比甜菜黄素更稳定。 有学者研究了红甜菜片在煮沸后红甜菜色素质量分数的变化,当煮沸处理时间从60、120、180 s逐渐增加时,甜菜红素的质量分数相应减少了6%、22%和51%, 甜菜黄素的质量分数则分别减少了18%、23%和 33%[94]。 将红甜菜在 105、115、125 ℃下处理30 min,观察甜菜红素和甜菜黄素质量分数的变化,结果发现[95],甜菜红素质量分数依次下降了24%、62%和81%, 甜菜黄素下降了 13%、60%和73%, 说明高温导致甜菜红素和甜菜黄素质量分数减少。研究85 ℃下加热8 h 后红甜菜鲜汁颜色的变化,发现鲜汁的色相角由358°偏移至62°,此时溶液由紫红色变为黄橙色[96]。 对加热后的红甜菜汁进行HPLC 和LC-MS 鉴定,发现汁液中含有大量呈黄色的色素新甜菜苷、甜菜苷异构化生成少量红色的异甜菜苷和在C-17 发生脱羧反应生成橙色的17-脱羧基甜菜苷、17-脱羧基异甜菜苷以及在C-15 发生脱羧反应且伴有手性中心损失所生成红色的15-脱羧基甜菜苷。 这5 种化合物是红甜菜汁在热处理过程中发生橙变的原因,且甜菜色素的降解程度随着温度的升高而增加。 通过研究贮藏温度(25、35、45 ℃)对浓缩红甜菜汁中甜菜色素稳定性的影响,结果发现甜菜色素的降解遵循一级动力学模型[97](在红色火龙果汁中甜菜红素的降解[98]、90 ℃下藜麦样品中甜菜色素的降解[99]均遵循一级动力学模型),而L*、a*、b*和C* 值的变化符合零级动力学模型;25 ℃下样品中甜菜红素和甜菜黄素的降解速度慢于其他温度下的降解速度,说明此温度下红甜菜色素较稳定;甜菜红素和甜菜黄素降解的反应速率常数随贮藏温度和时间的增加而增大, 且所有样品中甜菜黄素降解的活化能(Ea为92.04~93.27 kJ/mol)与甜菜红素降解活化能(Ea为 66.07~66.13 kJ/mol)的比较表明,甜菜黄素的热敏感性高于甜菜红素。 将由红甜菜分离得到的甜菜红素和甜菜黄素在90 ℃处理30 min,发现甜菜红素耐热性要比甜菜黄素高,高温处理后甜菜红素损失了13%~15%, 甜菜黄素损失了45%,而甜菜红素的热稳定性是甜菜黄素的3 倍[100]。 红甜菜经高温处理后的颜色变化与红甜菜色素质量分数的关系[101],将红甜菜汁、红甜菜浆和红甜菜整根在120 ℃加热60 min, 发现随着加热时间的增加,样品的红颜色逐渐褪去,整体颜色有不同程度的变黄, 总甜菜色素的质量分数逐渐减少。此外, 还发现红甜菜汁在高温处理后颜色参数L*和b*与红甜菜色素质量分数呈负相关,C*和a*与红甜菜色素质量分数呈正相关;与红甜菜浆、红甜菜整根相比,红甜菜汁中颜色参数L*、a*、C*、b*与红甜菜色素质量分数相关性最高。 高温下甜菜苷的醛亚胺键水解、脱羧和异构化,分别生成亮黄色的甜菜醛氨酸和无色的环多巴5-O-β-葡萄糖苷、红色的15-脱羧基甜菜苷和红色的异甜菜苷, 甜菜色素裂解后的产物继续进行脱氢产生黄色的新甜菜苷等色素苷元[102]。 在加热甜菜色素溶液的过程中,若发现颜色由紫红色变为黄橙色又逐渐变回紫红色,此变化称作甜菜红素的色素再生,这与甜菜苷的醛亚胺键水解有关。Huang 等[103]将pH 5.0 的红甜菜色素溶液在氮气环境90 ℃短时间加热后, 甜菜苷的醛亚胺键水解产物甜菜醛氨酸的醛基与环多巴5-O-β-葡萄糖苷的氨基进行亲核加成完成席夫碱缩合,重新生成甜菜红素,甜菜红素再生现象说明醛亚胺键水解是一个部分可逆反应。 此外,甜菜醛氨酸和环多巴5-O-β-葡萄糖苷的积累增大了甜菜红素再生的反应速率,从而减少了甜菜红素损失的量。 有研究表明,甜菜苷和甜菜苷配基在氧气存在的条件下不稳定,使红甜菜色素及含有该类色素的产品变暗和失去颜色,说明氧气可加速甜菜色素的降解[104-105]。 在有氧气条件下甜菜苷降解动力学遵循一级动力学模型,但在缺氧条件下偏离一级动力学模型[106]。 pH 6.0 的红甜菜汁和pH 6.0 的甜菜红素溶液在90 ℃加热9 min 后红甜菜色素质量分数的变化,结果发现,当在空气中加热时,空气与溶液体积的比值在1.9~12.6 不会影响甜菜红素溶液色素质量分数,其原因可能是加热时间较短;而对于红甜菜汁,加热后的甜菜红素质量分数随着空气体积的增加而降低。 由于样品在加热过程中的晃动,氧气的扩散阻力接近于零,使得氧气与红甜菜汁的接触面积变大, 甜菜苷损失受空气中氧气扩散速率的影响,稳定性随着氧气体积分数的增加呈线性降低[107]。研究发现[108],甜菜苷和甜菜苷配基生成新甜菜苷的原因是空气氧化,此时碱性共轭体系在吡啶和重氮甲烷的影响下脱质子化, 生成的新甜菜苷呈黄色,这也是甜菜色素溶液由紫红色转变为黄色的原因之一。 甜菜苷的降解是一个部分可逆的反应,将红甜菜汁置于完全密闭的容器中 (pH 4.75、20 ℃、130 min),甜菜苷保留率从 54 %提高至 92%[109]。 因此,为了提高甜菜红素再生的色素质量分数,有必要在密闭环境下对色素进行处理,反应可逆性是导致甜菜苷降解偏离一级动力学的原因。 通过比较甜菜苷和甜菜苷配基在氧气存在时的稳定性,发现糖基化结构甜菜苷要比苷元结构甜菜苷配基更稳定,其原因可能是前者具有更高的氧化还原电位,不易发生氧化反应;当甜菜苷被氧气氧化时,可将两个电子转移到O2中生成H2O2,或将O2加到甜菜苷分子上,形成有机过氧化物[110]。 对于红甜菜自身来说, 未经杀菌的红甜菜,降解酶的存在可引起红甜菜色素质量分数及颜色变化,如β—葡萄糖苷酶、多酚氧化酶、过氧化物酶等。 β—葡萄糖苷酶可使甜菜红素的糖苷发生脱糖基化, 生成紫红色的甜菜苷配基和异甜菜苷配基,使红甜菜色素由红色向紫红色转变[111]。 过氧化物酶也可使红甜菜色素分解,与甜菜黄素相比,甜菜红素更易被过氧化物酶分解[112]。 降解酶可促使甜菜苷的异构化和脱氢、脱糖基,使红甜菜色素降解,产生相应的降解产物并积累,利于甜菜红素再生。 红甜菜片经自然发酵后, 甜菜色素质量分数下降了61%~88%[113],这与红甜菜自身所含β-葡萄糖苷酶、多酚氧化酶、 过氧化物酶使红甜菜色素分解有关。除β—葡萄糖苷酶外, 红甜菜携带的乳酸菌类植物源细菌可以利用多种碳水化合物作为碳源, 包括β—葡萄糖苷[114]。Martínez-Parra 等[115]研究发现,红甜菜中甜菜苷和甜菜苷配基氧化后的产物中除甜菜醛氨酸和环多巴5-O-β-葡萄糖苷外, 还含有过氧化物酶,该酶使甜菜苷配基氧化并生成甜菜苷配基自由基,甜菜苷配基自由基经歧化作用生成甜菜苷配基和甜菜苷配基醌。 在过氧化物酶对甜菜苷配基氧化过程中,甜菜苷配基降解速率与底物浓度的关系遵循米氏方程。 在pH 值、光照、温度、氧气和降解酶等因素影响下,红甜菜色素易发生降解反应。 甜菜苷在降解过程中受影响因素的不同可能发生如醛亚胺键断裂、脱氢、脱糖基化、脱羧和异构化等反应,产生不同结构的色素。 根据影响稳定性因素作用程度的不同,红甜菜色素会发生由红色变为紫红色至黄橙色或最终为无色的褪色现象,但在特定条件下可观察到颜色逐渐向红色转变或甜菜红素质量分数上升,即发生了甜菜红素再生。 红甜菜色素在pH 5.0 时最稳定,在pH 5.0~6.0时较稳定,在pH<3.0 时发生由红色向紫红色转变,在pH>7.0 时颜色向黄色转变; 红甜菜及红甜菜色素应进行避光处理, 避免光照引起色素的氧化降解;红甜菜及其色素纯品在4 ℃存放最佳,含有红甜菜色素的产品的贮存温度最佳为25 ℃。 红甜菜色素对热敏感,甜菜黄素的热敏感性要高于甜菜红素,色素降解程度随处理温度的升高而增加,不宜长时间高温处理,避免高温导致的色素损失;甜菜色素受热处理其热降解遵循一级反应动力学,颜色参数 (L*、a*、b*和C*) 的变化符合零级反应动力学;氧气的存在可加速红甜菜色素氧化,在有氧气的条件下甜菜苷的降解动力学遵循一级动力学模型,含有甜菜红素产品进行包装时应在包装内充入氮气,减少氧气与红甜菜色素接触,避免氧气引起色素的褪色;在贮藏和加工过程中还应重视降解酶和微生物引起的色素质量分数和颜色变化,应在适宜的pH 值和温度条件下进行灭酶和灭菌处理,减少因降解酶所引起的色素降解。 针对红甜菜色素及红甜菜产品,在加工、贮藏、运输及销售过程中各个环节下应满足低酸 (pH 在5.0~6.0)、低温、避光和隔氧的条件,还应进行灭酶和灭菌处理。 红甜菜在我国已有多个地区种植,适应环境能力强,经济适用性高,是商业化甜菜色素的主要来源。 未来可从以下方面深入研究以提高红甜菜色素的稳定性:1)甜菜红素酰基化,如阿魏酸、对香豆酸、咖啡酸等可提供酰基化基团与甜菜苷配基分子缔合形成酰基糖苷, 减少醛亚胺键断裂的可能,提高甜菜红素的稳定性;2)甜菜红素包埋技术,应选择适宜的壁材包埋甜菜红素, 有效解决其在热、光照、酸、碱、氧气等不同环境中稳定性差的问题,同时最大限度保留该色素的生物活性;3)甜菜红素再生, 应结合甜菜红素与甜菜黄素的生物合成途径,深入研究甜菜红素再生的特定条件,促使醛亚胺键断裂产生的甜菜醛氨酸与环多巴5-O-β-葡萄糖苷结合生成甜菜苷, 异甜菜醛氨酸与环多巴5-O-β-葡萄糖苷结合生成异甜菜苷,利于维持红甜菜色素在易降解环境中的质量分数并有助于提升色素稳定性;4) 微生物发酵技术提高甜菜红素稳定性,如通过以乳酸发酵为主的发酵技术, 使发酵液的pH值有利于甜菜红素的稳定。 甜菜色素稳定性的研究有助于将其更好、更全面的应用于食品、营养保健品、化妆品、染料等领域,充分发挥其生物活性和潜在的保健价值,逐步减少合成红色素(如胭脂红、苋菜红和赤藓红)的使用,提高红甜菜及甜菜色素的利用率。1 红甜菜色素简介
1.1 红甜菜色素的来源
1.2 红甜菜色素的组成及结构


2 影响红甜菜色素稳定性的因素

2.1 pH 值对红甜菜色素稳定性的影响
2.2 光照对红甜菜色素稳定性的影响
2.3 温度对红甜菜色素稳定性的影响
2.4 氧气对红甜菜色素稳定性的影响
2.5 降解酶对红甜菜色素稳定性的影响
3 展 望
