酿酒酵母XM2-9 流加发酵生产甲基硒代半胱氨酸
2021-07-28洪文荣洪晓明
吴 江 , 洪文荣 , 苏 敏 , 洪晓明
(1. AUCH International Trading Pty Ltd,Sydney,NSW2000,Australia; 2. 莆田学院, 福建 莆田 351100;3. 重庆能源学院医药和营养研究中心,重庆 402260)
甲基硒代半胱氨酸 (Se-methylselenocysteine SeMCys)是一种天然含硒的氨基酸。 它是近年来发现的第21 种氨基酸硒代半胱氨酸的甲基化衍生物[1]。 作为第三代的有机硒化合物,甲基硒代半胱氨酸比硒酵母、硒代蛋氨酸和其他硒代氨基酸具有更好的生物利用度,更强的抗氧化作用[2],以及更强的抗衰老和抗癌生物活性等优点[3-4]。 美国FDA 已经批准了用甲基硒代半胱氨酸作为抗肿瘤化疗试剂进行动物和临床试验[5]。 试验结果表明,甲基硒代半胱氨酸比其他硒化合物在化疗辅助治疗方面效果更好,同时能更有效消除化疗带来的毒性[6]。 目前的临床试验结果表明,化疗时结合甲基硒代半胱氨酸治疗能显著提高肿瘤细胞的杀死率[7]。 在中国,甲基硒代半胱氨酸已于2009 年被卫生部批准为新型营养强化剂[8],并开始广泛应用于食品和保健品等方面。
甲基硒代半胱氨酸最早从植物中分离得到,生长在富硒地区的植物具有积聚甲基硒代半胱氨酸的能力,例如大蒜、洋葱、青花菜[9]、豆科植物[10]、野生的韭菜[11]等植物。 富硒大蒜在提高免疫功能和预防癌症方面有一定的效果,将在含硒培养液中培养的大蒜通过HPLC-ICP-MS 分析, 可检测到其中含有甲基硒代半胱氨酸[12]。1987 年美国FDA 批准了用硒酵母作为无机硒替代物用于动物饲料添加剂以及保健品[13],使得硒酵母发酵的研究和生产进入了新的阶段。 其基本原理是在发酵过程中加入无机硒盐,酵母在繁殖过程中吸收无机硒转化成为有机硒而存储在细胞中成为硒酵母。Schrauzer[14]报道,在酵母发酵过程中,加入硒盐使酵母最终积累有机硒质量分数达3 000 μg/g, 其中硒代蛋氨酸和硒代半胱氨酸含量可达总含量的60% 以上。 Rajashree 和Muthukumar[15]报道了用酿酒酵母突变株采用流加发酵工艺生产硒酵母,最终有机硒质量分数达到3 758 μg/g,发酵液中菌体质量浓度达到32.09 g/L。但是在利用酵母发酵生产有机硒的报道中,绝大多数的硒酵母中含有的有机硒主要成分是硒代蛋氨酸和硒代半胱氨酸的混合物,而这些硒代氨基酸是参与蛋白质合成的,因此这些有机硒需要降解后才能被人体吸收代谢。 Mapelli[16]等为了生产价值更高的甲基硒代半胱氨酸,构建了能够高效表达异质硒代半胱氨酸甲基转化酶的工程酵母菌,通过优化流加发酵工艺,使酵母细胞有机硒质量分数达到1 061 μg/g, 但其中甲基硒代半胱氨酸的质量分数却很低,只有 2.6 μg/g。 Klimaszewska[17]等利用真菌Lentinula edodes生产甲基硒代半胱氨酸,通过液体发酵收获的菌丝体经过萃取后得到120 μg/g 甲基硒代半胱氨酸。 Ogra[18]等通过生物转化的方法阐明了酿酒酵母合成各种有机硒的代谢途径,分析测定了主要硒代氨基酸的含量,发现有微量甲基硒代半胱氨酸生成。 至今为止,通过发酵法生产甲基硒代半胱氨酸的研究鲜有报道。 作者以酿酒酵母突变株XM2-9 为生产菌株,采用双流加补料发酵方式解除了Crabtree 效应, 使得菌体浓度和葡萄糖的产率大大提高。 同时,以亚硒酸钠溶液为单独流加补料,以最佳比硒消耗速率为依据,有效地控制亚硒酸钠的流量,使硒转化率大大提高。 最终得到发酵液的菌体质量浓度为35.6 g/L, 细胞中有机硒质量分数达到4 937 μg/g, 其中甲基硒代半胱氨酸的产量高达8 189 μg/g。
1 材料与方法
1.1 材料
1.1.1 菌种 酿酒酵母Saccharomyces cerevisiaeXM2-9 突变株,由 AUCH Lab 保藏。
1.1.2 斜面和种子培养基 葡萄糖 20 g/L,酵母粉10 g/L,蛋白胨20 g/L,琼脂15 g/L。种子培养基不加琼脂,调至pH 4.5。
1.1.3 分批培养基
1) 低浓度硫培养基:葡萄糖30 g/L,氯化铵4 g/L,磷酸二氢钾3 g/L,七水硫酸镁 0.05 g/L,氯化镁0.85 g/L, 加入20 mL 微量元素母液 (氯化铁 970 mg/L,氯化锌760 mg/L,钼酸钠152 mg/L,氯化钴70 mg/L,氯化锰 78 mg/L)。 加入 20 mL 维生素母液(生物素10 mg/L,泛酸钙120 mg/L,维生素B660 mg/L,肌醇 120 mg/L)。
2) 正常硫培养基:其他成分相同,只改变七水硫酸镁为9.7 g/L。
1.1.4 流加培养基 葡萄糖110 g/L,氯化铵15 g/L,磷酸二氢钾4.3 g/L,七水硫酸镁10.2 g/L,微量元素母液40 mL/L,维生素母液40 mL/L。
1.1.5 亚硒酸钠溶液 亚硒酸钠(Na2SeO3)20 mg/mL(Sigma-Aldrich)。
1.2 方法
1.2.1 发酵罐及其控制 发酵罐是New Brunswick BioFlo 610 自动控制发酵罐,装液体积30 L。发酵温度为35 ℃,溶氧由通气和搅拌转速来调节,通气量为 0.5~0.7 vvm, 搅拌转速为 200~400 r/min。 溶氧(DO)控制在 1~2 μg/g,pH 通过自动流加 30% 的氨水和2 mol/L 盐酸来调节。
1.2.2 葡萄糖和乙醇质量浓度的测定 发酵液中葡萄糖和乙醇的浓度用HPLC 的方法测定[16]并进行了改进,使用Shimadzu HPLC System,用Supelco 分析柱,流动相使用1 g/L H3PO4,流量为0.7 mL/min,温度为50 ℃。
1.2.3 硒质量分数的测定
1) 酵母细胞中硒质量分数的测定: 称取0.5 g干硒酵母粉放入20 mL 试管中,加入5 mL 70% 的浓硝酸混匀。 将试管放入80 ℃烘箱中消化2 h,然后将消化液到入100 mL 容量瓶中, 加入蒸馏水至100 mL。 用原子吸收光谱仪(Perkin Elmer A-Analyst 200)测定,条件是选择元素硒,波长为196.03 nm。
2) 发酵液上清液中总硒质量分数的测定:取10 mL 发酵液,放入离心管中,以5 000 r/min 离心5 min,上清液直接用原子吸收光谱法测定。
3) 发酵上清液无机硒质量分数的测定:发酵上清液无机硒按照甲基蓝还原法测定[19]。
1.2.4 菌体浓度测定 取10 mL 发酵液在5 000 r/min下离心5 min, 去上清液, 用蒸馏水洗涤酵母3 次后,再在5 000 r/min 下离心5 min。 去上清液,将酵母沉淀放入105 ℃烘箱中干燥2 h 至恒质量后称质量。
1.2.5 分批发酵和流加发酵 分批发酵:将培养好400 mL 的摇瓶种子接到装液体积为30 L 的发酵罐中,pH 4.5、35 ℃自动控制进行发酵,溶氧控制在1~2 μg/g。
流加发酵: 在同样发酵罐中先加入10 L 分批发酵培养基,接入种子后,开始分批发酵。 随着菌体的生长,发酵液中残糖质量浓度不断下降至0.1 g/L以下时,开始用流加培养基通入发酵罐,恒速流加量分别控制在F=0.6、0.8、1 L/h,同时亚硒酸钠溶液通过蠕动泵加入发酵罐。 控制发酵液的残糖质量浓度为限制性底物质量浓度。
指数流加发酵:流加培养基的流加量按照下列公式计算:
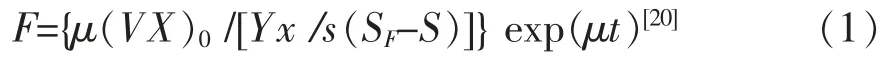
式中:F为培养基流加量,L/h;S为发酵液中葡萄糖质量浓度,g/L;μ 为比生长速率,h-1;V为发酵液体积,L;SF为流加培养基中葡萄糖质量浓度,g/L;Yx/s为菌体细胞对葡萄糖的得率,g/g;(VX)0为流加发酵的初始细胞质量,g。
1.2.6 酵母细胞比生长速率的计算

式中:t1和t2分别表示菌体培养对数生长期时间1和时间 2,min;X1和X2分别表示在t1和t2所对应的菌体质量浓度,g/L。
1.2.7 抑制性底物对比生长速率的影响 在酵母培养过程中,由于亚硒酸钠的毒性对于酵母生长有一定的抑制作用,Andrew[21]提出了菌体生长模型,其比生长速率和亚硒酸钠底物浓度的关系为:
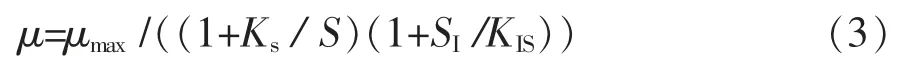
式中:Ks为饱和常数,g/L;KIS为抑制常数,g/L;S为限制性底物质量浓度,g/L;SI为抑制性底物质量浓度,g/L;μmax为无底物抑制的最大比生长速率。
在亚硒酸钠存在的情况下, 如果SI>KIS, 则μ<μmax,菌体的比生长速率显著下降,因此在菌体发酵过程中培养基中的亚硒酸钠要控制在最佳的范围内。
1.2.8 亚硒酸钠溶液流加量 亚硒酸钠流加量以比硒消耗速率为 0.5 mg/(g·h)为依据[22],即

式中:fi为亚硒酸钠流加量,mL/h;V为发酵液体积,L;X为发酵液中菌体质量浓度,g/L。
当亚硒酸钠溶液质量浓度为20 mg/mL 时,亚硒酸钠流加量fi= 0.055VX。
2 结果与讨论
2.1 分批发酵参数的计算和条件优化
2.1.1 初始亚硒酸钠质量浓度对硒酵母生长的影响 当葡萄糖初始质量浓度为30.2 g/L, 无机硒初始质量浓度分别为 0、10.5、30.3、40.2 g/L 时,经分批发酵得到的细胞生长曲线见图1。从图1 可以看出,当培养基中硒质量浓度为零时,细胞生长最快。 随着初始硒质量浓度的增加,菌体的比生长速率逐渐下降,葡萄糖的比消耗速率也逐步下降。 说明无机硒质量浓度越高, 对于菌体生长的抑制越明显,细胞生长符合Andrew 模型。 但是,由于此突变株对无机硒的抗性作用, 即使在初始硒质量浓度达到40 mg/L,细胞仍然保持一定的比生长速率,表1 为分批发酵得到的数据。
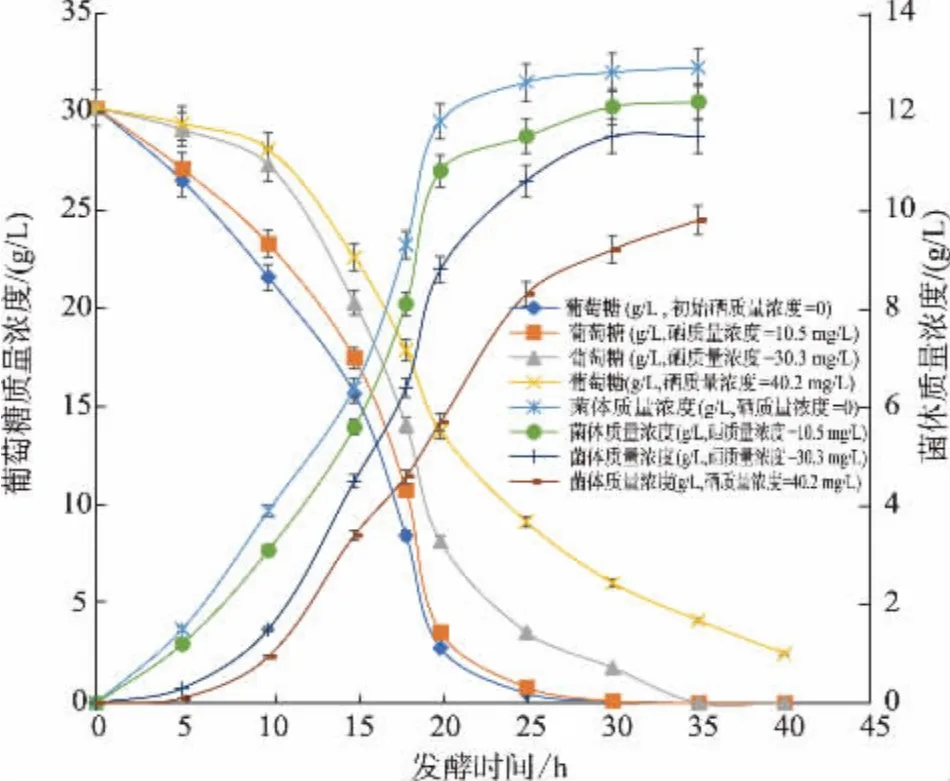
图1 不同初始亚硒酸钠质量浓度下硒酵母XM2-9 的发酵过程Fig. 1 Batch fermentation of S.cerevisiae XM2 -9 in glucose medium with different initial selenium concentrations

表1 不同初始硒质量浓度下酵母发酵过程参数的比较Table 1 Parameters of selenium yeast fermentation with different initialselenium concentrations
实验数据表明, 在不含亚硒酸钠的培养基中,细胞的比生长速率最高,达到μ=0.125 h-1;当培养基中初始硒质量浓度分别为10.5、30.3、40.2 mg/L 时,细胞的比生长速率分别为 0.123、0.117、0.101 h-1,其比生长速率呈下降趋势。 同样地,最终的菌体质量浓度也是随着初始硒质量浓度增加而下降。 实验还表明,随着初始硒质量浓度的增加,最终酵母细胞中有机硒的质量分数也相应增加, 它们分别为766、2 265、3 117 μg/g。 这说明该酵母菌具有很强的无机硒转化能力,但是由于分批发酵后期的营养和无机硒耗尽,菌体出现老化,导致分批发酵难以实现硒酵母高生产强度和高硒转化率的生产要求。显然,只有通过其他的发酵模式才能实现有机硒酵母高产的目标。
2.1.2 培养基中硫酸镁质量浓度对硒酵母发酵的影响 硒和硫在化学性质上具有相似性,但细胞对硫和硒吸收和转化上表现出不同的亲和性。 硫是菌体生长所必需的元素,因此硫质量浓度的大小对菌体生长有一定的影响,同时硫对硒的吸收转化还存在竞争性抑制。 Mapelli[23]认为在硒酵母发酵过程中硫质量浓度达到某一关键点时细胞对硒的吸收会显著下降。
为了考察在低硫质量浓度下是否有利于菌体对无机硒的吸收和代谢,特设定了2 种培养基进行分批发酵,一种是酵母正常生长所需的硫酸根质量浓度3.8 g/L, 另一种为低硫酸根质量浓度0.02 g/L[16],结果见图2。 从 图2 可以看出,低质量浓度硫培养基在开始阶段菌体生长的迟滞期比正常硫培养基延长了2 h 左右, 但是在进入对数生长期后低质量浓度硫培养基的菌体细胞比生长速率逐步接近正常硫培养基的菌体, 它们的比生长速率分别为0.125、0.122 h-1, 最终的菌体质量浓度分别为 12.9、12.5 g/L。为了比较细胞在两种培养基中对无机硒的吸收和转化率的影响,分别在这两种培养基中加入亚硒酸钠,初始质量浓度都为30.3 mg/L。 酵母细胞在两种培养基下无机硒的残留质量浓度和菌体质量浓度随时间的变化曲线见图3。可以看到,在低质量浓度硫培养基中,菌体生长速度稍低于正常硫培养基中菌体生长速度,但是在这两种培养基中菌体细胞对于硒的吸收和比硒消耗速率几乎相同。 表2列出了这两种培养基发酵参数。

图2 在正常硫质量浓度和低硫质量浓度的葡萄糖培养基条件下酵母XM2-9 的发酵过程Fig.2 Batch fermentation of S. cerevisiae XM2-9 in glucose medium with normal and low sulphur concen -trations

图3 在正常硫质量浓度和低硫质量浓度的葡萄糖培养基下硒酵母XM2-9 的发酵过程及其发酵液中残留硒质量浓度的变化Fig. 3 Selenium yeast batch fermentation by S. cerevisiae XM2-9 in glucose medium with normal and low sulphur concentrations
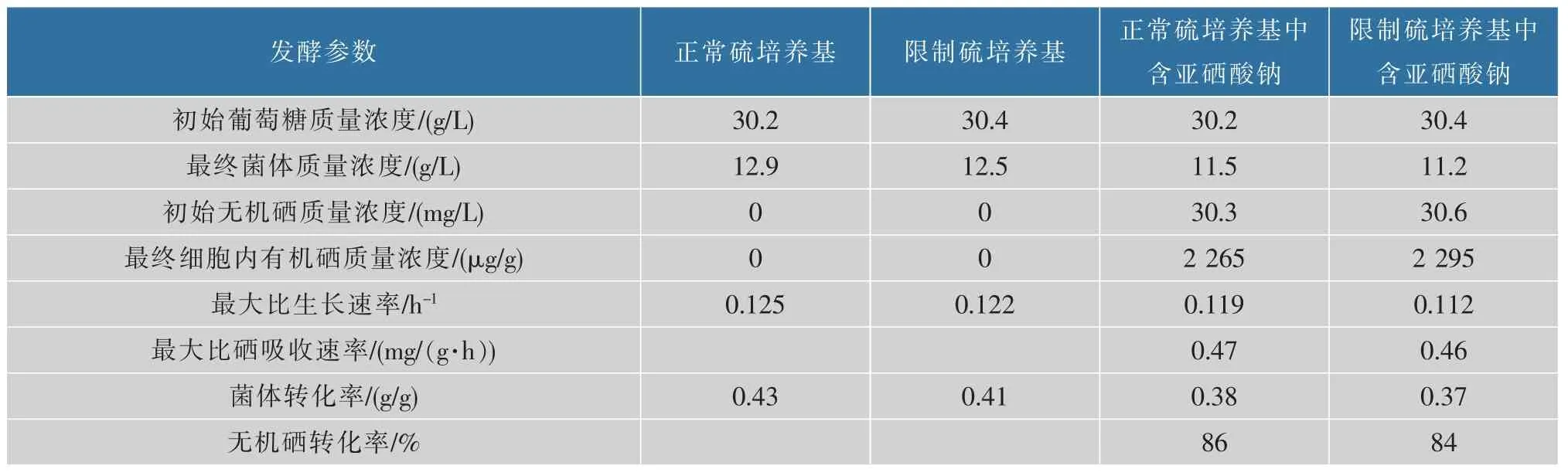
表2 不同初始硫质量浓度下硒酵母发酵过程参数的测定和计算结果Table 2 Determination and calculation of fermentation parameters of selenium yeast with different initial sulphur concentration
由表2 可以看出,在对数生长期,通过计算得到在正常硫培养基下细胞的最大比硒消耗速率为d[cSe]/(Xdt)=0.47 mg/(g·h) 略大于低质量浓度硫培养基下比硒消耗速率0.46 mg/(g·h),表明在此条件下低硫质量浓度对无机硒的吸收和代谢并没有改善。 但是这两个比硒消耗速率数值和Suhajda[22]描述的最佳比硒消耗速率相吻合。 该比硒消耗速率值为后面流加发酵时亚硒酸钠溶液的流量计算提供了理论依据。 实验显示,在这两个硫质量浓度相差比较大的情况下得到了非常相近的比生长速率和比硒消耗速率的数值。 为了证实实验的可靠性,在培养基优化时将硫酸镁质量浓度从0.05 g/L 增加到0.1 g/L, 所得到的比生长速率和比硒消耗速率是一致的。 由此可以推断,在设定的正常硫酸根质量浓度和低硫酸根质量浓度之间酵母的比硒消耗速率是几乎相同的。 实验还证明,菌体生长在正常硫酸根质量浓度下的迟滞期比在低硫酸根质量浓度培养基下迟滞期大大缩短, 更加有利于硒酵母发酵,因此在后面流加发酵实验中用正常硫酸镁质量浓度培养基。
2.2 恒速流加发酵对细胞生长与硒转化的影响
流加发酵在酵母生产和一些初级代谢产物发酵中有广泛应用。 在发酵过程中通过控制培养基流量来减少发酵过程中产生的葡萄糖效应[24],与此同时,流加亚硒酸钠溶液使菌体细胞在生长的同时不断地吸收和代谢无机硒,从而获得高产的甲基硒代半胱氨酸酵母。
在发酵罐中先加10 L 分批发酵培养基,接种后开始间歇发酵。 当发酵液中残糖质量浓度下降至0.1 g/L 以下时,开始流加发酵模式,流加量根据菌体比生长速率μ=0.117 h-1为参考。 初始发酵体积以10 L 计算,当稀释率分别选为D=0.06、0.08、0.1 h-1,则葡萄糖培养基流加量分别为F= 0.6、0.8、1 L/h泵入发酵罐。 同时亚硒酸钠溶液也流加入罐内,流量控制在比硒消耗速率 0.5 mg/(g·h)为佳。 当亚硒酸钠质量浓度为20 mg/mL 时, 无机硒流加量按公式f= 0.055XV计算。 当起始发酵液体积V=10 L、菌体质量浓度X=11 g/L、 亚硒酸钠初始流加量为f1=6.05 mL/h,以此类推,流加量随着发酵液体积和菌体浓度这两个参数的乘积增加而增加。 但是到发酵后期随着菌体细胞的逐步老化,细胞对无机硒的吸收和代谢速率下降,这时无机硒流加量应有所变化。 将比硒消耗速率控制在 0.4 mg/(g·h)以下,同时测定发酵液中残留的无机硒质量浓度,控制发酵液中残留的无机硒质量浓度低于30 mg/L。 图4 显示恒速流加发酵过程中菌体质量浓度和菌体中有机硒质量分数随时间变化的曲线。 发酵结束时分别测定发酵液中菌体质量浓度和酵母中有机硒质量分数等进行物料衡算, 并计算发酵动力学参数,见表3。
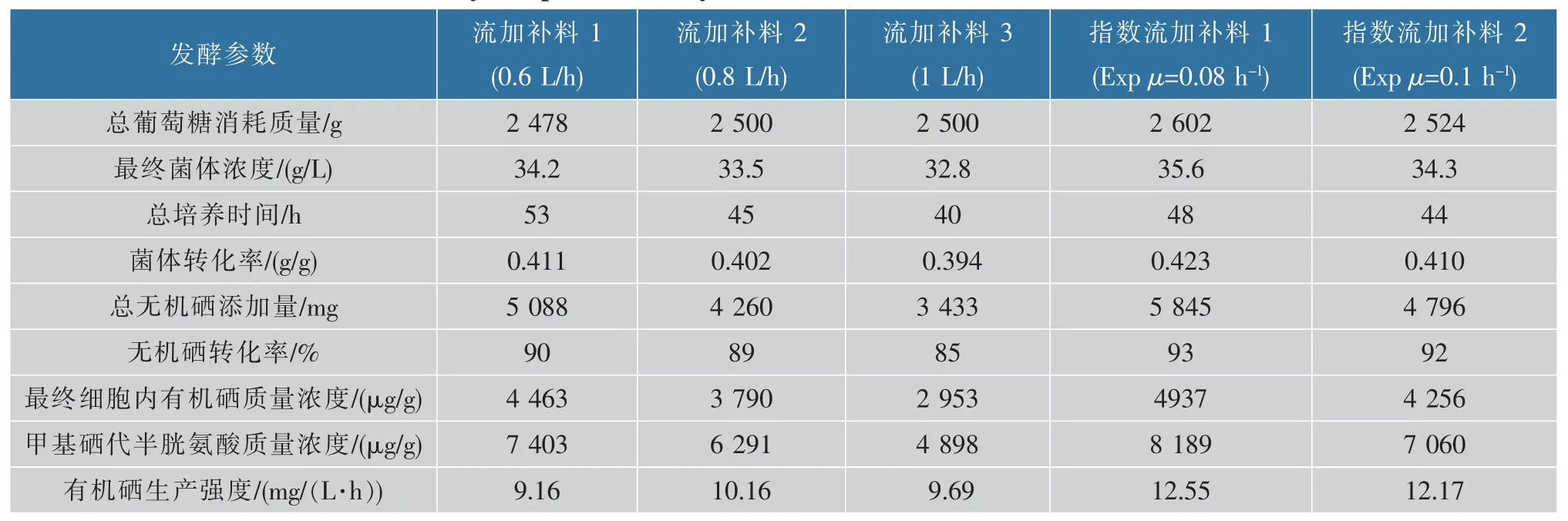
表3 不同流加量下硒酵母流加补料发酵的结果Table 3 Selenium yeast production by fed-batch fermentation under different flow rates
从图4 可以看出, 当葡萄糖培养基流加量为0.6 L/h 时,最终的菌体质量浓度达到34.2 g/L,有机硒质量分数也达到4 463 μg/g,发酵周期较长,有机硒生产强度为9.16 mg/(L·h);当流加量增加到1 L/h时,菌体在较快的比生长速率下繁殖,硒盐的流加量也相应加快,在此流加量下有机硒生产强度提高到9.69 mg/(L·h),但是菌体质量浓度却降低为 32.8 g/L,其有机硒质量分数也降低到2 953 μg/g; 当流加量为0.8 L/h 时, 细胞比生长速率介于前两者之间,菌体细胞对硒的吸收和亚硒酸钠流加量更匹配。 有机硒生产强度高于其他两个流量的有机硒生产强度,达到 10.16 mg/(L·h), 发酵结束时酵母的菌体质量浓度为33.5 g/L,有机硒质量分数达到3 791 μg/g。以上实验结果说明,培养基的流加量与有机硒生产强度有密切的关系,当流加量增加到某一值时,有机硒生产强度达到最大值,这是恒速流加发酵生产有机硒酵母的关键。
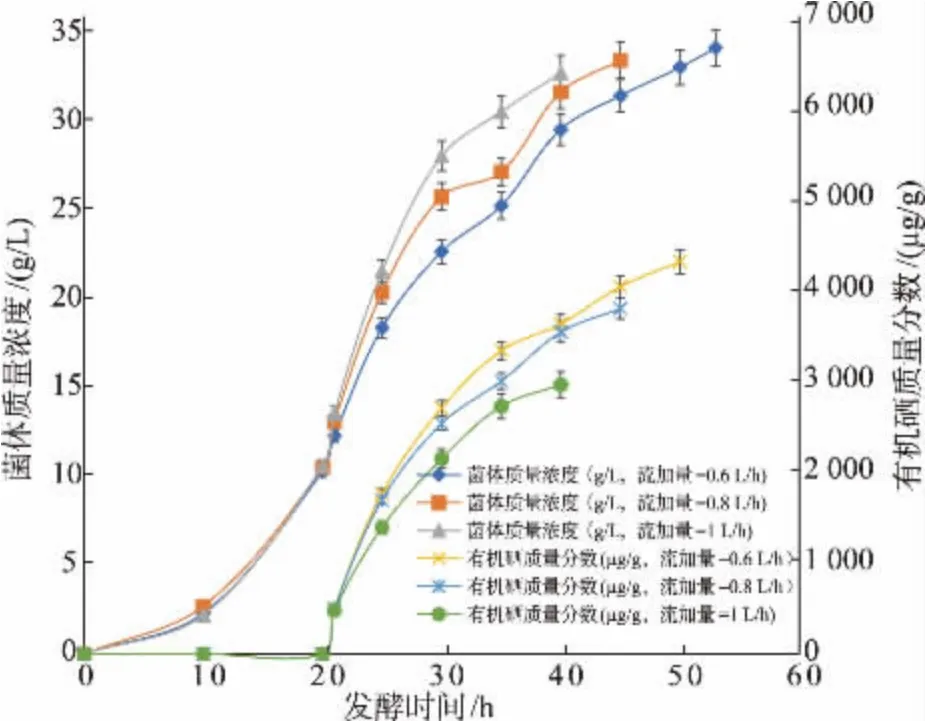
图4 葡萄糖培养基在流加量0.6、0.8、1 L/h 时恒速流加硒酵母发酵过程Fig. 4 Fed-batch fermentation with a constant feeding at different flow rates of 0.6, 0.8 and 1 L/h
2.3 指数流加发酵优化
恒速流加葡萄糖培养基发酵提高了有机硒生产强度和无机硒的转化产率, 但是在流加的初期,由于菌体质量浓度比较低,在高速流加葡萄糖培养基情况下菌体来不及消耗葡萄糖,导致发酵液中残糖不断增加,有少量乙醇的产生,乙醇质量浓度积累至1.0~1.5 g/L, 从而影响细胞比生长速率和最终的葡萄糖产率。 为了消除残糖的积累,设计了指数流加方式进料。 根据指数流加公式,分别设定了两个比生长速率μ1=0.08 h-1和μ2=0.1 h-1来计算相对应指数流加速率。
1) 根据公式计算, 首先设定参数 μ1=0.08 h-1、V0=10 L、X0=11 g/L、Yx/s=0.42 g/g、SF=110 g/L。计算得到初始进料时的流量为F0=0.19 L/h,1 h 后流量增加为F1=0.22 L/h,以此类推一直进料28 h,总进料为20. 93 L。同时亚硒酸钠溶液流加进料,流量控制在比硒消耗速率 0.5 mg/(g·h), 计算方法和恒速进料一样。
2) 再选取 μ2=0.1 h-1, 其他参数与计算方法同(1)来进行指数流加速率计算。
图5 显示这两批指数流加发酵的结果。 当葡萄糖培养基流加量以设定的μ1=0.08 h-1指数流加时,有机硒生产强度增加到 12.55 mg/(L·h)。 指数流加发酵的有机硒生产强度比恒速流加发酵提高了19%,酵母中有机硒的比例增加了23%。这是因为从指数流加发酵开始,发酵液中葡萄糖基本上被消耗掉,转化成菌体,并且细胞一直维持较高的比生长速率,年轻菌体使得细胞的平均比硒消耗速率大于恒速流加的比硒消耗速率,结果最终的有机硒质量分数大幅度提高。
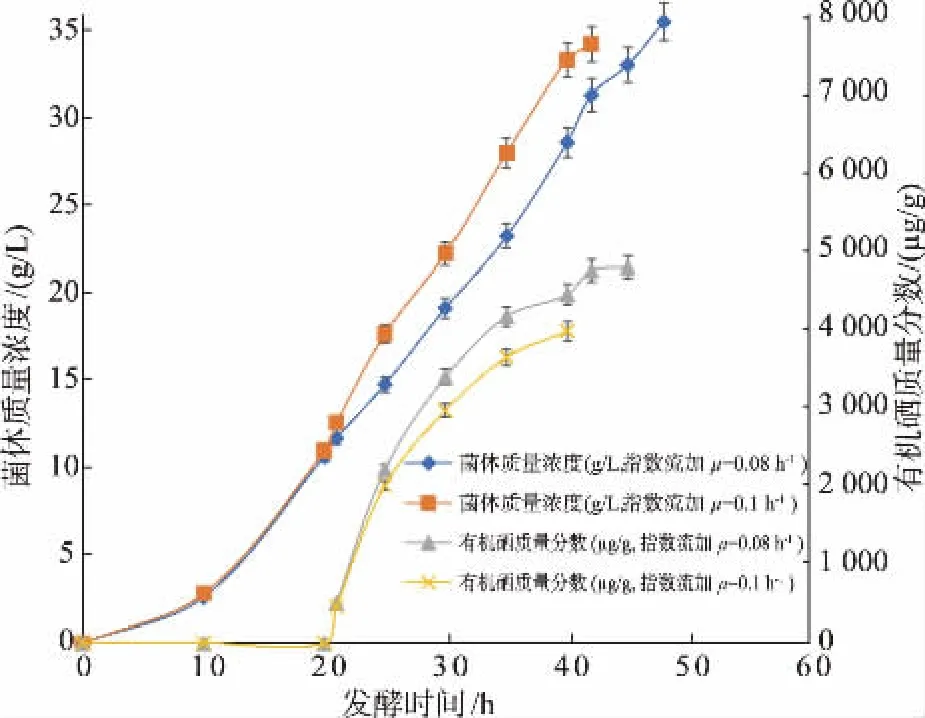
图5 葡萄糖培养基在设定的μ=0.08、0.1 h-1 时指数流加硒酵母发酵过程Fig.5 Fed-batch fermentation with an exponential feeding at different flow rates set at μ=0.08 h-1 and μ=0.1 h-1 respectively
当葡萄糖培养基流加量以设定的μ2=0.1 h-1指数流加时,有机硒生产强度达 12.17 mg/(L·h)。但在实际操作时,发酵液中残留无机硒有时瞬间升高导致对菌体的抑制作用以及发酵中后期的菌体部分老化,实际上平均比生长速率下降为0.083 h-1,低于0.1 h-1理论值。 通过比较发现,以设定的μ1=0.08 h-1指数流加的发酵结果最优。
2.4 硒酵母有机硒代谢产物的测定结果和分析
通过指数流加发酵试验后,分别得到两个批次的硒酵母菌体,经过洗涤和干燥得到酵母粉。 对这两个样品的有机硒成分做了检测,结果见表4。
从表4 可知, 硒酵母中99% 以上是有机硒,其中甲基硒代半胱氨酸(SeMCys)占总有机硒的72%左右,硒代蛋氨酸(SeMet)占 21%~22%,大约 5%~6%余下的有机硒为各种硒代糖类。 研究认为[25],培养基中亚硒酸钠和酵母细胞膜上特异配体结合形成复合体,通过转运离子通道并穿过细胞膜进入细胞内。 在细胞内亚硒酸钠经过一系列代谢途径合成重 要 的 中 间 代 谢 物 Selenocystathionine。Selenocystathionine 在 cystathionine-γ-lyase 作用下形成硒代半胱氨酸,这时硒代半胱氨酸在硒代半胱氨酸甲基转化酶作用下产生甲基硒代半胱氨酸。 由于S. cerevisiaeXM2-9 突变株的 synthase γ-glu-Cys 酶失活, 所以形成的甲基硒代半胱氨酸不能继续向下合成γ-glu-SeMetCys,从而导致甲基硒代半胱氨酸积累在细胞内。 因为甲基硒代半胱氨酸不是合成蛋白质的氨基酸, 只能存储在细胞的液泡中,这样酵母突变株利用这一代谢机制将亚硒酸钠转化为甲基硒代半胱氨酸,从而有效降低了亚硒酸钠对细胞的毒性。

表4 硒酵母中有机硒代谢物的测定结果Table 4 Determination of organic selenium metabolites in selenium yeast product
通过上述分析发现,硒代半胱氨酸甲基转化酶是合成甲基硒代半胱氨酸的关键酶。 Mapelli[16]为了生产甲基硒代半胱氨酸,构建了能够高效表达异质硒代半胱氨酸甲基转化酶的工程酵母菌,虽然转化的酵母细胞能产生一定量甲基硒代半胱氨酸,但是质量分数却很低,只有2.6 μg/g。 其原因是合成的甲基硒代半胱氨酸已部分代谢成其他的中间产物,而不是积累在细胞内。 Klimaszewska[17]等利用真菌Lentinula edodes生产甲基硒代半胱氨酸,通过不断提高培养基中亚硒酸钠的质量浓度来驯化菌体对无机硒的抗性,同时优化发酵条件,使驯化后菌体的有机硒质量分数比出发菌株大幅度提高。Lentinula edodes液体发酵得到的菌体质量浓度为10 g/L, 菌体中甲基硒代半胱氨酸质量分数为120 μg/g,硒代蛋氨酸为672 μg/g。虽然含甲基硒代半胱氨酸的真菌Lentinula edodes具有潜在的食品保健功能,但是远不能达到作为工业化生产甲基硒代半胱氨酸的要求。 与上述的研究相比,本研究在甲基硒代半胱氨酸生产强度和有机硒质量分数方面有了很大的突破。
3 结 语
首先采用分批发酵,在葡萄糖培养基中加入不同初始质量浓度的亚硒酸钠进行发酵对比,确定了硒酵母在各种培养基中的最大比生长速率。 然后考察培养基中硫酸镁质量浓度对发酵的影响,并确定酵母细胞在有机硒转化过程中最佳比硒消耗速率。在此基础上, 首次采用双流加发酵工艺生产硒酵母。 通过比较发现,葡萄糖培养基采用指数流加供料为最佳, 使细胞处于较高的比生长速率下繁殖。与此同时,建立独立的亚硒酸钠流加系统,进料速度控制在比硒消耗速率 0.5 mg/(g·h)左右。 用数学模型对两种流加速率进行优化控制,并以有机硒生产强度为优化指标,最终的硒酵母发酵取得了最佳结果。 以设定的比生长速率μ1=0.08 h-1指数流加葡萄糖时,有机硒生产强度达到最高值12.55 mg/(L·h),菌体最终质量浓度达到35.6 g/L, 酵母中有机硒质量分数高达4 937 μg/g,其中,更有价值的甲基硒代半胱氨酸质量分数达到8 189 μg/g。 通过优化取得了在高有机硒生产强度条件下生产甲基硒代半胱氨酸的目的。
