限制性内切酶NcoI 的高效重组表达、硒代与结晶条件初步筛选
2021-07-28陈晓雨邵钰晨杨雪丽李婷婷
程 艺 , 马 超 , 陈晓雨 , 邵钰晨 , 王 潇 ,杨雪丽 , 苏 蓉 , 李婷婷 *
(1. 江苏海洋大学 江苏省海洋药物活性分子筛选重点实验室, 江苏 连云港 222005; 2. 江苏省海洋生物产业技术协同创新中心,江苏 连云港 222005)
限制性核酸内切酶(简称“限制酶”)是现代基因工程中最基础的一大类工具酶[1]。 天然来源的限制酶往往具有星号活性(即在非理想条件下限制酶的专一性发生改变)较强、反应缓冲体系不一致等缺陷,所以研究者对限制酶的研究和改造一直没有停止[2]。 不同限制酶之间的序列同源性很低,基本无法通过同源序列分析来确定核心催化位点,因此解析限制酶蛋白质的三维结构和阐明限制酶的分子机制对后续定向改造具有重要的指导意义[3-4]。 然而,尽管目前已经发现了数千种限制酶,被商业化应用的限制酶也达到300 种左右,但迄今为止仅有50 余种限制酶的三维结构得到解析[5-8]。
大多数限制酶蛋白质相对分子质量小于70 000,适合采用X 射线晶体衍射法解析三维结构[9-10]。 由于限制酶具有切割DNA 的特性, 在对其进行重组表达时往往会使宿主DNA 被切割, 造成宿主菌的死亡,因此需要利用该限制酶对应的甲基化酶对宿主DNA 进行保护, 从而获得重组限制酶的大量表达[11]。 另一方面,由于限制酶彼此之间序列同源性低,无法参考已有的限制酶晶体结构,使用分子置换法来推算晶体衍射的相位,只能采用同晶置换法或反常散射法[12]。 同晶置换法需要制备大量蛋白质晶体来摸索制备重原子衍生物的浸泡条件。 反常散射法在重组表达时制备蛋白硒代衍生物,通过在多个波长下收集硒原子边缘的反常散射及其附近的衍射数据,从而推算晶体衍射相位[13-14]。 虽然硒元素对蛋白质的诱导及稳定性均会产生不同程度的影响,硒代的效率也受诸多因素干扰[15],但由于其操作方便,研究时会首先选择反常散射法。 目前在大肠杆菌中表达硒代蛋白可以选择甲硫氨酸缺陷型表达菌株,或者阻断甲硫氨酸合成通路,利用外源硒代甲硫氨酸获得硒代蛋白。
NcoI 是一种来源于珊瑚诺卡氏菌Nocardia corallina的Type II 类限制酶, 是常用的限制酶之一,迄今为止尚未有三维结构和分子机制相关的报道。 作者利用大肠杆菌表达系统,重组表达了野生型NcoI 蛋白质和硒代NcoI 蛋白质, 并尝试以坐滴法筛选晶体生长条件,为下一步解析NcoI 的三维结构、阐明其分子机制和定向改造提供基础。
1 材料与方法
1.1 材料与仪器
BL21 (DE3)pLysS、B834 (DE3)pLysS 和 pET-28b 质粒载体: 购自武汉淼灵生物科技有限公司;λDNA、无缝克隆试剂盒等分子生物学试剂:购自莫纳 (武汉) 生物科技有限公司;Ni 亲和层析基质(Toyopearl AF):购自东曹(上海)生物科技有限公司;UniGel-80Q:购自江苏纳微生物科技有限公司;HiLoad 16/60 Superdex 75pg 凝胶过滤预装柱:购自美国GE 公司;蛋白胨、酵母粉、琼脂糖:购自美国Thermo Fisher Scientific 公司;蛋白质结晶条件筛选试剂盒:购自美国Hampton Research 公司;其余化学试剂均为国药分析纯。JN-02 细胞高压破碎仪:购自广州聚能生物科技有限公司;Beckman Avanti J-26s XP 离心机:购自 Beckman 公司;Invitrogen Qubit 4 荧光计:购自 Thermo Fisher Scientific 公司;恒温晶体生长拍照仪:购自美国Formulatrix 公司。
1.2 方法
1.2.1NcoI 重组蛋白的载体构建 编码II 型限制性内切酶NcoI 的基因序列(UniProt ID:O85489)和甲 基 化 酶NcoIM 的 基 因 序 列 (UniProt ID:A0A077QMR0)经人工合成,同时克隆至一个目标载体pET-28b。 将重组质粒pET28b-NcoI 通过热激转化法分别导入 BL21 (DE3) pLysS 和 B834(DE3)pLysS 感受态细胞。 因为pET-28b 载体上带有卡那霉素的抗性基因, 而两种表达菌株 BL21(DE3)pLysS 和 B834(DE3)pLysS 均自带氯霉素抗性基因,所以经卡那霉素和氯霉素双抗性LB 平板筛选,获得NcoI 重组表达菌株 BL21 (DE3) pLysS-NcoI 和B834(DE3)pLysS-NcoI。
1.2.2NcoI 重组蛋白及其硒代蛋白的发酵NcoI重组蛋白的发酵:菌株 BL21(DE3) pLysS-NcoI 接种在LB 培养基中,经活化和扩大培养至OD600nm为0.6~0.8,分别于 16、37 ℃加入 IPTG 诱导表达,IPTG浓度分别为0.1、0.5、1.0 mmol/L 进行最佳表达条件优化。硒代NcoI 重组蛋白的发酵:菌株BL21(DE3)pLysS-NcoI 或者 B834 (DE3)pLysS-NcoI 在过渡培养基(LB 培养基与M9 培养基比例为2∶8)中扩大培养至OD600为 0.6~0.8,后转移菌体至M9 培养基中,补加硒代甲硫氨酸至质量浓度为0.05 g/L,在37 ℃适应性培养 15 min, 于 16 ℃加入 IPTG(0.5 mmol/L) 诱导表达 16 h。 菌株 BL21(DE3)pLysS-NcoI 在过渡培养基中扩大培养至OD600为0.6~0.8, 后转移菌体至 M9 培养基中, 补加苯丙氨酸、苏氨酸、赖氨酸、缬氨酸、亮氨酸和异亮氨酸至各质量浓度为0.1 g/L, 硒代甲硫氨酸0.05 g/L,在37 ℃适应性培养 15 min, 于 16 ℃加入 IPTG(0.5 mmol/L)诱导表达 16 h。
1.2.3NcoI 重组蛋白及其硒代蛋白的分离纯化收集发酵菌体,用裂解缓冲液(25 mmol/L Tris-HCl,pH 8.0,300 mmol/L NaCl) 重悬菌体并进行高压破碎,然后在 4 ℃下于14 000 r/min 离心30 min,收集上清液。 上清液经镍亲和层析法初步纯化后,进行SDS-PAGE 验证是否有目的蛋白质表达条带,然后用阴离子交换层析柱UniGel-80Q 进一步纯化。 最后蛋白质经HiLoad 16/60 Superdex 75pg 凝胶过滤预装柱分离,收集相应组分浓缩,进行SDS-PAGE验证。 蛋白质质量浓度由Invitrogen Qubit 4 荧光计精准测定。 整个纯化过程需要低温环境。
1.2.4NcoI 蛋白及其硒代蛋白的质谱检测 采用Agilent 6530 精确质量四极杆飞行时间(Q-TOF)液质联用系统 (美国 Agilent Technologies 公司)对NcoI 重组蛋白(1.5 mg/mL)和其硒代蛋白(1.5 mg/mL)进行分析鉴定。 HPLC 分离条件: 使用 Agilent Zorbax C18 色谱柱, 流动相是V乙腈∶V水∶V甲酸为2.0∶98.0∶0.1,柱温 40 ℃,流量 1 mL/min,进样量20 μL。 质谱检测条件:电喷雾正离子扫描(ESI+),离子源温度325 ℃,毛细管电压3.5 kV,每隔0.33 s采集一次图谱,质量扫描范围m/z为680~1 140。 质谱检测由中国科学院武汉物理与数学研究所完成。
1.2.5NcoI 蛋白及其硒代蛋白的酶活检测 取NcoI 蛋白(10 μg/μL)和硒代蛋白(10 μg/μL)各1 μL,均以 0.3 μg λDNA 为底物,使用 CutOne 缓冲液(莫纳(武汉)生物科技有限公司)配制成20 μL反应体系,37 ℃温育15 min, 随即高温失活,1 g/dL琼脂糖凝胶电泳检测底物的酶切结果。
1.2.6NcoI 蛋白及其硒代蛋白结晶条件初筛 利用坐滴法对10 种蛋白质结晶条件筛选试剂盒(Crystal Screen HR2-112、Crystal Screen Lite HR2-128、Crystal Screen HR2-110、Crystal Screen 2 HR2-112、Index-HR2-144、StatRx-HR2-107、SaltRx 2-HR2 -109、Natrix -HR2 -116、PEGRx1 -HR2 -082、PEGRx2-HR2-084)进行初筛。NcoI 重组蛋白(纯度>95%)浓缩至10 mg/mL,将蛋白质溶液与结晶试剂按1∶1 比例混合,置于20 ℃恒温晶体生长拍照仪中,每隔12 h 拍照记录晶体生长情况。
2 结果与分析
2.1 重组表达载体构建
限制性内切酶NcoI 特异性识别和切割CCATGG 位点,因此在大肠杆菌中重组表达会严重损害宿主DNA。 为避免重组表达的NcoI 蛋白质对宿主的伤害, 同时表达了NcoI 的甲基化酶(NcoIM), 可以识别并甲基化NcoI 的切割位点,被甲基化的DNA 特异性识别位点受到保护, 从而避免限制性内切酶的切割。在载体pET-28b 上同时构建了NcoI 编码基因和NcoIM 编码基因,NcoI 编码基因N 端带有6×His 标签序列,见图1。将构建成功的 pET-28b(+)-NcoI 重组质粒转化到大肠杆菌BL21(DE3)pLysS 以及甲硫氨酸缺陷型菌株B834(DE3)pLysS 感受态细胞中,筛选阳性克隆,提取质粒,经测序确定序列正确后,进行诱导表达。

图 1 pET-28b(+)-NcoI 质粒图谱Fig. 1 Schematic map of pET-28b(+)-NcoI plasmid
2.2 NcoI 重组蛋白的表达和纯化
将构建成功的重组表达质粒通过热激转化法导入 BL21(DE3)pLysS 感受态菌株中,然后涂布于卡那霉素和氯霉素双抗性的LB 平板上,37 ℃下倒置培养12 h 后,随机挑选若干单克隆进行目的蛋白质的小量表达试验。 通过构建的重组蛋白质的氨基酸序列预测蛋白质的相对分子质量,限制性内切酶NcoI 重组蛋白质的相对分子质量为34 500,SDSPAGE 检测不同条件下蛋白质的表达情况及表达量。 结果显示,NcoI 重组蛋白在 16 ℃、0.5 mmol/L IPTG 诱导表达时能获得最多的可溶性蛋白质,且蛋白质大小与预期一致,后续以此条件进行蛋白质的大量表达,见表1。
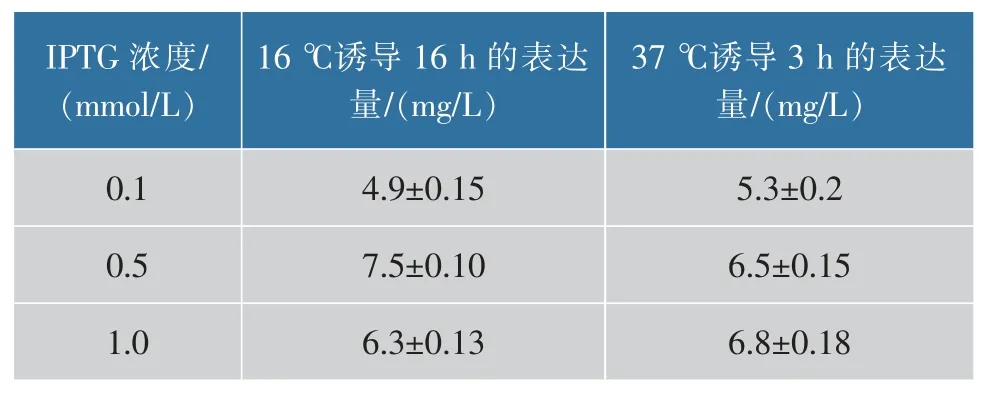
表1 不同诱导条件下每升发酵产物NcoI 重组蛋白的表达量Table 1 Expression of recombinant protein NcoI per liter of fermentation product under different induction conditions
破碎后菌液上清液通过镍亲和层析后,经SDS-PAGE 分析,目的蛋白质存在于200 mmol/L 咪唑洗脱组分中,纯度约80%,见图2(a)。将含有目的蛋白质的组分进行透析除去咪唑,样品通过阴离子交换层析柱UniGel-80Q 得到了纯度约90%的目的蛋白质,见图2(b)。 浓缩样品后通过分子筛凝胶层析和SDS-PAGE 进行分析,所收集目的蛋白质的纯度超过95%,满足蛋白质结晶生长条件,见图2(c)、(d),纯化后重组NcoI 酶质量浓度约为7.5 mg/L。

图2 重组NcoI 的表达与纯化Fig. 2 Expression and purification of NcoI
2.3 NcoI 硒代蛋白的表达和纯化
最常用硒代蛋白培养方法是利用甲氨酸缺陷型菌株,在培养基中引入硒代甲硫氨酸来置换重组蛋白质中的甲硫氨酸,其中大肠杆菌常用甲硫氨酸缺陷型菌株是B834[16]。 因此,作者先尝试将构建成功的重组表达质粒转化导入B834(DE3)pLysS 感受态菌株中,并进行目的蛋白质的小量表达试验。 经SDS-PAGE 检测, 未发现NcoI 重组硒代蛋白 (Se-NcoI)的表达条带,见图 3(a)。 该实验表明,甲硫氨酸缺陷型菌株B834 不适合同时表达NcoI 重组蛋白和NcoIM 重组蛋白。 另外尝试利用表达NcoI 重组蛋白的相同菌株 BL21(DE3) pLysS-NcoI,仅在发酵过程中添加了硒代甲硫氨酸、异亮氨酸等多种氨基酸,期望在抑制大肠杆菌甲硫氨酸本底合成的同时可以更好地利用外源硒代甲硫氨酸,从而获得硒代NcoI(Se-NcoI)蛋白质。 对发酵产物的细胞裂解液进行SDS-PAGE 凝胶电泳检测, 发现NcoI 重组硒代蛋白可以高效表达,Se-NcoI 蛋白质经过3 个纯化步骤:Ni 亲和层析、 阴离子交换层析和分子筛凝胶层析,纯度超过95%,Se-NcoI 蛋白酶质量浓度约为 6 mg/L,见图 3(b)、(c)。

图3 重组Se-NcoI 的表达与纯化Fig. 3 Expression and purification of Se-NcoI
重组蛋白的表达过程对外源添加的硒代甲硫氨酸的利用存在一定的概率,而且硒代甲硫氨酸对于大肠杆菌具有一定的毒性[17],然而结果表明NcoI重组蛋白和Se-NcoI 蛋白酶浓度差别不大, 因此需要测定Se-NcoI 蛋白质中硒代甲硫氨酸的取代率。
2.4 重组NcoI 蛋白质及其硒代蛋白的质谱检测
利用飞行质谱实验, 对重组NcoI 蛋白和Se-NcoI 蛋白进行相对分子质量测定, 从而检测Se-NcoI 蛋白质中甲硫氨酸是否被硒代甲硫氨酸取代。对重组NcoI 蛋白和Se-NcoI 蛋白进行质谱检测,见图4。 将所得数据按照如下公式计算出蛋白质相对分子质量。

式中:X1与X2为相邻的质荷比,且X2>X1。
经计算,重组NcoI 蛋白相对分子质量为34 510,与NcoI 理论相对分子质量 34 500 相符。 重组Se-NcoI 蛋白相对分子质量为34 744,与NcoI 蛋白质的相对分子质量差为234。 已知硒元素相对原子质量为78.96,硫元素相对原子质量为32.065,因此平均每分子Se-NcoI 蛋白质中被硒原子取代的硫原子数量为 234/(78.96-32.065)=4.99。 由于重组NcoI蛋白质的氨基酸序列中含有5 个甲硫氨酸,每个甲硫氨酸残基包含1 个硫原子,可以推测本批Se-NcoI蛋白质中的甲硫氨酸已经全部被硒代甲硫氨酸取代,适合进行后续的反常散射实验。
2.5 NcoI 蛋白质及其硒代蛋白的酶活检测
在获得重组NcoI 以及Se-NcoI 蛋白质之后,分别对其进行酶活力检测,以验证硒代蛋白是否与野生型蛋白质具有相同的生物学功能。 分别用10 μgNcoI 和 10 μg Se-NcoI 蛋白对 0.3 μg λDNA 进行15 min 快速酶切。 琼脂糖凝胶电泳均能显示出明显的特征酶切条带,见图 5(a)。 这与 Thermo Fisher 公司网址中公布的NcoI 特征酶切条带相似, 见图5(b),表明被完全硒代的Se-NcoI 蛋白质与野生型蛋白质具有相似的生物学活性,即硒代并不影响NcoI蛋白质的结构。
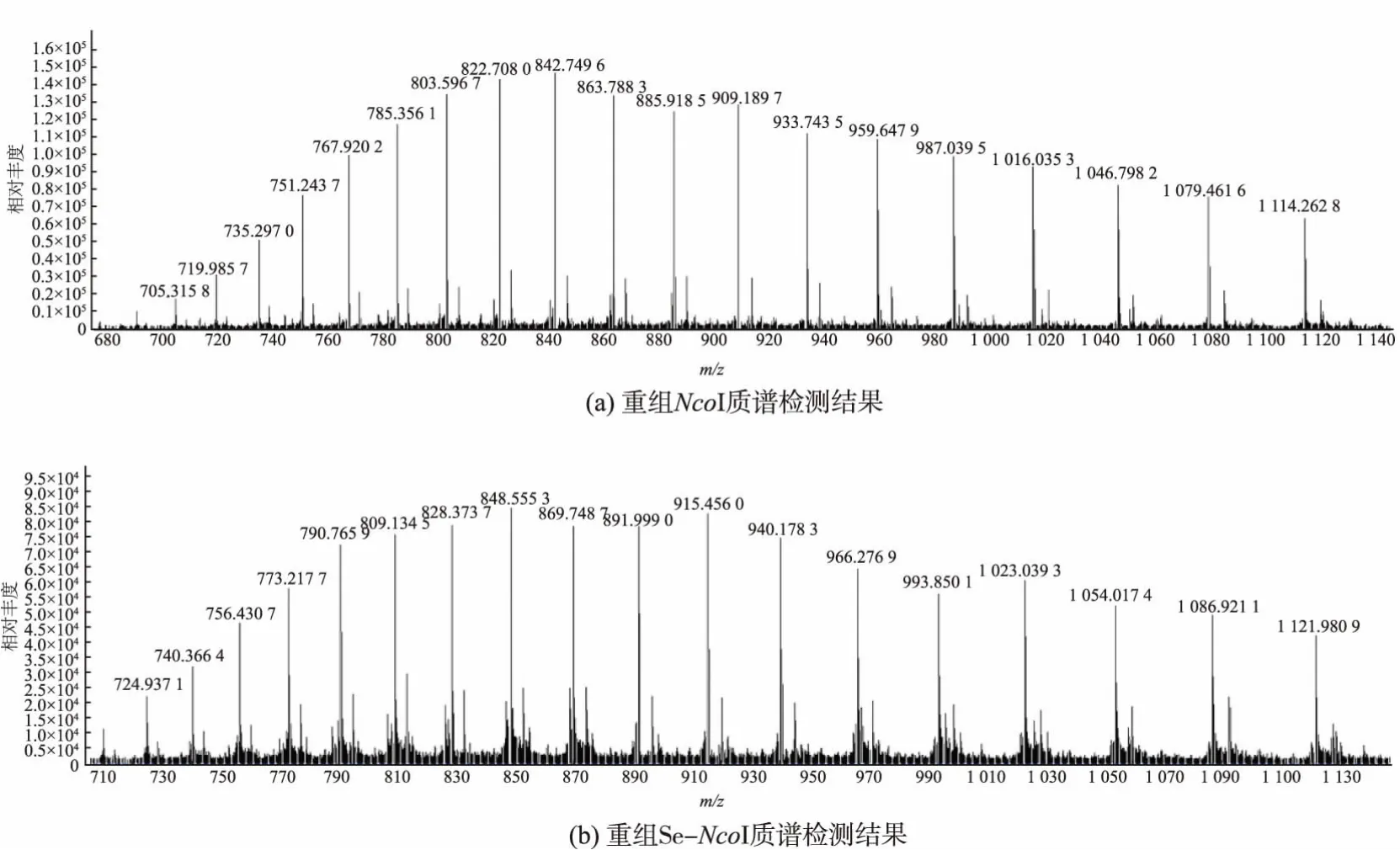
图 4 NcoI 和 Se-NcoI 质谱图Fig.4 Serum mass spectrometry of NcoI and Se-NcoI

图5 NcoI 与Se-NcoI 的酶切活力验证Fig. 5 Digestion activity of NcoI and Se-NcoI
2.6 NcoI 蛋白质结晶筛选
将重组NcoI 蛋白和 Se-NcoI 蛋白浓缩至10 mg/mL,在20 ℃下通过坐滴法,采用10 种蛋白质结晶试剂盒筛选了528 种结晶生长条件。 样品点样后观察,NcoI 在4 种条件下形成了初步的晶体。其中条件 a 为 0.1 mol/L 三水合醋酸钠 (pH 4.6)、2.0 mol/L 甲酸钠; 条件 b 为 0.1 mol/L 柠檬酸(pH 3.5)、25 g/dL PEG 3350; 条件 c 为 0.2 mol/L 硫酸铵、0.1 mol/L BIS-TRIS(pH 6.5)、 25 g/dL PEG3350;条件 d 为 0.8 mol/L 琥珀酸(pH 7.0)。 其中条件 a、b和c 下生长出的NcoI 蛋白质晶体呈针状, 见图6(a)、(b)、(c),条件 d 下生长出的蛋白质晶体呈颗粒状,见图 6(d),而 Se-NcoI 蛋白质在此条件下未形成结晶。

图6 NcoI 的结晶条件的筛选Fig.6 Initial screening of crystallization conditions of NcoI
条件b 和c 得到的单晶脆弱,因此无法捞取完整晶体。 条件d 得到的单晶分辨率差,低于0.8 nm。条件a 得到的单晶获得衍射图样见图7, 晶体存在明显各向异性,一个方向大约在0.36 nm,另一个方向大约在0.8~1 nm,需进一步优化。

图7 重组NcoI X-射线衍射图Fig. 7 X-ray diffraction image of NcoI
3 讨 论
目前, 限制酶NcoI 在PDB 蛋白质结构数据库里没有找到同源结构, 若通过X-射线晶体衍射的方法解析NcoI 结构,除了需要获得NcoI 的晶体,还需利用NcoI 同源结构、同晶置换或者多波长散射的方法进行NcoI 的结构解析。通过在大肠杆菌中表达硒代甲硫氨酸取代甲硫氨酸的重组蛋白质[18],结合多波长反常散射(MAD)的方法经过X 射线衍射可以收集到异常散射原子的边缘及其附近的数据,能够快速准确测定产生的相位角[19],从而进行NcoI 的结构解析。
限制性内切酶NcoI 对大肠杆菌体内普遍存在的 DNA 甲基化酶基因dam和dcm均不敏感,若BL21(DE3)pLysS 菌株中只表达NcoI 重组蛋白,那么宿主DNA 会被NcoI 蛋白质严重破坏。而NcoI 对应的甲基化酶NcoIM 基因与限制性内切酶基因共表达,能够使宿主DNA 获得甲基化保护,从而实现了重组NcoI 的大量表达。
作者发现甲硫氨酸缺陷型菌株B834 不适合同时表达NcoI 重组蛋白和NcoIM 重组蛋白。 这可能是B834 菌株中的基因型影响了NcoI 重组蛋白或者NcoIM 重组蛋白的表达。 有研究表明,高浓度的异亮氨酸、赖氨酸和苏氨酸能抑制天冬氨酸激酶活性,从而遏制大肠杆菌自身合成甲硫氨酸,且苯丙氨酸在此过程中起到协同作用[20]。因此,尝试利用同样表达NcoI 重组蛋白的菌株BL21 (DE3) pLysSNcoI,仅在发酵过程中添加了硒代甲硫氨酸、异亮氨酸等多种氨基酸,期望在抑制大肠杆菌甲硫氨酸本底合成的同时, 可以更好地利用外源硒代甲硫氨酸,从而获得硒代NcoI(Se-NcoI)蛋白质。 经质谱分析发现,硒代蛋白的相对分子质量与未硒代蛋白相差234, 符合硒原子取代5 个硫原子所增加的相对分子质量。 因此判断Se-NcoI 蛋白质中的5 个甲硫氨酸全部被硒代甲硫氨酸取代。 尽管硒代法适用于大多数原核表达的蛋白质,但是硒代甲硫氨酸容易氧化,并且会取代能够增强蛋白质稳定性的甲硫氨酸,导致硒代蛋白活性降低[21]。 作者对NcoI 及其硒代蛋白进行酶活验证,发现NcoI 及其硒代蛋白都能消化底物λDNA, 且二者活性类似, 从而推测Se-NcoI 与NcoI 蛋白质在结构上类似。 作者采用在普通菌株发酵培养基中添加硒代甲硫氨酸及相关氨基酸的实验方案, 能够获得完全硒代的NcoI 蛋白质,无需特殊的甲硫氨酸缺陷型表达菌株,这也为获得其他限制性内切酶硒代蛋白表达提供了参考。
X-ray 衍射法需要高质量的蛋白质晶体, 而且晶体的生长与否依赖于蛋白质纯度的高低。 获得蛋白质结晶的关键步骤是经过蛋白质高效表达以及分离纯化出纯度大于95%的蛋白质,但是蛋白质结晶条件的初步筛选没有规律,一般需要蛋白质结晶条件筛选试剂盒进行高通量筛选[22]。 作者使用了10种蛋白质结晶试剂盒,共计528 个条件,对NcoI 的蛋白质结晶条件进行了初筛,所得NcoI 晶体衍射的分辨率为0.8 nm 左右。分辨率低可能是因为蛋白质稳定性较差, 或者均一性差。 后续将进一步优化NcoI 的蛋白质构建和结晶条件, 筛选NcoI 的DNA配体, 并在此基础上继续进行硒代Se-NcoI 的晶体生长,进一步精细优化条件,以获得能产生良好衍射效果的蛋白质以及蛋白质-DNA 复合物晶体,解析NcoI 的三维结构, 以阐明NcoI 特异性识别并切割DNA 的机制。
4 结 语
作者利用限制性内切酶NcoI 和甲基化酶NcoIM 的大肠杆菌共表达体系, 获得了大量表达的限制性内切酶NcoI, 其纯度>95%, 酶质量浓度为7.5 mg/mL。 同时,通过在基础培养基M9 中添加高浓度的异亮氨酸、赖氨酸和苏氨酸等,抑制大肠杆菌自身合成甲硫氨酸, 提高硒代甲硫氨酸的利用率,获得了重组NcoI 硒代蛋白。 另外,NcoI 的完全硒代对活性无影响。通过结晶条件初筛得出NcoI 的蛋白质结晶条件,初步获得衍射分辨率为0.8 nm 的NcoI 晶体,为后续分析结构活性位点、阐明分子机制、进行定向改造、获得高效和无星号活性的突变蛋白质奠定基础。
