醇脱氢酶催化合成(S)-哌啶醇及产物抑制机制
2021-07-28吴彦霏许国超周婕妤
吴彦霏 , 许国超 , 周婕妤 , 倪 晔 *
(1. 江南大学 生物工程学院, 江苏 无锡 214122;2. 江南大学工业生物技术教育部重点实验室, 江苏 无锡214122)
大量的天然和非天然生物活性物质分子中具有一个或多个哌啶环,包括许多市售的活性药物成分[1-2]。 手性哌啶醇及其衍生物是制药工业中重要的中间体,比如(S)-N-Boc-3-羟基哌啶((S)-NBHP)是合成依鲁替尼药物的关键手性中间体,其市售品名为Imbruvica,是一种靶向B 细胞的抗癌药物[3-5]。依鲁替尼已于2013 年获得美国食品和药物管理局的批准用于治疗套细胞淋巴瘤, 分别于2014 年和2015 年获得批准用于治疗慢性淋巴细胞性白血病和淋巴浆细胞性淋巴瘤[6]。 目前手性哌啶醇主要是通过化学方法将原料通过多步转化制备而得,产率和产品纯度不理想[7]。 最近,酮还原酶(KRED)催化N-Boc-3-哌啶酮(NBPO)的不对称还原反应在手性哌啶醇的合成中显示出良好的性能。2014 年通过商业KRED 实现100 g/L NBPO 的生物转化, 首开醇脱氢酶合成(S)-NBHP 的先河[8]。 然而,本篇研究中所采用的KRED 及其后报道的醇脱氢酶均具有一定程度的底物抑制和产物抑制,且反应需要添加昂贵的辅酶,不利于高浓度条件下实现酶法规模化制备(S)-NBHP。 因此,筛选具有良好催化性能的醇脱氢酶(或酮还原酶)对实现高效酶法制备(S)-NBHP具有重要意义。
作者对本实验室保存的还原酶库进行了筛选,旨在获得对NBPO 具有优良催化性能的还原酶。 该酶库中的还原酶具有20%~50%的氨基酸序列同源性,并能够催化还原多种酮类物质。 研究发现,来源Kluyveromyces polyspora的醇脱氢酶KpADH 显示出较大的潜力,适用于酶法不对称合成(S)-NBHP。基于对不同反应体系的研究,解释了产物抑制的主要因素,并通过不添加任何助溶剂的单水相体系解除了产物抑制的影响, 实现了无需额外添加辅酶NADPH 的条件下(S)-NBHP 的高效和绿色合成。
1 材料与方法
1.1 实验材料
辅酶NADPH (还原型烟酰胺腺嘌呤二核苷酸磷酸)、NADP+(氧化型烟酰胺腺嘌呤二核苷酸磷酸)、NADH(还原型烟酰胺腺嘌呤二核苷酸)、NAD+(氧化型烟酰胺腺嘌呤二核苷酸)等:购于深圳邦泰生物科技有限公司;质粒DNA 抽提试剂盒、PCR 产物回收试剂盒、β-巯基乙醇、TEMED、异丙基-β-D-硫代半乳糖苷(IPTG)、卡那霉素(Kan)等:购于上海捷瑞生物工程有限公司;N-Boc-3-羟基哌啶: 购于上海麦克林生物公司;N-Boc-3-哌啶酮: 购于上海皓伯化工有限公司。
1.2 菌株
所有质粒均保存于江南大学生物工程学院生物催化与酶工程实验室还原酶文库, 并在Escherichia. coliBL21(DE3)中表达。
1.3 高通量活力测定方法
以NBPO 作为底物,在30 ℃下测定340 nm 处NAD(P)H 吸光度的变化,计算比活力。200 μL 活力测定体系包括:10 μL 粗酶液 (适当稀释倍数),10 μL NBPO(溶于乙醇,终浓度为 5 mmol/L),10 μL NAD(P)H(终浓度为 1 mmol/L)和 170 μL 磷酸缓冲液 (100 mmol/L,pH 7.0)。 一个酶活力单位(U) 定义为在上述条件下每分钟氧化1 μmol NAD(P)H 所需的酶量。
1.4 分析方法
反应液用乙酸乙酯萃取, 无水硫酸钠干燥,并通过真空蒸发器挥发乙酸乙酯。 采用高效液相色谱法(HPLC)分析立体选择性及转化率。立体选择性分析采用 Superchiral S-AY 柱 (4.6 mm×150 mm,Shanghai Chiralway Biotech Co.Ltd)测定,流动相为体积分数95%的正己烷和体积分数5%的乙醇。转化率分析使用 C18 柱 (4.6 mm×250 mm,Diamonsil,Shanghai DIKMA Co. Ltd),流动相为体积分数55%的乙腈和体积分数45%的水。 检测器波长均为210 nm,柱温为 30 ℃。
1.5 蛋白质的表达及纯化
将含有KpADH 重组质粒的大肠杆菌接种到LB 培养基中,并加入 50 μg/mL 的卡那霉素(Kan),在 37 ℃和 180 r/min 下振荡培养。 当 OD600达到0.8时, 加入异丙基-β-D-硫代半乳糖吡喃糖苷(IPTG,0.2 mol/L)至终浓度0.2 mmol/L,并将温度降低至25 ℃诱导蛋白质表达。 培养结束,通过离心收集细胞并在PBS 缓冲液(pH 7.4)中进行超声破碎。 将细胞裂解液以8 000 r/min 离心30 min。 最后,通过亲和色谱法纯化细胞裂解液,并通过SDS-PAGE 分析。
1.6 半衰期的测定
将KpADH 的纯酶液稀释至1 mg/mL 左右,取稀释的酶液1 mL 放入30 ℃恒温水浴锅中保温,定时取样并采用上述1.3 的测活方法。 以0 h 的活力为100%,依次测定比活力随时间变化的曲线,活力下降到50%的时间为该蛋白质在30 ℃的半衰期。
1.7 产物抑制动力学测定
采用纯酶液测定KpADH 的动力学参数, 使用上述1.3 的测活方法, 测定不同浓度底物 (0.5~50 mmol/L) 和产物 (0~100 mmol/L) 的比活力, 使用Origin 软件分别进行非线性回归(nonlinear regression)拟合。 拟合方程包括:米氏方程、竞争性抑制方程、非竞争性抑制方程、反竞争性抑制方程、混合性抑制方程;并获得参数抑制常数Ki、米氏常数Km、最大反应速率Vmax,采用Origin 评估拟合结果并通过MatLab 软件作图。 以上所有数据均独立测定3 次。
1.8 酶促不对称合成反应的条件优化
反应在20 mL 的磁力搅拌夹套反应器中进行,将1 g 底物、1.2 g 葡萄糖、20 mg 葡萄糖脱氢酶冻干酶粉、35 mgKpADH 冻干酶粉及不同助溶剂分别加入10 mL 反应体系中,30 ℃恒温条件下反应, 并采用自动滴定仪滴定1 mol/L Na2CO3, 使pH 维持在7.0。 反应进程中定点取样,通过液相色谱分析获得转化率及终产物的对映体过量值(e.e.值)。
1.9 底物及产物分配系数的测定
准确配制 1 mol/L 的 NBPO 及 NBHP,取 20 μL加入 480 μL 缓冲液中,再按照体积比 1∶1 加入有机溶剂,吸取 200 μL 水相,加入 400 μL 乙酸乙酯萃取并烘干,通过液相色谱分别计算出底物及产物的浓度。 分配系数等于底物NBPO 和产物NBHP 分别在有机相和水相浓度的分配比。 每个样品分别做3个平行。
1.10 有机溶剂耐受性的测定
将纯化的KpADH 酶液 (保持蛋白质质量浓度在1 mg/mL 左右)与有机溶剂按体积比1∶1 混合,在30 ℃和1 000 r/min 条件下振荡并保温12 h, 吸取水相中的酶液采用1.3 的测活方法, 进行残余活力的测定。
1.11 克级制备(S)-NBHP
反应在20 mL 的磁力搅拌夹套反应器中进行,将2 g 底物、2.4 g 葡萄糖、40 mg 葡萄糖脱氢酶冻干酶粉、70 mgKpADH 冻干酶粉分别加入10 mL 反应体系中,30 ℃恒温反应,并采用自动滴定仪滴定1 mol/L Na2CO3,使 pH 维持在 7.0。 反应结束后,采用二氯甲烷将反应液萃取3 次,收集萃取后的二氯甲烷,并通过旋转蒸发仪挥发二氯甲烷,获得产品(S)-NBHP。 采用 HPLC 分析产品的立体选择性。
2 结果与讨论
2.1 醇脱氢酶的筛选
对酶库进行有针对性的筛选是获得新酶的有效途径之一。 分别以NADPH 和NADH 为辅酶,以N-Boc-3-哌啶酮(NBPO)为底物,在 340 nm 对实验室保存的还原酶库进行高通量活力筛选。 通过筛选发现, 对 NBPO 具有还原活力的还原酶均为NADPH 依赖型。 进一步对有活力的还原酶进行立体选择性分析,结果见表1。 经过活力的筛选得到6种对NBPO 具有一定催化活力的还原酶,立体选择性较高的有 4 种:KpADH、CgKR1、PAR、Cg26。 其中Cg26 的立体选择性为R构型,其余3 种为S构型。考虑到适用于大规模的酶法制备,一些商业参数指标需要参考,例如生物催化剂载量,其决定反应过程中酶制剂的经济效应。 较高的比活力有利于生物催化剂在较低的载量下实现底物浓度载量上的生物转化数,从而实现经济高效的生物催化过程[9]。 同时, 前期工作中获得了KpADH 的晶体结构并对KpADH 的立体选择性机制做了深入的分析, 有利于后续的立体选择性改造[10]。 从表1 来看,KpADH较高的比活力在大规模的制备中更具有明显的优势。 所以, 选取来自Kluyveromyces polyspora的KpADH 为后续研究对象[11]。
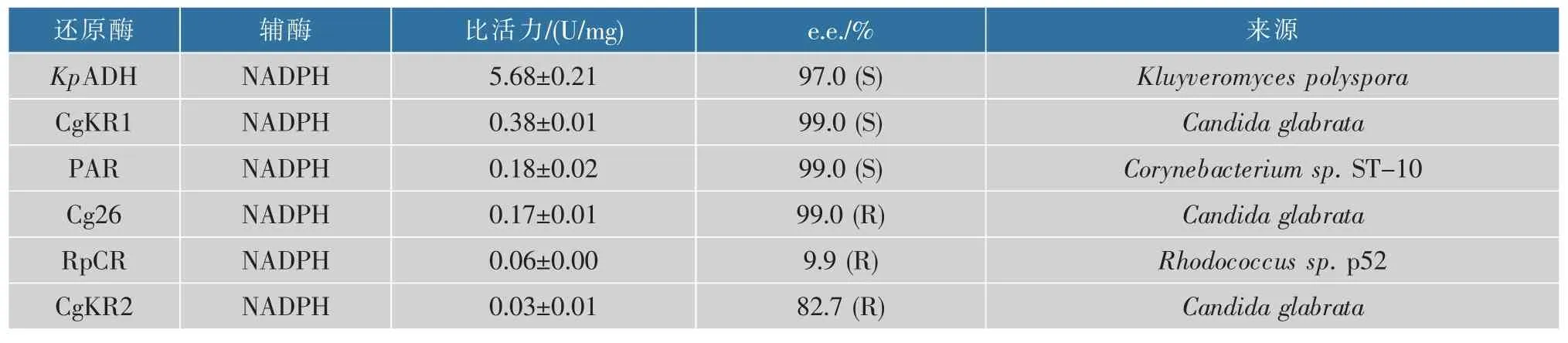
表1 醇脱氢酶酶库的筛选结果Table 1 Screening results of alcoholdehydrogenases library
2.2 不同底物浓度对转化率的影响
具有应用前景的生物催化反应通常底物上载量应大于100 g/L,故首先考察了KpADH 对高浓度NPBO 的耐受情况。 根据文献报道,NBPO 为疏水性底物[12]。 因此,在10 mL 的反应体系中加入5%的乙醇助溶,并加入相同的酶量(200 U)考察不同底物浓度对反应的影响。 如图1 所示,随着反应时间的增加,转化率快速趋于稳定。当底物浓度为250 mmol/L时,反应可实现完全转化,然而在底物浓度分别为500 mmol/L 和1 mol/L 时, 底物的转化水平分别为390 mmol/L 和460 mmol/L。 底物浓度较高的两个反应都快速终止在400 mmol/L 的转化水平,且延长反应时间后转化率并未得到改善。 测定30 ℃KpADH的半衰期为80 h,说明KpADH 的稳定性良好。但在加入底物反应1 h 左右, 反应快速终止在400 mmol/L的转化水平,说明反应过程中较高的底物或产物浓度抑制了KpADH 合成产物(S)-NBHP。该现象与之前报道的YDR541C 在单水相催化中受到严重的抑制结果一致[13],说明可能是产物抑制导致的。 因此,作者考察不同浓度的产物对不对称还原反应的影响。

图1 不同底物浓度的反应转化曲线Fig. 1 Reaction conversion curves at different substrate concentrations
2.3 不同产物浓度对转化率的影响
在1 mL 反应体系中加入相同酶量 (0.015 U)、相同的底物浓度(50 mmol/L NBPO)和不同的产物浓度(0~250 mmol/L NBPH),考察不同产物浓度对KpADH 催化还原NBPO 反应的影响, 结果见图2。随着产物浓度的增加,反应转化率逐渐降低,直到反应转化率接近3%, 说明产物抑制是影响NBPO转化反应的关键因素。

图2 不同浓度产物对KpADH 催化NBPO 还原反应转化率的影响Fig. 2 Effect of different product concentrations on the bioreduction of NBPO catalyzed by KpADH
2.4 底物和产物抑制动力学拟合分析
分别考察了不同浓度的底物和产物存在的条件下KpADH 比活力的变化, 并通过拟合获得相应的动力学常数,见图3。 经过底物动力学测定,在高浓度底物的条件下KpADH 的活力没有明显降低,Km值为 (17.4±1.1) mmol/L,Vmax值为 (88.3±2.2)μmol/(min·mg),未发现明显底物抑制的现象。 在加入不同浓度的产物后,KpADH 的比活力呈现不同程度降低,见图3(b)的拟合曲线。 通过抑制动力学拟合分析和Origin 软件评估拟合结果,非竞争抑制方程的拟合程度最高,R-Square 值高达0.98 (RSquare 越接近1,说明拟合程度越高)。 获得抑制常数Ki值为(459.9±118.6) mmol/L,Km值为(9.9±1.0)mmol/L,Vmax值为(83.9±2.9) μmol/(min·mg)。 上述反应体系中加入助溶剂乙醇以增加产物的水溶性,当达到产物的抑制浓度后反应受到抑制而进入平台期。

图3 底物和产物动力学的拟合结果Fig. 3 Fitting results of the substrate and product kinetics
经过拟合评估, 该抑制类型属于非竞争性抑制。 这说明产物与酶的非活性部位相结合,形成产物和酶的络合物后会进一步再与底物结合;或者是酶与底物结合形成底物和酶络合物后,部分再与产物结合。 虽然底物、抑制物(产物)和酶的结合无竞争性,但两者与酶结合所形成的中间络合物不能释放产物,导致了酶催化的表观反应速率降低。
据报道,NADPH 依赖性的羰基还原酶YDR541C 在单水相反应体系中进行NBPO (100 ~400 mmol/L)的不对称转化,300 mmol/L 的 NBPO 可以在1 h 内完全转化, 由于产物抑制作用,400 mmol/L 的NBPO 转化率仅为81.7%。 最终反应停留在300 mmol/L 的转化水平[13]。与还原酶PsCR 一样,在单水相体系中将4-氯-3-氧代丁酸乙酯(COBE)不对称催化还原为(S)-4-氯-3-羟基丁酸酯((S)-CHBE),当产物浓度达到120 mmol/L 时,反应速度急剧下降[14]。作者通过动力学拟合分析,当达到抑制浓度400 mmol/L 时, 产物与底物非竞争性地结合KpADH 形成三元复合物, 使KpADH 构象改变,不能进一步释放产物,导致酶活力下降。 这种非竞争性抑制作用不能通过增加底物浓度来解除抑制[15]。因此, 在不同的底物浓度下KpADH 的转化水平停留在400 mmol/L。
2.5 单水相催化体系的探索
据报道,反应体系中添加助溶剂可能影响产物的转化率和立体选择性[16-17]。 由于KpADH 还原NBPO 的e.e.值为97%,因此通过溶剂的优化可能提高终产物的立体选择性和反应转化率。 作者针对单水相体系和水-有机两相体系进行了研究, 根据不同底物浓度的研究结果,固定500 mmol/L 的底物浓度,保持底物与酶添加量的质量比(S/C)为18.2∶1的条件下,选择不同的醇类助溶剂、有机溶剂以及绿色离子液体BMIN·PF6进行体系的优化[18-19]。
如表 2 所示,反应体系 2、3、4 中分别加入体积分数5%醇类助溶剂, 可以看出助溶剂虽然提高了反应的初速率,但是反应很快就在转化率为60%左右时终止,这是产物抑制导致的。 反应5 中加入5%的乙酸丁酯,最终转化率达到98.2%。由于乙酸丁酯的疏水性使得产物空间上与酶分离,因而转化率得以提升, 但也限制了酶与剩余底物的充分接触,最终使得反应在24 h 的转化率未达到99%以上。少量有机溶剂的添加对e.e.值没有影响。 综上,其中最佳的反应体系为不加任何助溶剂的磷酸盐缓冲液体系,在该体系中,反应转化率可以达到99%以上。

表2 KpADH 单相反应体系的优化结果Table 2 Optimization results of KpADH inmonoaqueous phase reaction system
2.6 两相催化体系的探索
采用水-有机溶剂的两相体系可实现底物与酶、产物与酶在空间上的相对分离,从而避免酶失活。 底物NBPO 是疏水性底物,略微溶于水,不利于与酶分子充分接触。 此外,底物对酶分子有一定毒性,这也会导致酶分子的失活,因此尝试两相反应体系实现油—水的界面反应。 作者选取了具有不同lgP值的10 种有机溶剂进行探究,分别测定了产物和底物在有机溶剂中的分配系数以及有机溶剂对KpADH 催化活性的影响,结果见表3—4。最终选择产物分配系数分别为3.6 和15.8 以及残余活力分别为91%和5%的有机溶剂:甲苯和乙酸丁酯。 反应体系6 和7 表明,50%有机溶剂的加入使e.e. 值提高至98.9%,这表明酶在有机溶剂中刚性增强,构象更加稳定[17]。但是,两相反应体系的转化率均没有达到99%的水平,且反应速率较慢,说明大量的底物溶解在有机溶剂中减少了酶与其碰撞的机会,所以反应速率下降,尤其是在反应后期底物较少的情况下,无法与酶充分接触,导致反应不完全。

表3 有机溶剂对KpADH 活力的影响及产物和底物的分配系数Table 3 Effect of organic solvents on KpADH activity and partition coefficient of products and substrates
据报道,离子液体作为一种绿色溶剂可被用作为反应介质增强传质效率和提高酶的稳定性[20-22]。因此, 选取常用的离子液体1-丁基-3-甲基咪唑六氟磷酸盐(BMIN·PF6)以及实验室合成的低共熔溶剂氯化胆碱∶尿素摩尔比为1∶2、氯化胆碱∶甘油摩尔比为 1∶1、 氯化胆碱∶葡萄糖摩尔比为 5∶2 来探索反应的转化率和对映选择性。 然而,KpADH 在上述离子液体和低共熔溶剂(DES)中活力较低,仅观察到较低的转化率。
2.7 克级制备(S)-NBHP
从上述反应体系优化的结果可知,未加入任何助溶剂的反应体系1 可在24 h 内催化还原500 mmol/L NBPO,达到99.6%的转化率,见图4。说明在该反应过程中,底物NBPO 逐渐溶解并完全转化为产物(S)-NBHP,且产物难溶于水相体系,避免了与酶的大量接触,未对酶活产生显著影响。 加入助溶剂后,反应初速度加快,但增加了产物的溶解度,使之达到抑制浓度(459.9±118.6) mmol/L,所以反应快速终止。 另外,与两相体系相比,大量有机溶剂的加入可以略微提高产物的e.e.值,但转化不完全会影响终产物的纯度。 所以,不加任何助溶剂的磷酸盐缓冲液体系更具备绿色、高效的生物催化制备条件。
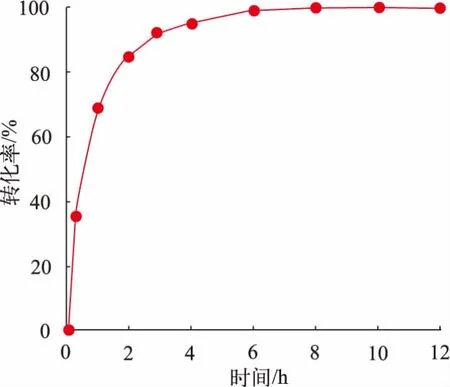
图4 KpADH 不对称还原200 g/L NBHO 的反应进程Fig. 4 Conversion curve of the asymmetric reduction of NBPO by KpADH at 200 g/L
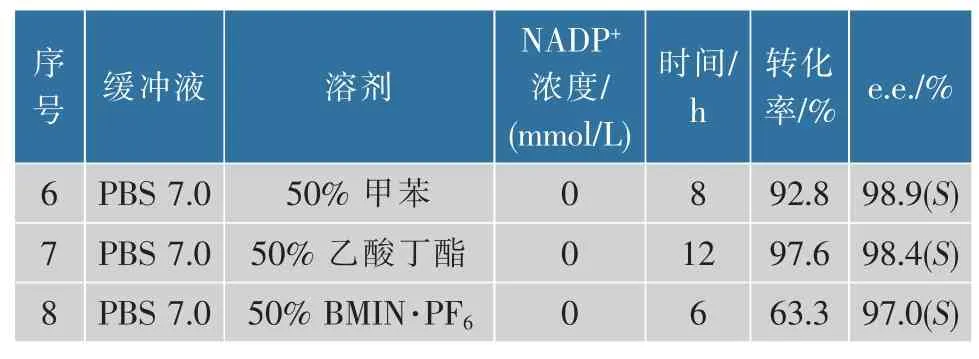
表4 两相反应体系的优化结果Table 4 Optimization results of biphasic reaction system
因此,在反应体系1 的基础上保持底物与酶添加量的质量比(S/C)为18.2 g/g 不变,逐渐增加底物的质量浓度至 200 g/L(1 mol/L),最终反应 12 h,可实现完全转化,产物的e.e.值为97%,产品收率为77%。 与来源于酿酒酵母的羰基还原酶YDR541C催化合成(S)-NBHP 相比,KpADH 能够在不加任何有机溶剂和外源辅酶的条件下实现较高浓度的转化,表明KpADH 在酶法制备(S)-NBHP 上具有良好的应用潜力[13]。
3 结 语
作者筛选和比较发现KpADH 可以高效还原NBPO 合成(S)-NBHP。 通过反应体系的探索,发现在加入乙醇等助溶剂的反应体系中有较强的抑制效应, 且高浓度的产物NBHP 对KpADH 催化性能影响显著。 通过动力学拟合,发现抑制类型为非竞争性抑制类型, 并计算获得抑制常数Ki值为(459.92±118.59) mmol/L。 反应体系优化的结果说明,不添加任何助溶剂的体系能够有效地避免产物抑制,同时也能使酶与底物充分接触,反应完全。 在此基础上实现了200 g/L 底物的完全转化, 克级制备获得了(S)-NBHP。 作者初步探究了 NBHP 对醇脱氢酶的抑制机制,并优化和建立了解决抑制问题的反应体系,为实现(S)-NBHP 的大规模酶法合成奠定了良好的研究基础。
