微小RNA-338-3p靶向调控高迁移率族蛋白B1增强子宫内膜癌对紫杉醇敏感性的研究
2021-07-28邹学红汪俊王芳谢环
邹学红,汪俊,王芳,谢环
子宫内膜癌是女性常见的恶性肿瘤之一,其发病率呈逐年上升趋势,但关于子宫内膜癌的发病机制仍不明确。有研究发现紫杉醇(paclitaxel,PTX)可抑制乳腺癌等肿瘤细胞,PTX 可联合顺铂用于子宫内膜癌的治疗。有多项研究表明miRNAs 可影响癌细胞对PTX 药物敏感性,如miRNA-101 增强乳腺癌MDA-MB-231 细胞对PTX 的药物敏感性。有报道称 miR-338-3p 可靶向 FOXP4 抑制肝癌细胞的增殖,miR-338-3p 通过调控 ZEB2 和MACC1 信号通路影响胃癌细胞上皮间质转化,但关于miR-338-3p 在子宫内膜癌的表达相关研究仍较少。有研究发现高迁移率蛋白B1(high-mobilitygroupboxprotein-1,HMGB1)在子宫内膜癌中表达上调,发挥促癌基因作用。但 miR-338-3p 是否通过调控HMGB1 表达增强子宫内膜癌对PTX 的敏感性仍未可知。本研究自2019年1-6月通过流式细胞术和CCK-8 实验,探讨miR-338-3p 调控人子宫内膜癌细胞HEC-1B 和ishikawa 对PTX 敏感性的影响分子机制,为深入探讨人子宫内膜癌发病和耐药机制以及改善子宫内膜癌患者的预后提供科学依据。
1 材料与方法
1.1 试剂及仪器
DMEM 培养基(C11965500BT)、青霉素和链霉素(15140122)为美国Gibco 公司产品;ECL 试剂(P0018)、RIPA 蛋白裂解液(P0013B)、HMGB1 抗体(AF1174)和蛋白印迹法(Western blottingting)所用试剂为碧云天公司产品;β-肌动蛋白(β-actin)为德国Merck 公司产品(A4700);Trizol 试剂为英潍捷基公司产品(15596026);CCK-8 试剂盒(CA1210)为索莱宝公司产品;mirPremiemicro RNA Isolation Kit(SNC50)为德国 Merck 公司产品;一步法miRNA反转录试剂盒(D1801)为新海基因公司产品;mirVana实时荧光定量聚合酶链反应(qRTPCR)miRNA detection Kit(AM1558)为赛默飞公司产品;双荧光素酶报告基因质粒(E1751)为美国Promega 公 司 产 品 ;Annexin V-FITC/PI 检 测 试 剂(CA1020)、CCK8 试剂盒(CA1210)为北京 Solarbio公司产品;PTX(33069-62-4,纯度≥98%)为成都德锐可生物科技有限公司;实验中所用引物、质粒均由江苏金唯智公司合成制备。1.2 方法
1.2.1
细胞培养及转染 人子宫内膜癌细胞株Ishikawa 细胞株由中国人民解放军武汉总医院医院妇产科实验室保存,人正常子宫内膜上皮细胞ESC和子宫内膜癌细胞株HEC-1B 购于北京细胞中心,细胞培养于含有10%胎牛血清、100 U/mL 青霉素和100 μg/mL 链霉素的 DMEM 培养基中,在 37 ℃、5%二氧化碳及饱和湿度培养箱中培养;将细胞分为如下5组:miR-338-3p组(转染miR-338-3p mimics组)、miR-NC(转染miRNA阴性对照组)、si-HMGB1组(转染干扰RNA)、si-NC 组(转染siRNA 阴性对照)和miR-338-3p+HMGB1 组(共转染 miR-338-3pmimics和pcDNA3.0 HMGB1 组),将各组用转染试剂转染至 Ishikawa 和 HEC-1B 细胞,培养 6 h 后更换为完全培养基用于后续实验。1.2.2
Ishikawa 和 HEC-1B 细 胞 PTX 敏 感 性 的 检测 将上述转染组细胞接种至96孔板中,细胞密度为 8×10个/mL,24 h 后,各孔加入相应浓度的 PTX(终浓度分别为 0 、0.5、1.0、1.5、2.0 μg/mL)继续培养24 h 后,弃去培养基,加入完全培养基100 μL 和10 μL CCK-8溶液继续培养1 h,按照1.2.4 中方法检测细胞增殖,并计算细胞存活分数,绘制拟合曲线。1.2.3
RT-qPCR 检测 miR-338-3p mRNA 水平 采用 TRIZOL 法提取细胞总 RNA,mirPremiemicro RNA Isolation Kit 分离miRNA,利用一步法miRNA反转录试剂盒进行反转录,用mirVanaqRT-PCR miRNA detection 试剂盒进行RT-qPCR 检测,以U6为内参,2法检测 miR-338-3p mRNA 水平,步骤参照各试剂盒方法。MiRNA-338-3p(退火温度为60 ℃)的SRT 引物:TCAACTGGTGTCGTGGAGTCGGCAAT-TCAGTTGAGCAACAA;特异性性引物:AUGACUCAGGCGACTCCAGC-ATCAGTGATT;通用引物:TGGTGTCGTGGAGTCG;U6(退火温度为58 ℃)引 物 :F:GCGGTCTGCGCGATCAAG,R:TTCCCCTCGAGCTCATTGCC。1.2.4
CCK-8 法检测细胞增殖 将上述处理组细胞消化后接种至96 孔板中,每孔100 μL,每孔细胞为 6×10个,每组设置 5 个复孔,待细胞培养 0 、24、48、72 h 后,每孔加入10 μL CCK-8 溶液,继续培养1 h,在酶标仪选择450 nm 波长,测定并记录各孔吸光度值(OD),实验重复3 次,求平均值,绘制细胞增殖曲线。1.2.5
双荧光素酶报告基因实验 采用TargetScan预测HMGB1 可能是miR-338-3p 的靶基因。分别将含有与 miR-338-3p 结合位点的 HMGB1 3’UTR 片段及突变体插入到pGL3 荧光报告载体基因下游,分别记为HMGB1-WT(野生型)和HMGB1-Mut(突变型)。将测序鉴定正确的HMGB1-WT 和HMGB1-Mut 质粒分别与 miR-NC 和 miR-338-3p mimics 共转染 Ishikawa 和 HEC-1B 细胞,常规培养 24 h 后,参照双荧光素酶报告基因检测试剂盒说明书步骤进行检测。1.2.6
Annexin V-FITC/PI 检测细胞凋亡 收集上述处理组细胞,用胰蛋白酶将细胞消化,取1×10个细胞,加入 300 μL 的 DMEM 重悬细胞,加入 5 μL Annexin V-FITC,室温避光孵育 15 min,加入 5 μL PI 混匀,再补加 200 μL 的 DMEM 后,上流式细胞仪进行检测,重复3次,求平均值。1.2.7
Western blotting 检测HMGBI 蛋白表达 将上述处理组细胞用预冷PBS 洗涤3 遍,加入含有PMSF(100 倍稀释)的细胞裂解液,利用BCA 蛋白浓度测定试剂盒测定蛋白浓度,然后进行SDS-PAGE电泳,采用湿转法将蛋白转至PVDF 膜上,用5% 脱脂奶粉4 ℃过夜封闭,用HMGB1和β-actin的一抗进行4 ℃过夜孵育,用辣根过氧化物标记山羊抗鼠二抗进行37 ℃温箱孵育,PBST 洗膜3 次,用混好的ECL 化学发光液滴加至膜上,化学发光成像仪下扫描并拍照,同时以β-actin 为内参,对目的蛋白HMGB1做相对定量分析。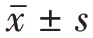
2 结果
2.1 miR
-338
-3p 在子宫内膜癌细胞中低表达
RT-qPCR 检测miR-338-3p 在人正常子宫内膜上皮细胞ESC 及子宫内膜癌细胞HEC-1B 和Ishikawa 的表达,结果显示,与人正常子宫内膜上皮细胞ESC相比,miR-338-3p 在子宫内膜癌细胞HEC-1B 和Ishikawa 中表达显著下调[(1.00±0.10)比(0.51±0.04),(0.46±0.04),F
=182.114,P
=0.000;t
=13.649,P
=0.000,t
=15.041,P
=0.000]。2.2 过表达miR
-338
-3p 抑制子宫内膜癌细胞增殖、促进凋亡和增加子宫内膜癌细胞对PTX 的敏感性
将miR-338-3p mimics 转染至HEC-1B 和Ishikawa 细胞中,RT-qPCR 检测结果显示,miR-338-3p 在HEC-1B[(1.00±0.10)比(4.87±0.31),t
=35.643,P
=0.000]和Ishikawa[(1.00±0.09)比(6.11±0.43),t
=34.895,P
=0.000]细胞中表达显著上调;CCK-8 法检测结果和流式细胞术结果显示:与miR-NC 组相比,miR-338-3p 组细胞的增殖能力降低(表1),而细胞凋 亡 率 显 著 增 加[HEC-1B :(10.02±0.86 ) 比(23.10±1.86),t
=19.149,P
=0.001;Ishikawa :(10.01±0.91)比(25.43±2.01),t
=20.966,P
=0.000];不同浓度的PTX 联合miR-338-3p 对子宫内膜癌细胞增殖能力的影响:CCK-8 实验结果显示,HEC-1B 和Ishikawa 细胞的存活分数随着紫杉醇浓度的增加而逐渐下降,与miR-NC 组相比,miR-338-3p 组细胞存活分数均明显下降(HEC-1B:t
=1.401,P
=0.925,t
=1.234,P
=0.051,t
=5.152,P
=0.006,t
=14.787,P
=0.004,t
=14.482 ,P
=0.004,t
= 15.614,P
=0.000,t
=14.221,P
=0.003,t
=0.152,P
=0.473),(Ishikawa:t
=1.663,P
=0.825,t
=3.35,P
=0.041,t
=6.176,P
=0.012,t
=7.944,P
=0.008,t
=15.013 ,P
=0.001,t
=16.063,P
=0.000,t
=15.022,P
=0.001,t
=0.676,P
=0.758)。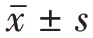
表1 CCK-8检测细胞增殖活力/(,n=9)
2.3 miR
-338
-3p 的
靶
基
因
HMGB1
RT-qPCR 检测HMGB1 表达,与人正常子宫内膜上皮细胞ESC相比,HMGB1 在子宫内膜癌细胞HEC-1B 和ishikawa 中表达上调[(1.00±0.10)比(4.31±0.32)、(3.24±0.26),F
=64.240,P
=0.000];生物学在线预测分析软件 Targetscan 预 测 到 miR-338-3p 与 HMGB1 的 3’UTR 存在结合位点(图1A);双荧光素报告基因实验验证miR-338-3p 与HMGB1 之间的靶向关系,结果显示:miR-338-3p 能显著降低野生型HMGB1-3’UTR WT 的 荧 光 活 性[HEC-1B:(1.00±0.11 ) 比(0.44±0.03),t
=17.709,P
=0.000;ishikawa:(1.00±0.11)比(0.47±0.04),t
=13.584,P
=0.000],但却不影响 HMGB1-3’UTR MUT 的荧光活性[HEC-1B:(1.00±0.12)比(1.01±0.10),t
=0.212,P
=0.835;ishikawa:(1.00±0.12 ) 比(1.01±0.10),t
=0.192,P
=0.850];Western blotting 检测结果显示,与 miR-NC组相比,过表达miR-338-3p 可显著降低HMGB1 在HEC-1B[(1.00±0.10)比(0.44±0.03),t
=16.091,P
=0.000]和 ishikawa[(1.02±0.11)比(0.47±0.04),t
=14.097,P
=0.000]细胞中的表达(图1B)。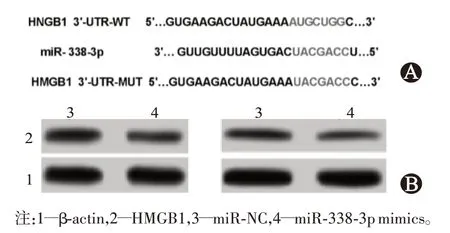
图1 miR-338-3p与HMGB1之间的靶向关系验证:A为miR-338-3p与HMGB1的3’UTR存在结合位点;B为过表达miR-338-3p对HMGB1表达的影响
2.4 敲低HMGB1 抑制子宫内膜癌细胞增殖、促进凋亡和增加子宫内膜癌细胞对PTX 的敏感性
将si-HMGB1 转染至 HEC-1B 和 ishikawa 细胞,Western blotting 结果显示,与 si-NC 组相比,si-HMGB1 组细胞中HMGB1 表达显著降低[HEC-1B:(1.00±0.10)比(0.44±0.03),t
=16.091,P
=0.000;ishikawa:(1.00±0.09)比(0.48±0.04),t
=15.839,P
=0.000];CCK-8法检测结果和流式细胞术结果显示:与si-NC 组相比,si-HMGB1 组细胞的增殖能力降低(表2),而细胞 凋 亡 率 显 著 增 加[HEC-1B:(10.02±0.91 ) 比(24.30±1.96),t
=19.825,P
=0.000,ishikawa:(10.01±1.01)比(22.72±1.76),t
=18.791,P
=0.000];不同浓度的PTX 联合si-HMGB1 对子宫内膜癌细胞增殖能力的影响:CCK-8 实验结果显示,HEC-1B 和Ishikawa 细胞的存活分数随着紫杉醇浓度的增加而逐渐下降,与si-NC组相比,si-HMGB1组细胞存活分数均明显下降(HEC-1B:t
=1.332,P
=0.657,t
=1.742,P
=0.146,t
=5.243,P
=0.024,t
=5.342,P
=0.011,t
=14.522,P
=0.000,t
=16.162,P
=0.001,t
=13.594,P
=0.001,t
=0.152,P
=0.421;Ishikawa:t
=1.356,P
=0.745,t
=3.321,P
=0.086,t
=6.313,P
=0.016,t
=8.224,P
=0.016,t
=15.175,P
=0.000,t
=16.394,P
=0.000,t
=14.943,P
=0.001,t
=0.974,P
=0.343)。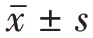
表2 CCK-8检测细胞增殖活力/(,n=9)
2.5 HMGB1 部分逆转miR
-338
-3p 对子宫内膜癌细胞增殖、凋亡及对PTX 敏感性的影响
将miR-338-3p 和 pcDNA3.0HMGB1 共 转 染 至 HEC-1B 和ishikawa 细胞,与 miR-338-3p 组相比,miR-338-3p+HMGB1 组细胞增殖能力升高(表3),细胞凋亡率降低(表4);不同浓度的PTX 联合pcDNA3.0 HMGB1和miR-338-3p mimics 对子宫内膜癌细胞增殖能力的影响:CCK-8 实验结果显示,HEC-1B 和 Ishikawa细胞的存活分数随着紫杉醇浓度的增加而逐渐下降,与miR-338-3p组相比,miR-338-3p+HMGB1组细胞存活分数升高(HEC-1B:F
=1.021,P
=0.6425,F
=0.493,P
=0.326,F
=22.943,P
=0.000,F
=42.070,P
=0.000,F
=85.374,P
=0.000,F
=188.411,P
=0.000,F
=90.020,P
=0.000,F
=0.682,P
=0.216;ishikawa :F
=1.011,P
=0.689,F
=0.301,P
=0.281,F
=19.020,P
=0.000,F
=35.882,P
=0.000,F
=83.360,P
=0.000,F
=243.824,P
=0.000,F
=127.017,P
=0.000,F
=0.694,P
=0.846)。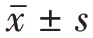
表3 CCK-8检测细胞增殖活力/(,n=9)
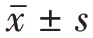
表4 流式细胞仪检测细胞凋亡/(,n=9)
3 讨论
MiRNAs 是 一类长度 约为 19 至 23 个 nt 的 高 度保守的内源性非编码小分子RNA,能够通过与靶基因的mRNA 的3’UTR 不完全互补配对进而影响mRNA 的降解或抑制其翻译。研究表明有多种miRNAs 通过调控子宫内膜癌的增殖,迁移侵袭和凋亡等种生物学过程,参与癌症的发生发展。miR-338-3p 在多种癌症中发挥多种调控作用,如Ju等发现 miR-338-3p 可抑制胃癌细胞的发展,Peng等发现miR-338-3p 可通过IRS2 抑制非小细胞肺癌的增殖和侵袭,但 miR-338-3p 在子宫内膜癌细胞中的研究较少。本研究以人子宫内膜癌细胞HEC-1B和ishikawa为研究对象,RT-qPCR检测发现,与人正常子宫内膜上皮细胞ESC 相比,miR-338-3p 在HEC-1B 和ishikawa 细胞中的表达显著下调,提示我们miR-338-3p 可能在子宫内膜癌的发生发展中发挥重要作用。后续研究中在HEC-1B 和ishikawa 细胞中过表达miR-338-3p,检测发现过表达miR-338-3p 可抑制 HEC-1B 和 ishikawa 细胞增殖,促进其凋亡,提示miR-338-3p 可能成为子宫内膜癌潜在的治疗靶点。PTX 是一种来自紫衫树皮的提取物,通过影响肿瘤细胞的有丝分裂和细胞周期发挥作用,是临床一线抗肿瘤药物,不断有研究表明PTX 可联合其它化疗药物抑制子宫内膜癌的进展。在本研究中,首先检测了不同浓度的PTX 联合miR-338-3p对HEC-1B和ishikawa细胞增殖的影响,结果与前人研究一致,随着 PTX 的提高,HEC-1B 和 ishikawa 细胞的增殖能力降低,表明PTX 可抑制HEC-1B 和ishikawa 细胞的增殖,同时,与 miR-NC 组相比,miR-338-3p 组的细胞增殖能力降低,表明过表达miR-338-3p 可增加 HEC-1B 和 ishikawa 细胞对 PTX 的敏感性。
有研究表明HMGB1 参与多种癌症的发生发展过程。本研究首先检测了HMGB1在HEC-1B和ishikawa 细胞中的表达,结果发现,与人正常子宫内膜上皮细胞 ESC 相比,HMGB1 在 HEC-1B 和 ishikawa 细胞中的表达显著上调,提示我们HMGB1 可能在子宫内膜癌的发生发展中发挥重要作用。而HMGB1 对其他癌症的影响前人早有报道,如miR34a可靶向HMGB1抑制人宫颈癌和结肠癌细胞的增殖、迁移和侵袭,HMGB1 促进骨肉瘤细胞增殖和侵袭,抑制细胞凋亡。这些数据表明HMGB1在多种癌症中可能扮演着促癌基因的角色。为了验证miR-338-3p 是否可靶向HMGB1 参与子宫内膜癌的发生发展以及其对PTX 的敏感性,本研究通过生物信息学在线分析软件预测到HMGB1 的3’UTR与miR-338-3p 存在结合位点,双荧光素酶报告基因实验证实HMGB1 是miR-338-3p 的靶基因,且过表达miR-338-3p 可抑制HMGB1 表达,表明miR-338-3p 可靶向并负性调节HMGB1 表达。后续研究中在HEC-1B 和 ishikawa 细 胞 中 敲 低 HMGB1,敲 低HMGB1 可抑制 HEC-1B 和 ishikawa 细胞增殖,促进其凋亡,同时增加HEC-1B和ishikawa细胞对PTX的敏感性,与过表达miR-338-3p结果相一致。HMGB1和miR-338-3p共转染至HEC-1B和ishikawa细胞,结果发现HMGB1 可部分逆转miR-338-3p 对子宫内膜癌细胞增殖,凋亡以及对PTX敏感性的影响。
综上所述,本研究首次发现miR-338-3p 靶向HMGB1可促进人子宫内膜癌细胞HEC-1B和ishikawa凋亡、抑制增殖,同时增加其对PTX 的敏感性,为临床上miR-338-3p 联合PTX 治疗人子宫内膜癌提供了理论依据。
