无创粪便SDC2甲基化联合血清CEA在结直肠癌早期诊断中的应用价值
2021-07-24李锦,孙珍
李 锦,孙 珍
[1.深圳市宝安区中心医院消化内科(深圳大学第五附属医院),广东 深圳 518100;2.深圳市宝安中医院(集团)检验科,广东 深圳 518100]
结直肠癌是临床上常见的消化道恶性肿瘤,好发于结肠和直肠部位,尤其在老年人群发病较多。近数十年,结直肠癌的发病率在全球呈上升趋势,其可能与人们生活方式的改变和饮食结构的变化有关[1]。结直肠癌早期,患者大多无明显症状,或症状略为轻微、不易发现,具有一定的隐匿性;但其中晚期容易发生全身远处转移,常见转移部位有肝脏、肺及其他器官,严重甚至危及生命[2-3]。若临床上结肠癌能做到早发现、早治疗,对提高患者的生存率和生活质量具有重要意义[4]。目前,结直肠癌的诊断主要依靠微创结直肠镜手术及病理活检[5],同时还配合有血清癌胚抗原CEA检测;但由于结肠镜检测是侵入性检查、需繁琐的肠道准备、有穿孔的风险等,而血清CEA检测因敏感度和特异性低而存在明显的局限性,导致结直肠癌筛查难以普及[6]。有研究[2]表明,粪便DNA检测其具有无创、方便、诊断效能高等优点,检测粪便样本中SDC2甲基化水平,有助于准确预测评估结直肠癌患病情况,且标本采集方法简单,操作方便、无侵入性。本研究采用无创粪便SDC2基因甲基化联合血清CEA的检测对结直肠癌诊断分析,旨在明确其在结直肠癌诊断中的应用及评估价值。
1 资料与方法
1.1一般资料:选取我院2018年1月~2020年1月收治确诊的64例结肠癌患者,58例结直肠瘤患者及60例健康对照组作为研究对象。纳入标准[3]:①均经过组织病理确诊结直肠癌,既往未接受过任何抗肿瘤治疗;②术前无远处转移病灶;③自愿参与实验,同意粪便 SDC2 基因甲基化检测及 CEA 检测。 排除标准:①肠镜检查发现其他肠道疾病;②存在全身感染性疾病、精神疾病,以及其他严重器质性病变;③近1个月有肉眼血便者。其中结直肠癌组(n=64)患者男43例,女21例;年龄35~80岁,平均(52.21±10.54)岁;结直肠瘤组(n=58)患者男38例,女20例;年龄34~78岁,平均(47.85±11.81)岁;健康对照组(n=60)男40例,女20例;年龄30~78岁,平均(48.62±9.71)岁。三组患者年龄、性别比较均差异无统计学意义(P>0.05),具有可比性。本研究经我院医学伦理委员会批准,所有患者均签署知情同意书。
1.2方法:①标本采集:抽取受试者空腹外周静脉血4 ml,以3 000 r/min 离心15 min后取血清,化学发光免疫分析法,根据试剂盒说明书,应用全自动电化学发光分析仪(CDBASE601 型)检测血清癌胚抗原(carcinoembryonic antigen,CEA) 含量。当血清CEA>5 μg/L,检测结果为阳性。②粪便 DNA 提取及亚硫酸盐转化:根据试剂盒说明书,利用粪便DNA 提取试剂盒从粪便样本(180~220 mg)中提取DNA。同时通过PCR 扩增验证DNA提取质量。然后采用亚硫酸氢盐转化试剂盒将对基因DNA 进行修饰,将未发生甲基化的胞嘧啶转化为尿嘧啶,而甲基化的胞嘧啶保持不变。③实时荧光定量PCR测定SDC2:采用实时荧光定量PCR SDC2甲基化含量,PCR反应体系为25 μl,包括:TaKaRa EpiTaq HS(5 U/μl)0.125 μl,10×EpiTaq PCR Buffer(Mg2+free)2.5 μl,25 mmol/L MgCl22.5 μl,dNTP Mixture 3 μl,正向引物 1 μl,反向引物1 μl,模板 DNA 2 μl。反应条件:95℃,5 min;95℃,30 s;54~62℃,30 s;72℃,30 s;40个循环;72℃,10 min。 EpiTect PCR 对照组DNA作为阳性对照。扩增产物在3%琼脂糖凝胶中进行电泳分离,然后进行凝胶成像。
1.3观察指标:比较三组患者单独检测SDC2、CEA及联合检测的阳性率。同时通过ROC扩增曲线分析单独检测及联合检测的灵敏度和特异度。

2 结果
2.1三组患者粪便SDC2、CEA及联合检测阳性率比较:结直肠癌组、结直肠瘤组和健康对照组患者SDC2检测的阳性率分别为67.19%、55.19%和11.67%;CEA检测的阳性率为39.06%、17.24%和8.33%;联合检测的阳性率则分别是82.81%、58.62%和13.33%,差异均有统计学意义(P<0.05)。见表1。

表1 三组患者粪便SDC2、CEA及联合检测阳性率比较
2.2粪便SDC2基因、血清CEA、联合检测诊断结直肠癌ROC曲线分析:ROC曲线分析发现,SDC2基因检测诊断结直肠癌AUC为0.629(95%CI:0.474~0.783),血清CEA水平诊断结直肠癌AUC为0.512(95%CI:0.357~0.632),联合检测诊断结直肠癌AUC 是0.782(95%CI:0.642~0.856)。联合诊断结直肠癌的AUC值最高,与单独SDC2、CEA检测比较差异有统计学意义(P<0.05)。见图1。
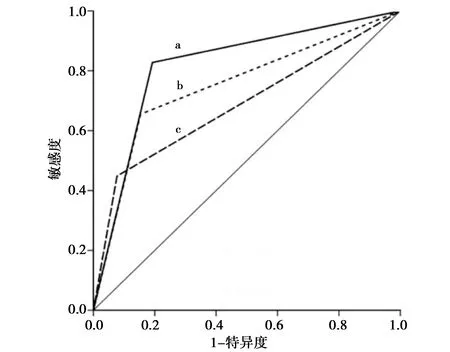
图1 粪便SDC2基因、血清CEA、联合检测诊断结直肠癌ROC曲线分析
3 结论
结直肠癌是一种严重威胁人类身体健康及生命安全的恶性肿瘤,常见于中老年人,其发病率在全球男性肿瘤中居第三位,女性肿瘤中居第二位[4]。近年,随着人们生活水平的提高和饮食结构的改变,我国直肠癌发病率和死亡率逐渐升高,并且呈年轻化趋势;每年死于结直肠癌患者人数高达数十万;而欧美发达国家结直肠癌的死亡率较我国明显降低,主要归因于大规模的结直肠癌普查,对癌前病变进行治疗干预,实现了结直肠癌的早期检测和一级预防[6]。结直肠癌的发病进展较为缓慢,早期多见结直肠黏膜病变,进而演变为腺瘤性息肉,最后发展为恶性肿瘤。若能够早发现一级预防,二级定期筛查和三级治疗,可有效促进患者预后。然而,大多数患者早期无明显症状和临床体征,同时由于缺少早期诊断,有明显症状时就诊已处于中晚期,结直肠癌患者甚至已有远处转移。因此,早诊断、早发现、早治疗提高患者的生存率,促进预后具有重要意义。
有研究发现,结直肠癌患者粪便/血液中肿瘤相关基因的改变是组织癌变的重要原因之一,其中DNA甲基化情况在结直肠癌诊断及预后具有重要指导意义[5]。学者们发现越来越多游离DNA中某些特定基因甲基化可作为结直肠癌早期诊断、预后等方面的生物标志物,如PCDH10、Septin9、RASSF2、sFPR1、SDC2等,在肿瘤的早期筛选及诊断中应用较多。结直肠癌患者术后特定基因TAC1 甲基化水平会逐渐下降,但复发时DNA 甲基化水平显著上升,可用来辅助评判结直肠癌治疗效果[6]。无创粪便SDC2基因甲基化也有报道,但联合血清CEA在结直肠癌中的诊断效能如何未见报道,本文就SDC2基因甲基化联合血清CEA检测分析评估对结直肠癌的诊断价值。本研究结果显示,结直肠癌组、结直肠瘤组及健康对照组的SDC2基因甲基化阳性检出率分别为 67.19%、55.17% 及 11.67%,说明结直肠癌组SDC2基因甲基化的阳性检出率高于结直肠瘤组和对照组,提示结直肠癌患者粪便中SDC2基因甲基化水平明显升高,差异有统计学意义(P<0.05)。结直肠癌组、结直肠瘤组及健康对照组患者的SDC2与CEA联合检测的阳性率分别为82.81%、58.62%及13.33%,联合检测中结直肠癌阳性检出率显著增加,差异有统计学意义(P<0.05),提示提示联合检测对结直肠癌的诊断效能优于单独检测。现阶段单一基因检测结直肠癌的灵敏度偏低,容易出现误诊或漏诊[7]。目前,已有研究证实,SDC2基因甲基化在结直肠癌诊断中具有较高的灵敏度和特异度[8-9]。本文ROC 曲线分析发现,联合诊断结直肠癌的AUC值为0.782,显著高于单独SDC2甲基化和血清CEA水平检测,因此在早期筛查中进行联合检测对提高结直肠癌诊断的灵敏度、特异性,将获益更大[10]。
综上所述,无创粪便SDC2基因甲基化联合血清CEA可有效提高结直肠癌的检出率和诊断准确性,且具有无创、方便、诊断效能高等优点,临床上值得推广。
