卵蛋白源胰脂肪酶抑制肽的制备及其对小鼠体质量控制效果
2021-07-24武雅珍焦明雅李志成
王 璐, 武雅珍, 焦明雅, 李志成
(西北农林科技大学 食品科学与工程学院,陕西 杨凌712100)
近年来,肥胖发生率呈快速上升趋势。据统计,全球肥胖患者的增长速度为每5年翻一番,每年因肥胖引起的直接或间接死亡人数已达30万,肥胖已成为仅次于吸烟之后的第二个健康危险因素[1],肥胖也是继癌症和心脑血管疾病之后威胁人类健康的第三大疾病[2]。肥胖和饮食密切相关,当人体摄入食物的热量大于消耗量时,多余的热量会转变为脂肪,在体内积聚形成肥胖[3],食物脂肪的过量摄入会增加发生肥胖的风险。因此,控制饮食中脂肪的摄入和机体对于脂肪的吸收对改善肥胖有重要作用[4-5]。
机体摄食后,胰脂肪酶将膳食脂肪水解为单酰甘油和游离脂肪酸[6],在肠道内再吸收,合成新的脂肪[7]。胰脂肪酶抑制剂可有效抑制胰脂肪酶活性,降低胰脂肪酶对脂肪的分解作用,减少脂肪再合成,抑制机体内脂肪过度堆积,发挥控制、治疗肥胖的作用[8]。目前,奥利司他(Orlistat)是市场上被广泛认同和购买使用的胰脂肪酶抑制剂类减肥药物,但具有失眠、乏力、增加心率,甚至心律失常、心力衰竭、猝死等副作用[9]。因此,研发具有减肥作用的药物和辅助减肥的功能性食品已成为食品生物技术界、营养学界研究的热点。
我国鸡蛋生产总量超过了世界生产总量的1/3,但目前关于鸡蛋的深加工较少,鸡蛋的综合利用率较低[10-12]。作者以卵蛋白为原料,采用酶工程技术制备卵蛋白源胰脂肪酶抑制肽 (Pancreatic lipase inhibitory peptide from albumin,PLIPA),研究其对猪胰脂肪酶的抑制作用,并通过建立营养型肥胖小鼠模型,研究PLIPA对肥胖小鼠的体质量控制效果,为研发减肥功能食品提供依据。
1 材料与方法
1.1 材料与试剂
新鲜鸡蛋:购于陕西省杨凌示范区主要超市。
胰蛋白酶:北京索莱宝科技有限公司产品;碱性蛋白酶、中性蛋白酶、木瓜蛋白酶、胃蛋白酶:西安热默尔生物科技有限公司产品;猪胰脂肪酶、对硝基苯酚棕榈酸酯:上海阿拉丁生化科技股份有限公司产品;奥利司他:萨恩化学技术有限公司产品;茶多酚:北京赛多利斯仪器系统有限公司产品;L-阿拉伯糖:山东福田药业有限公司产品;原花青素:上海文森生物科技有限公司产品;茶多酚:山东福瑞达医药集团有限公司产品;总胆固醇(TC)、甘油三酯(TG)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)等试剂盒:南京建成生物工程研究所有限公司产品;其他试剂均为国产分析纯。
1.2 实验动物及饲料
7周龄C57BL/6J小鼠,由斯贝福(北京)生物技术有限公司提供,经中国食品药品鉴定研究院检测质量合格,实验动物使用证号为SCXK(京)2016-0002。
高脂饲料组分(质量分数):猪油10%,胆固醇1%,胆酸钠0.5%,蔗糖10%,基础饲料78.5%。
1.3 仪器与设备
UV-1700双光束紫外光分光光度计:日本岛津公司产品;LGJ-25C真空冷冻干燥机:北京四环仪器厂制造;JA3003型电子天平:北京赛多利斯科学仪器有限公司产品;Z216MK台式高速冷冻离心机:德国Hermle公司产品;Victor X3多功能酶标仪:美国PE公司产品。
1.4 实验方法
1.4.1 PLIPA的制备
1)制备卵蛋白粉 将新鲜鸡蛋洗净,消毒后分离蛋清,真空冷冻干燥成粉,保存备用。采用GB/T 5009.5—2010凯氏定氮法[13]测定其粗蛋白质质量分数为80.85%。
2)筛选水解卵蛋白粉最佳蛋白酶 参照刘爽的方法进行水解[14],将卵蛋白粉配成蛋白质质量浓度80 g/L溶液,沸水浴20 min使蛋白质变性,冷却至反应温度后放入水浴锅,调节pH至最适条件(见表1),加入蛋白酶水解3 h,煮沸10 min灭活,冷却至室温,5 000 r/min离心20 min,取上清液(PLIPA)测定对胰脂肪酶活性的抑制率或在-20℃冷冻保存,根据抑制率的高低筛选出最佳蛋白酶。
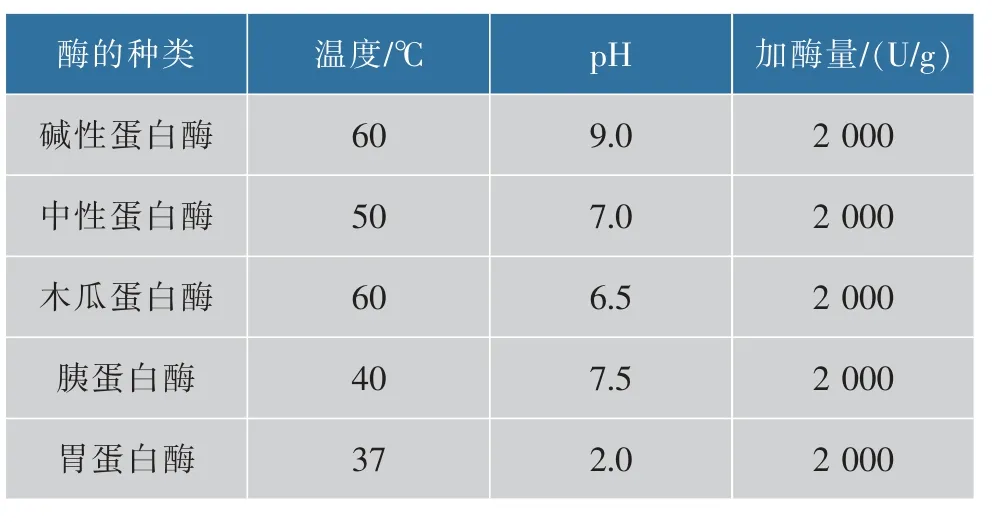
表1 5种蛋白酶适宜水解参数Table 1 Optimum hydrolysis parameters of five proteases
3)优化制备PLIPA以PLIPA对胰脂肪酶活性的抑制率为指标,分别研究最佳蛋白酶在最适pH条件下水解时间(酶解时间)、加酶量和水解温度(酶解温度)等工艺参数对其水解效果的影响,以获得具有较高抑制脂肪酶活性作用的PLIPA。通过单因素实验筛选各个因素的水平范围值,采用响应面方法和利用Desigh-Expert软件进行三因素三水平Box-Behnken Desigh(BBD)中心组合实验设计[15-17],优化制备PLIPA的最佳工艺参数。
4)卵蛋白源活性肽对胰脂肪酶的抑制率测定参照Zheng和雷启义的方法测定[18-19]。经测定,对硝基苯酚标准曲线方程为y=4.641 3x-0.024 9,R2=0.999 3。
参照Gómez-ruiz[20]方法进行模拟胃肠液消化实验。参照鲁伟[21]的方法测定多肽含量,将Gly-Gly-Tyr-Arg四肽修改为氧化型谷胱甘肽(GSSG),经测定,GSSG质量浓度与吸光度的标准曲线方程为y=8.481 1x,其中R2=0.997 9。
对于金融业而言,大量的用户、长期的运营产生了海量的数据,包括存款贷款、客户信息、理财投资等。通过人工智能技术进行数据分析,可以更有效地勾勒用户画像,制订个性化、智能化的客户方案,提供友好的智能客服助手,从而达到提升用户粘性和吸引新的优质客户的目标。在互联网+金融的背景下,金融服务会更多依赖信用机制,以降低呆账、坏账的概率,实现风险控制。例如蚂蚁金服将人工智能应用到互联网小贷、保险、征信、理财、客户服务等多个领域,将虚假交易率降低了近10倍。芝麻信用通过分析用户在阿里巴巴业务体系内的行为得出不同芝麻分,并放以不同金额的消费贷款。
1.4.2 PLIPA对肥胖小鼠的体质量控制效果
1)实验分组 48只C57BL/6J小鼠用基础饲料适应性饲喂3 d后按体质量分为6组:正常对照组,肥胖模型对照组,阳性药物组,PLIPA低、高剂量组和复合组。除正常组给予基础饲料喂养外,其余5组以高脂饲料饲喂(高脂组),以所有高脂组体质量均值>(正常组均值+2×标准误差)来判断造模是否成功[22]。造模成功后,各组饲料维持不变,每天同一时间灌胃给药10μL/g(以体质量计),正常组、肥胖模型组灌胃等体积生理盐水;阳性药物组(奥利司他),PLIPA低、高剂量组分别给药剂量60、400、800 mg/(kg·d),复合组剂量400 mg/(kg·d)(复合组中m(茶多酚)∶m(PLIPA)∶m(原花青素)∶m(L-阿拉伯糖)=4∶3∶2∶1)。实验期间,小鼠自由摄食饮水,每5 d称一次体质量,连续给药28 d后取血、解剖。
2)指标测定 给药结束后,禁食12 h,称体质量,眼眶采血。血液室温放置1 h,在4℃冰箱放置30 min,3 000 r/min离心10 min,收集血清,参照试剂盒说明测定TG、TC、HDL-C及LDL-C含量。采用颈椎脱臼处死小鼠,将小鼠平摊仰卧,用直尺准确测量小鼠鼻尖至肛门的长度为体长。解剖后,观察小鼠体内脏器变化及脂肪沉着情况,取腹部与皮下脂肪和肝脏,称质量,计算Lee′s指数、腹部与皮下脂肪系数、肝指数[23-24],计算公式分别如下:

式中:I1为Lee′s指数;I2为腹部脂肪系数;I3为皮下脂肪系数;I4为肝指数;M为小鼠体质量,g;L为体长,cm;Ma为腹部脂肪湿质量,g;MS为皮下脂肪湿质量,g;M1为肝脏湿质量,g。
1.4.3 数据处理与统计分析 体外每组实验做3个重复,结果以“平均值±标准偏差(X±SD)”的形式表示,使用Origin 8.5软件进行数据统计和图表绘制,采用SPSS 20.0统计软件对有关数据进行显著性分析,必要时结合最小显著差数检验(LSD.test)进行分析,P<0.05认为统计学差异显著。
2 结果与分析
2.1 卵蛋白水解酶的筛选
卵蛋白中所含多种特定生物活性肽的序列,能否被释放出来并表现其生物活性,关键在于所选酶的种类、水解时间、加酶量及温度[25]。经测定未被水解的卵蛋白(空白组)对胰脂肪酶的抑制率为(13.60±0.43)%,5种蛋白酶的卵蛋白源活性肽对胰脂肪酶的活性均表现出抑制作用(见表2)。除胃蛋白酶外,各蛋白酶的PLIPA对胰脂肪酶的抑制率均高于未被水解的卵蛋白对胰脂肪酶的抑制率,经差异显著性分析,中性蛋白酶、碱性蛋白酶和胃蛋白酶的PLIPA对胰脂肪酶的抑制率与未被水解的卵蛋白对胰脂肪酶的抑制率存在显著性差异(P<0.05),碱性蛋白酶的PLIPA对胰脂肪酶的抑制率显著高于其他酶(P<0.05),为(49.77±0.10)%,胃蛋白酶的PLIPA对胰脂肪酶的抑制率最小,仅为(6.46±6.79)%。可能是不同的酶对卵蛋白的作用位点不同,胃蛋白酶主要倾向于剪切氨基端或羧基端芳香族氨基酸或亮氨酸的肽键[26]。胰蛋白酶与木瓜蛋白酶主要的水解位点相似,为精氨酸或赖氨酸的羧基端,因此其对胰脂肪酶的抑制率也接近[27]。中性蛋白酶催化位点多,特异性较差,以水解芳香族疏水性氨基酸残基作为羧基端肽键为主[28]。碱性蛋白酶作用范围较广,作用位点倾向于羧基侧具有芳香烃或疏水性的氨基酸,比中性蛋白酶具有更大的水解能力和耐碱力,有较强的耐热性且具有一定的酯酶活力[28],最终选用碱性蛋白酶水解卵蛋白制备PLIPA。
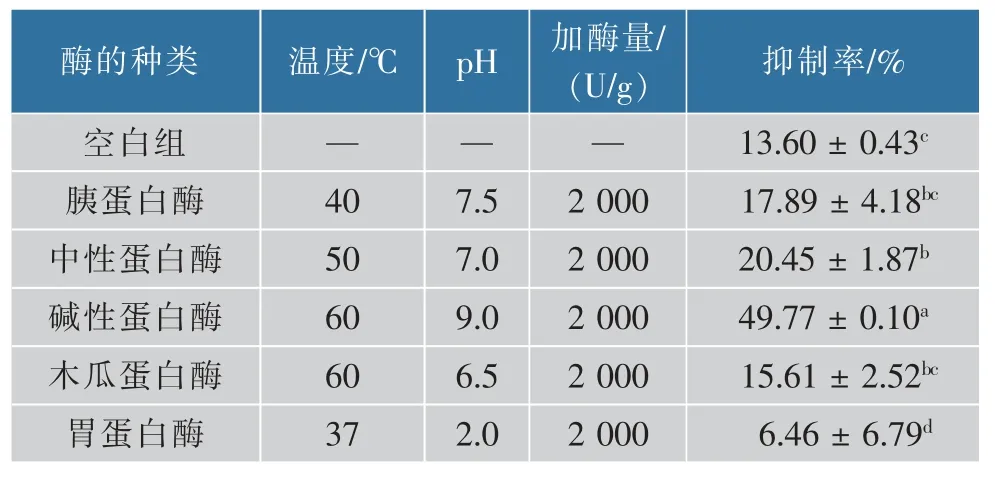
表2 5种蛋白酶的卵蛋白源活性肽对胰脂肪酶的抑制效果Table 2 Inhibitory effect of active peptides from ovalbumin hydrolyzed by five proteases on pancreatic lipase
2.2 碱性蛋白酶水解卵蛋白单因素实验
2.2.1 水解时间 由图1可知,PLIPA对胰脂肪酶的抑制率随水解时间先增大后减小,在3 h时,抑制率最大,随后呈下降趋势。其原因可能是随着水解时间的延长,水解液中具有抑制胰脂肪酶功能的肽类被降解,致使其对胰脂肪酶的抑制率下降。初步选取水解时间为3 h进行下一步实验。

图1 水解时间对卵蛋白源活性肽抑制胰脂肪酶效果的影响Fig.1 Effect of hydrolysis time on pancreatic lipase inhibitory rate of active peptides from ovalbumin
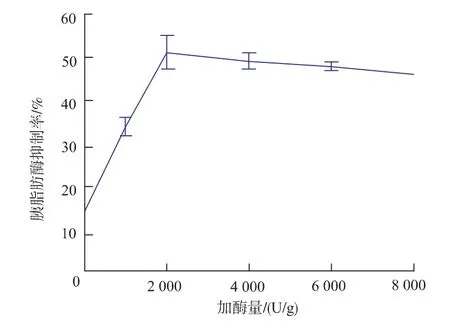
图2 加酶量对卵蛋白源活性肽抑制胰脂肪酶效果的影响Fig.2 Effect of additive amount on pancreatic lipase inhibitory rate of active peptides from ovalbumin
2.2.3 水解温度 由图3可以看出,PLIPA对胰脂肪酶的抑制率随水解温度的升高呈现先增大后减小的趋势,在60℃时,抑制率达到最大值,且与其他温度具有显著差异(P<0.05);在45~60℃范围内,温度升高,分子间运动加剧,酶与底物间的接触机会增加,水解产生活性肽的速率增大;当温度高于60℃时,酶的活性因高温逐渐降低,底物水解水平降低,产生活性肽的速率减小,对胰脂肪酶的抑制率随之降低。初步确定卵蛋白的水解温度为60℃。
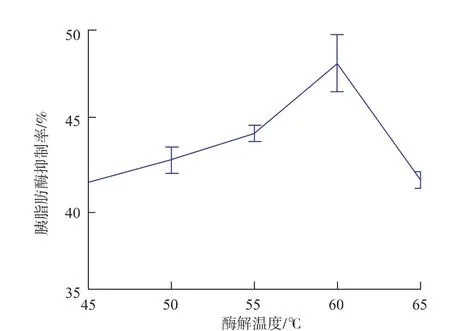
图3 水解温度对卵蛋白源活性肽抑制胰脂肪酶效果的影响Fig.3 Effect of enzymatic hydrolysis temperature on pancreatic lipase inhibitory rate of active peptides from ovalbumin
2.3 卵蛋白水解工艺的响应面优化实验
根据单因素结果,设计响应面实验(见表3)。用自变量X1、X2、X3分别表示水解时间、加酶量、水解温度,以PLIPA对胰脂肪酶的抑制率为响应值Y,结果见表4。

表3 响应面实验因素与水平设计Table 3 Factors and level design for response surface experiment
将表4中的数据进行多元回归拟合,得到回归方程:Y=51.79+2.55X1+0.79X2+3.19X3+1.74X1X2+1.02X1X3+0.63X2X3+1.54X12-1.99X22+0.53X32。由表5知,该回归方程模型的P=0.008 4<0.01,模型极显著,失拟项P=0.241 7>0.05,差异不显著,说明模型可靠。各因素对PLIPA抑制胰脂肪酶的效果影响大小为水解温度>水解时间>加酶量。一次项中水解温度、时间对PLIPA抑制胰脂肪酶的效果极显著(P<0.01),加酶量影响不显著,交互项均不显著;二次项中仅加酶量显著。可知水解温度对PLIPA抑制胰脂肪酶的效果影响最大,控制好水解温度对获得具有高胰脂肪酶抑制活性的PLIPA至关重要。

表4 响应面分析方案及实验结果Table 4 Analysis scheme and experimental results for response surface

表5 回归模型方差分析Table 5 Analysis of variance of regression model
由图4可知,PLIPA对胰脂肪酶的抑制率随水解时间的增大而增大,随水解温度的升高而减小,随加酶量的增加先增大后减少。结合回归模型,利用Design-Expert.V 8.0.6软件得出制备PLIPA的最佳工艺条件为:水解时间4 h,加酶量2 240 U/g,温度55℃,此时对胰脂肪酶抑制率预测值为59.04%。经3次平行实验测得对胰脂肪酶抑制率为(56.06±2.64)%,与预测值接近,说明建立模型准确可靠,在最优水解条件下,可制备PLIPA。

图4 各因素交互作用对胰脂肪酶抑制率的影响Fig.4 Interactive effects of various factors on the pancreatic lipase inhibitory rate
2.4 PLIPA模拟胃肠液消化实验
PLIPA经模拟胃液消化后,对胰脂肪酶的抑制率差异不显著(P>0.05);经模拟胃液消化再经过模拟肠液消化后,其每毫克肽对胰脂肪酶的抑制率显著降至0.46%(P<0.05),但胰脂肪酶抑制率为(43.38±0.02)%(见表6),达到预期效果,说明PLIPA在模拟胃肠道消化后仍具有较高的胰脂肪酶抑制活性。

表6 PLIPA模拟胃肠液消化后对胰脂肪酶的抑制率Table 6 Pancreatic lipase inhibitory rate of PLIPA after simulate gastrointestinal digestion
2.5 PLIPA对肥胖小鼠的影响
2.5.1 PLIPA对小鼠体质量和Lee′s指数的影响实验开始前小鼠平均体质量(19.00±2.00)g,组间差异不显著(P>0.05)。建模40 d,高脂饲料喂养组体质量均值27.04 g>(正常对照组均值+2×标准误差)20.00 g,且高脂组均显著高于正常组(P<0.01),说明建模成功。小鼠初始体质量、给药初与给药28 d后小鼠体质量平均值和Lee′s指数变化结果如表7。
经统计学分析,各处理组与肥胖模型组在摄食量方面差异不显著(P>0.05),表明灌胃操作对小鼠摄食量影响不大。由表7可知,建模成功后,高脂饲料喂养小鼠体质量均显著高于正常组(P<0.05)。给药28 d后,与肥胖模型组相比,各处理组体质量均有下降,表明灌胃PLIPA对减轻小鼠体质量有一定控制作用,其中PLIPA复合组的体质量显著低于肥胖模型组(P<0.05)。徐方旭等[30]研究原花青素对肥胖小鼠的脂解作用,结果表明,不同剂量的原花青素均能降低肥胖昆明小鼠的体质量,150 mg/(kg·d)原花青素在降低小鼠体质量方面效果最佳,小鼠体质量降低量为4.0 g。吴建章等[31]研究了L-阿拉伯糖对营养型大鼠的减肥效果,发现给药L-阿拉伯糖低、高剂量组(给药剂量分别为1.5、3 g/(kg·d)),饲养20、40 d后,体质量均明显降低,低剂量组给药20、40 d体质量分别降低72.8、81.5 g,高剂量组给药20、40 d分别降低132.8、161.5 g。连丽娜等[32]以昆明种小白鼠为研究对象,研究茶多酚对小鼠营养性肥胖的预防及减肥作用,减肥组分低、中、高剂量组,给药剂量分别为200、400、600 mg/(kg·d),给药茶多酚第45天,经与肥胖模型组相比,发现低、中、高剂量组小鼠体质量差异不显著,给药第90天,中、高剂量组显著降低,体质量分别降低10.7、11.8 g,而本研究中PLIPA低、高剂量组差异不显著,可能是给药剂量偏低或给药时间偏短导致。另外,PLIPA复合组Lee′s指数相对于肥胖模型组显著降低(P<0.01),表明PLIPA复合物对塑造高脂小鼠良好体形作用显著。PLIPA低、高剂量及复合组与阳性药物组无显著差异性,表明给药PLIPA可达到与阳性药物同样的效果,甚至较奥利司他控制体质量效果更好。
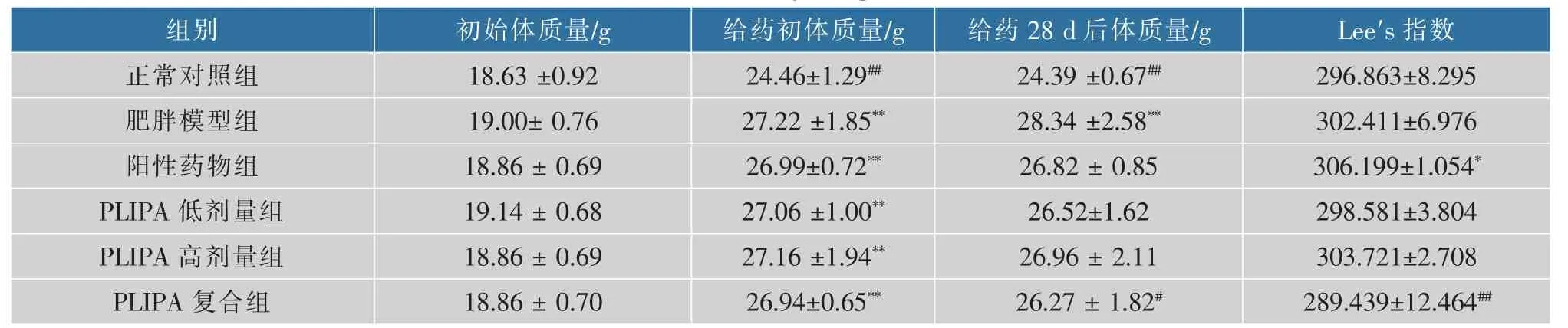
表7 PLIPA对小鼠体质量及Lee′s指数影响Table 7 Effects of PLIPA on body weight and Lee′s index in mice
2.5.2 PLIPA对小鼠脂肪系数和肝指数的影响 与正常组小鼠相比,高脂喂养的小鼠腹部脂肪湿质量、腹部与皮下脂肪系数和肝指数均升高(见表8),其中PLIPA复合组脂肪湿质量较肥胖模型组显著降低(P<0.05)。与肥胖模型组相比,PLIPA处理组、复合物组与阳性药物组的腹部脂肪系数降低,表明PLIPA及其复合物对高脂喂养小鼠的腹部脂肪具有控制作用。与正常组相比,阳性药物组及PLIPA低、高剂量组、复合物组的皮下脂肪系数显著升高(P<0.05),表明高脂饮食可使小鼠皮下脂肪堆积。与肥胖模型组相比,PLIPA低、高剂量组及复合组肝指数有所降低,其中,PLIPA高剂量组肝指数存在极显著差异(P<0.01),PLIPA高剂量可控制因肥胖导致肝指数的异常,且与阳性药物效果相当,说明PLIPA可一定程度抑制小鼠体内的脂肪堆积,对体质量有控制作用。
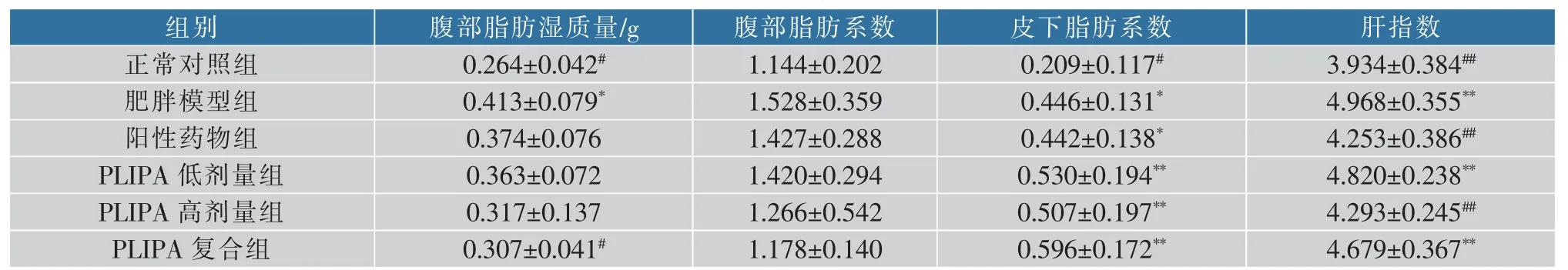
表8 PLIPA对小鼠脂肪湿重及脂肪系数、肝系数的影响Table 8 Effects of PLIPA on fat wet weight,fat and liver coefficient in mice
2.5.3 PLIPA对小鼠血液指标的影响 与正常组相比,各高脂组小鼠血脂4项指标TC、TG、HDL-C和LDL-C均升高(见表9)。给药阳性药物、PLIPA及复合物的处理组,4项指标相比肥胖模型组均降低,表明给药PLIPA可以控制高脂小鼠血脂指标的上升,其中,PLIPA复合组对LDL-C指标的控制存在显著作用(P<0.05)。

注:表中*表示与正常对照组相比,P<0.05差异显著,**表示P<0.01差异极显著;#表示与肥胖模型对照组相比,P<0.05差异显著,##表示P<0.01差异极显著。
3 结语
制备卵蛋白源胰脂肪酶抑制肽(PLIPA)的最佳蛋白酶是碱性蛋白酶,最佳工艺条件是在底物质量浓度80 g/L的卵蛋白,加入碱性蛋白酶2 240 U/g,55℃、pH 9.0条件下酶解4 h,PLIPA对胰脂肪酶抑制率达(56.06±2.64)%。PLIPA经胃肠液消化后,对胰脂肪酶的抑制率有所降低但仍可达到预期。小鼠动物实验表明,PLIPA低、高剂量及复合组均不同程度控制体质量增长以及脂肪的堆积,达到控制小鼠体形和体质量的目的,且随着给药剂量的增大,控制体质量的作用更为明显。另外,与PLIPA低、高剂量组相比,PLIPA与L-阿拉伯糖、茶多酚、原花青素复合组对小鼠体质量、体形控制效果最佳。需注意的是PLIPA黏性较大,容易堵塞分离柱,未能鉴定出具有抑制脂肪酶酶活的活性肽的结构,需待进一步研究。
