羊骨抗氧化肽酶解法制备和响应面工艺优化
2021-07-24陈晓雨赵丽华王英丽张忠海
张 靖, 苏 琳, 陈晓雨, 要 铎, 赵丽华, 王英丽, 张忠海, 靳 烨*
(1.内蒙古农业大学 食品科学与工程学院,内蒙古 呼和浩特010018;2.内蒙古澳菲利食品股份有限公司,内蒙古 巴彦淖尔015000)
自由基与人的衰老以及很多疾病有关。机体各系统正常运行时,体内氧化还原反应会产生内源性自由基;机体细胞在光氧化、辐射、农药、抗癌药物、重金属、防腐剂等刺激下会产生外源性自由基;食物中杂质和油脂的氧化、吸烟、过度暴晒和环境污染等都会激发过量的自由基[1]。体内细胞自由基产生和消除的动态平衡靠氧化还原酶系统和非酶还原剂共同调节[2]。当自由基的产生不受生理调控,抗氧化酶系统受损,小分子抗氧化剂耗尽时,自由基会单纯增加,导致氧化应激发生,DNA、蛋白质等生物分子被破坏,人体内生物膜受损,遗传信息改变,细胞膜流动性丧失以及酶失活,引起衰老,导致癌症,并促进老年痴呆、中风等疾病的发生,甚至造成死亡[3]。为了防止氧化应激造成的危害,各种抗氧化剂的研究和开发已成为化学工程和生物工程领域的热点。目前使用的化学合成抗氧剂虽能抑制油脂氧化,但对人体健康存在隐患,使用受到限制[4]。因此人们逐渐将关注点转向从食源性动物蛋白质和植物组织中提取天然抗氧化剂。国内外研究人员已从虾[5]、海参[6]、羊肉[7]、猪皮[8]、大米[9]、油 菜籽[10]、鸡蛋清[11]、玉米[12]、豌豆[13]、杏鲍菇[14]等动植物来源的蛋白质中提取出了具有抗氧化活性的肽类物质。食物蛋白质来源的抗氧化肽安全性高,且具有相对分子质量小、热稳定好、易吸收的特点,作为机体的食品认定抗氧化剂,是近年来热门的研究课题[15]。
作为羊肉加工的主要副产物,羊骨本身营养价值丰富,含有矿物质、维生素、软骨素等营养物质,所含蛋白质高达25%,氨基酸种类丰富且必需氨基酸(赖氨酸、亮氨酸等)含量高,是一种高营养廉价易得的肉类加工副产物[16]。长期以来,人们对羊骨的加工仅限于熬汤补钙、制骨胶,其次就是做成动物饲料,羊骨生物活性物质还未被深入研究。因此,本文中以羊骨为原料,通过酶解法制备羊骨抗氧化肽,以多肽生成量及羟自由基(·OH)清除活性为评价指标,经单因素实验和响应面分析确定了最佳酶解工艺条件,通过超滤分离获得高活性的抗氧化组分,并对不同相对分子质量的肽段进行氨基酸含量分析。旨在合理利用废弃羊骨开发功能性食品,为研究羊骨抗氧化肽的活性、分离纯化及生产提供一定的依据,提高资源综合利用水平及产业附加值。
1 材料与方法
1.1 材料与试剂
新鲜羊骨:内蒙古澳菲利食品股份有限公司提供。
风味蛋白酶(30 000 U/g)、胰蛋白酶(250 000 U/g)、碱性蛋白酶(200 000 U/g)、木瓜蛋白酶(1 200 000 U/g)、中性蛋白酶(60 000 U/g):北京酷来搏科技有限公司产品;2,2-联苯基-1-苦基肼基(2,2-Diphenyl-1-picrylhydrazyl,DPPH·):美 国Sigma公司产品;3 000和10 000超滤离心管:北京索莱宝科技有限公司产品;三氯乙酸(TCA)、硫酸亚铁、过氧化氢、水杨酸、铁氰化钾、三氯化铁等均为国产分析纯。
1.2 仪器与设备
安全智能型反压高温蒸煮锅:北京发恩科贸有限公司产品;GZX-9076MBE数显鼓风干燥箱:上海一恒仪器有限公司产品;高速万能粉碎机:广州雷迈机械厂制造;pH计:PB-10SArtorius公司产品;SHA-B恒温水浴振荡器:常州国华电器有限公司产品;5810-R型低温台式冷冻离心机:德国Eppendorf公司产品;TU-1810型紫外/可见光分光光度计:北京普析通用仪器有限公司产品;LA8080超高速全自动氨基酸分析仪:日本日立公司产品;LCJ-25C型冷冻干燥机:北京四环科学仪器厂有限公司产品;KDY-9830凯氏定氮仪:北京市通润源机电技术有限责任公司产品。
1.3 方法
1.3.1 羊骨预处理
1)羊骨粉制备工艺 羊骨→解冻→沸水煮15 min→剔除非骨骼成分(羊肉、筋腱、软骨及其他膜性组织)→冲洗→高压蒸煮(羊骨与蒸馏水质量比为1∶1,125℃,30 min)→去上层脂肪→冲洗→干燥(110℃,6 h)→粉碎→过80目筛(于-20℃下保存)。
2)羊骨粉脱脂工艺 羊骨粉→加无水乙醇混匀(羊骨粉质量与无水乙醇体积比为1 g∶5 mL)→搅拌(室温,24 h,每8 h左右换一次样液)→离心(4℃,3 000 r/min,15 min)→取沉淀→冲洗→烘干(60℃)→保存酶解备用(-20℃)。
1.3.2 酶解工艺流程 脱脂羊骨粉→按一定料液比加蒸馏水混匀→杀菌(0.1 MPa,121℃,15 min)→冷却(至40℃以下)→调节pH→加酶→水浴酶解→灭酶(100℃,10 min)→冷却→离心(4℃,8 000 r/min,15 min)→上清液减压抽滤(0.45μm水系滤膜)→多肽溶液。
1.3.3 蛋白酶的筛选 选取酶解基准条件为骨粉质量分数6%,酶添加量8 000 U/g,酶解时间3 h,酶解温度50℃,选用5种蛋白酶(风味蛋白酶pH 6、胰蛋白酶pH 8、碱性蛋白酶pH 9、木瓜蛋白酶pH 7、中性蛋白酶pH 7)分别对脱脂羊骨粉进行水解。以多肽生成量结合羟自由基(·OH)清除活性为指标,筛选出合适的蛋白酶。
1.3.4 羊骨多肽单因素实验设计 采用碱性蛋白酶水解脱脂羊骨粉制备抗氧化肽,以多肽生成量结合羟自由基(·OH)清除活性为指标进行单因素实验设计。分别固定其他因素,依次评价骨粉质量分数(4%、6%、8%、10%、12%)、酶添加量(4 000、6 000、8 000、10 000、12 000 U/g)、pH(8.0、8.5、9.0、9.5、10.0)、酶 解 温 度(40、45、50、55、60℃)、酶 解 时 间(2、3、4、5、6 h)对脱脂羊骨粉酶解效果的影响。
1.3.5 羊骨多肽响应面实验优化 在单因素实验的基础上,固定酶解温度50℃,以·OH清除率为响应值(Y),以酶解pH(A)、酶添加量(B)、酶解时间(C)、骨粉质量分数(D)为自变量。根据Box-Behnken中心组合实验设计原理,设计四因素三水平响应面实验,实验因素与水平设计见表1。

表1 响应面分析因素水平表Table 1 Factors and levels of response surface analysis
1.3.6 多肽生成量的测定 参考李珂的方法进行测定[17]。
1.3.7 羊骨多肽液的体外抗氧化活性测定 采用水杨酸法测定样品·OH清除活性[18],DPPH法测定样品DPPH·清除活性[19],Fe3+还原能力的测定参考田旭静的方法[20]。
1.3.8 超滤工艺制备梯级肽 通过响应面优化将最优条件下制备的酶解液进行离心(4℃,8 000 r/min,15 min)和过滤。将滤液经截留相对分子质量为3 000和10 000的超滤管进行超滤分离(4℃,3 000 r/min,30 min),得到3种不同相对分子质量的多肽组分(组分Ⅰ,Mr≤3 000;组分Ⅱ,3 000
1.3.9 氨基酸分析测定 采用响应面优化的条件制备羊骨多肽,冷冻干燥。通过酸水解法测定脱脂羊骨粉和多肽液及其超滤组分氨基酸含量。分别准确称取50 mg(含10~20 mg蛋白质)不同组分的样品,用15 mL 6 mol/L HCl溶解,110℃条件下酸水解22 h,冷却后过滤,用0.02 mol/L HCl定容至25 mL。取1 mL过滤液,60℃氮气吹干,加入0.02 mol/L HCl(去离子水配制)漩涡振荡至充分溶解,用0.22μm滤膜(水膜)过滤,最后采用LA8080超高速全自动氨基酸分析仪进行氨基酸测定。
1.4 数据处理与统计分析
所有实验均重复3次,实验数据以X±SD表示。采用Design-Expert v8.0.6软件进行响应面实验设计和数据分析,采用GraphPad Prism 5软件作图,IBM SPSS Statistics19软件对数据进行单因素方差分析(ANOVA),显著性分析采用Duncan检验。
2 结果与分析
2.1 蛋白酶筛选
多肽的抗氧化活性和酶解所用蛋白酶种类有关,不同蛋白酶对肽键的作用位点不同,所产生的多肽具有不同C端、N端和相对分子质量。一些研究表明,C端具有大分子疏水性氨基酸时,多肽表现出高抗氧化活性,因此筛选适宜的蛋白酶是该实验的关键步骤[21]。如图1所示,在相同酶活力条件下,5种蛋白酶水解产物的抗氧化能力存在显著差异。其中,碱性蛋白酶水解产物的·OH清除率最大,酶解3 h后,其·OH清除率达(78.37±2.29)%,然后依次是木瓜蛋白酶(45.67±3.22)%、风味蛋白酶(40.42±5.61)%、胰蛋白酶(36.3±2.57)%和中性蛋白酶(19.05±3.52)%。碱性蛋白酶水解产物的多肽生成量也最高,为(111.86±0.25)mg/g(以骨蛋白质计)。碱性蛋白酶酶解产物的抗氧化活性最佳且多肽生成量最高,因此可以作为制备羊骨抗氧化肽的首选蛋白酶。

图1 5种蛋白酶的酶解效果Fig.1 Enzymatic hydrolysis effect of five proteases
2.2 酶解工艺的单因素实验
2.2.1 骨粉质量分数对酶解物多肽生成量及抗氧化活性的影响 固定酶添加量8 000 U/g,pH 9.0,酶解温度50℃,酶解时间3 h,研究不同骨粉质量分数(4%、6%、8%、10%、12%)对脱脂羊骨粉蛋白质酶解物多肽生成量及·OH清除活性的影响,结果如图2所示。随着骨粉质量分数的增加,多肽生成量呈先增后减趋势,骨粉质量分数为8%时,多肽生成量达到峰值(119.61±0.48)mg/g(以骨蛋白质计),之后逐渐降低。这是因为适宜的骨粉质量分数使蛋白质与酶分子更好地接触,提高酶解效率;但当骨粉质量分数过大时,水解液黏度增大,底物与蛋白酶扩散速率降低,蛋白质链断裂,反应受到抑制,酶解效率下降,多肽生成量降低[22]。本实验中多肽溶液的·OH清除活性变化趋势为:骨粉质量分数在4%~8%时,·OH清除率呈显著上升趋势(P<0.05),继续提高骨粉质量分数,·OH清除率保持平稳,最高达到(85.28±2.79)%。由此可知过高的骨粉质量分数会抑制蛋白酶的酶解效果,从而使得功能性肽释放量减少[22]。因此为了获取高活性抗氧化肽,必须严格控制酶解环节。由图2可知,骨粉质量分数为8%、10%和12%时,酶解液的·OH清除率差异不显著(P>0.05),且骨粉质量分数8%时多肽生成量最大,考虑到节约成本,故选择8%为适宜骨粉质量分数。
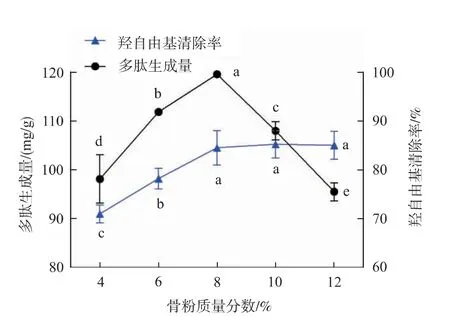
图2 骨粉质量分数对酶解物多肽生成量及抗氧化活性的影响Fig.2 Effect of substrate concentration on polypeptides amount and antioxidant activity of hydrolysates
2.2.2 酶添加量、pH对酶解物多肽生成量及抗氧化活性的影响 固定骨粉质量分数8%,pH 9.0,酶解温度50℃,酶解时间3 h,研究酶添加量分别为4 000、6 000、8 000、10 000、12 000 U/g时,碱性蛋白酶对脱脂羊骨粉蛋白质酶解物多肽生成量及·OH清除活性的影响如图3(a)所示。多肽生成量随酶添加量的增加而逐渐增大,当酶添加量为8 000 U/g时,酶解液中多肽生成量最大,为(119.89±0.61)mg/g(以骨蛋白质计),继续增加酶添加量反而使多肽生成量缓慢降低,可能是因为随着产物质量分数的提高,产物与酶形成复合物,减少酶与底物的接触概率,导致水解进程缓慢[23]。观察酶解产物的·OH清除活性可以发现,酶添加量从4 000 U/g增加到6 000 U/g时,·OH清除率显著增加(P<0.05),酶添加量为6 000 U/g时,·OH清除率达到最大值,随后继续增加酶添加量,酶解液·OH清除率逐渐下降(P>0.05)。合适的酶用量可提高羊骨蛋白质的利用率,促进羊骨抗氧化肽的生成;过高的酶添加量引起过度酶解,导致活性抗氧化肽过度降解,产生不具活性的氨基酸或小分子肽,同时提高促氧化肽的释放概率[24]。综合考虑多肽生成量和·OH清除率,选择最适酶添加量为6 000 U/g。
固定骨粉质量分数8%,酶添加量6 000 U/g,酶解温度50℃,酶解时间3 h,研究不同pH(8.0、8.5、9.0、9.5、10.0,反应过程中控制pH始终在一个恒定的水平)对脱脂羊骨粉蛋白质酶解物多肽生成量及·OH清除活性的影响,结果如图3(b)所示。本实验酶解物的多肽生成量和·OH清除率都呈先增加后降低趋势,且在pH为9.0时两项测试指标均达到峰值。由于酶解反应pH的改变直接影响酶与底物的解离状态以及蛋白酶活性中心构象,从而影响酶的稳定性,改变酶与底物的结合方式,使产物结构发生改变,最终影响酶解产物的性质[25]。从图3(b)可以看出,pH小于9.0时酶解产物的·OH清除率显著增加(P<0.05),pH大于9.0后酶解产物的·OH清除率急剧下降(P<0.05),pH继续升高会破坏蛋白酶的活性中心和空间结构,使其催化活性降低。同时由于碱性蛋白酶最适pH为9.0,此时碱性蛋白酶的活性最高,酶解效果最好,酶解产物的·OH清除率最大,所以确定最佳酶解pH为9.0。
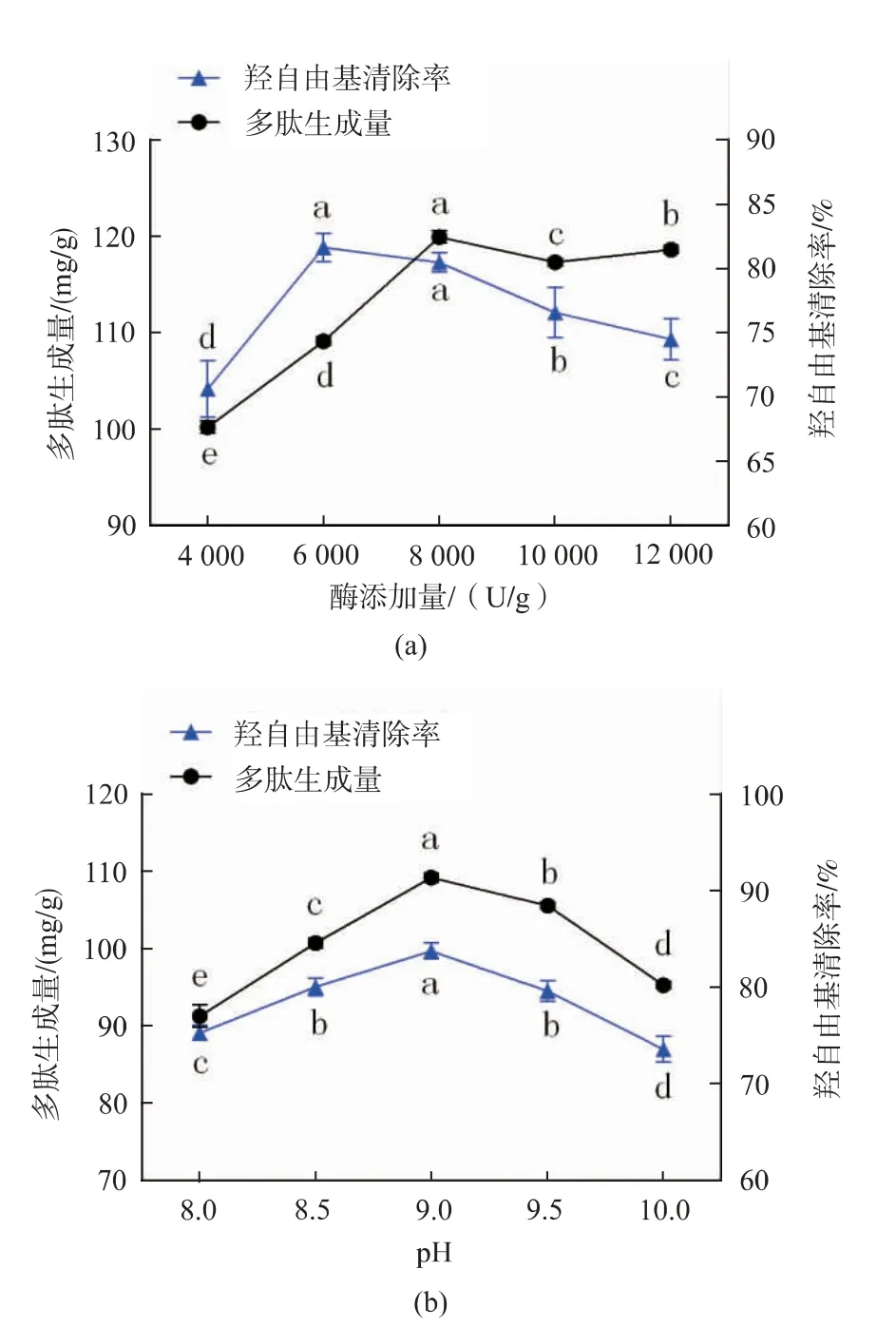
图3 酶添加量、pH对酶解物多肽生成量及抗氧化活性的影响Fig.3 Effect of enzymes amount and pH on polypeptides amount and antioxidant activity of hydrolysates
2.2.3 酶解温度、时间对酶解物多肽生成量及抗氧化活性的影响 固定骨粉质量分数8%,酶添加量6 000 U/g,酶解pH 9.0,酶解时间3 h,研究不同酶解温度(40、45、50、55、60℃)对脱脂羊骨粉蛋白质酶解物多肽生成量及·OH清除活性的影响,结果如图4(a)所示。当反应体系处于40~50℃时,多肽生成量随温度上升而显著增加(P<0.05),50℃时多肽生成量达到峰值,继续升高温度,反应过程中多肽生成量明显下降。由多肽溶液的·OH清除率变化趋势可知,温度为50℃和55℃时的酶解物·OH清除率最高,分别为(86.23±2.93)%和(84.1±2.14)%,此温度段抗氧化活性没有显著性差异(P>0.05),温度低于50℃或高于55℃时·OH清除率都偏低,结合多肽生成量的变化趋势,可知在一定的多肽生成量下,多肽溶液含有适合且稳定的多肽片段和氨基酸比例,从而具有良好的抗氧化活性。故选择50℃为最适酶解温度。
固定骨粉质量分数8%,酶添加量6 000 U/g,酶解pH 9.0,酶解温度50℃,研究不同酶解时间(2、3、4、5、6 h)对脱脂羊骨粉蛋白质酶解物多肽生成量及·OH清除活性的影响,结果如图4(b)所示。酶解时间3 h以后,多肽生成量呈波动上升趋势,在酶解6 h多肽生成量达到最大值。由于酶解初期,底物含量高,可以充分与酶反应,所以随着时间的不断延长,其多肽生成量逐渐增大,而随着反应的进行,底物被不断消耗,反应产物不断积累,酶的活性受到抑制,酶解活动基本趋于平稳甚至结束,导致多肽生成量趋于平缓[26]。·OH清除率随酶解时间的延长先增加后减少,在酶解3 h时·OH清除率最大,达到(90.68±2.18)%,随酶解时间的延长,底物特异性位点基本被完全反应,继续酶解会导致底物的过度水解,抗氧化肽的过度降解和低活性氨基酸的生成,使多肽溶液抗氧化活性降低[27]。所以综合考虑,选择3 h为最适酶解时间。
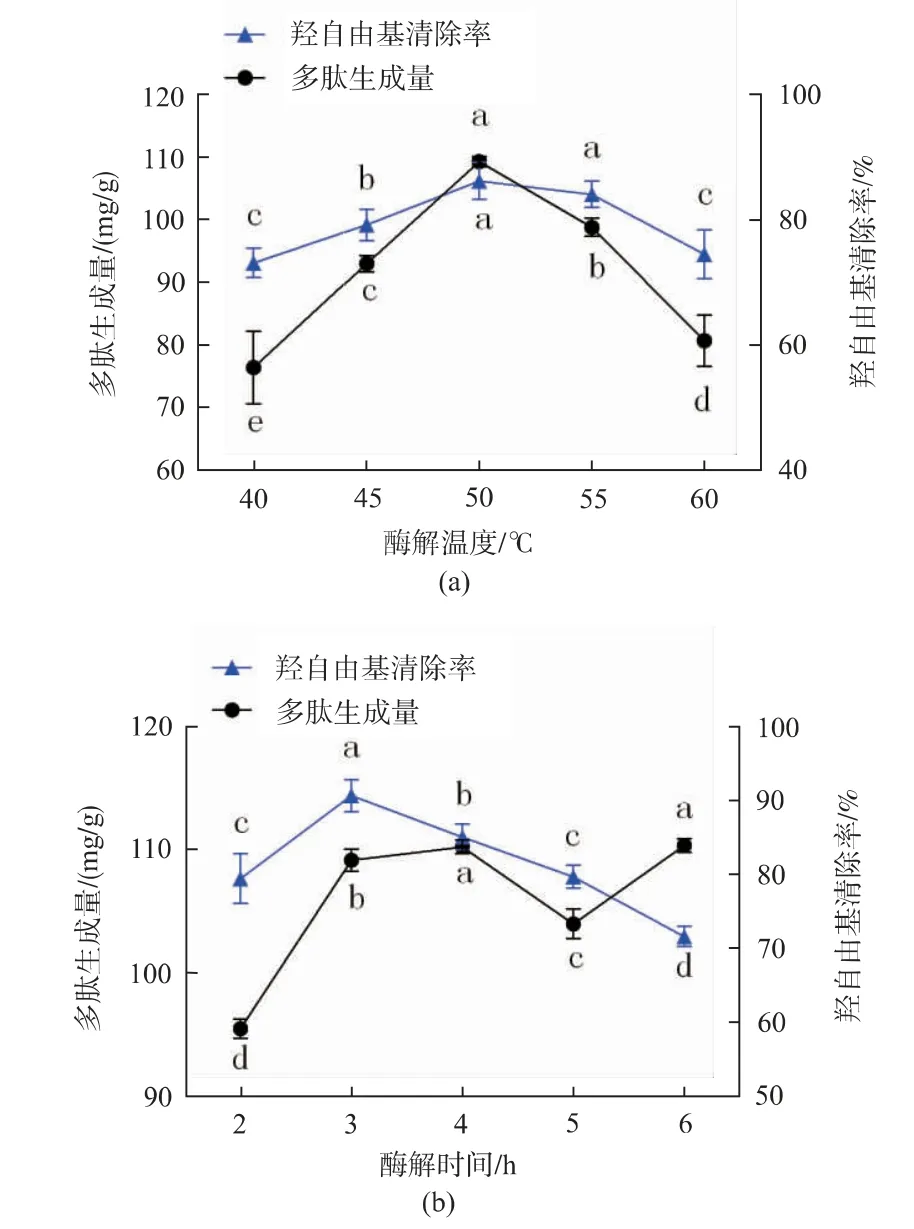
图4 酶解温度、时间对酶解物多肽生成量及抗氧化活性的影响Fig.4 Effect of hydrolysis temperature and time on polypeptides amount and antioxidant activity of hydrolysates
2.3 酶解工艺的响应面实验
2.3.1 响应面实验结果 综合单因素实验结果,固定酶解温度50℃,以pH、酶添加量、酶解时间、骨粉质量分数这4个因素为自变量,·OH清除率为响应值,根据Box-Behnken实验设计原理进行响应面实验,实验设计方案与结果如表2所示。

表2 响应面实验设计方案与结果Table 2 Response surface experimental design and results
2.3.2 模型的建立与方差分析 利用软件Design-Expert v8.0.6进行多元回归拟合,得到回归模型方程:
Y=90.46-0.63A+1.92B+2.24C+3.86D+0.31AB-0.073AC-1.19AD-1.73BC+0.60BD-0.54CD-7.16A2-5.47B2-3.75C2-4.88D2回归方程的方差分析结果见表3。实验所选模型的决定系数R2=0.983 9,调整决定系数RAdj2=0.966 6,模型P<0.000 1,表明该回归模型极显著;失拟项P值为0.355 3>0.05,失拟项不显著,方程拟合度高。模型中B、C、D、A2、B2、C2、D2、BC对·OH清除率影响极显著(P<0.01),AD对·OH清除率影响显著(P<0.05)。由表3可知,F(A)=4.17,F(B)=39.10,F(C)=53.29,F(D)=157.96,即各因素对羊骨粉酶解物抗氧化活性的影响顺序为骨粉质量分数>酶解时间>酶添加量>pH。
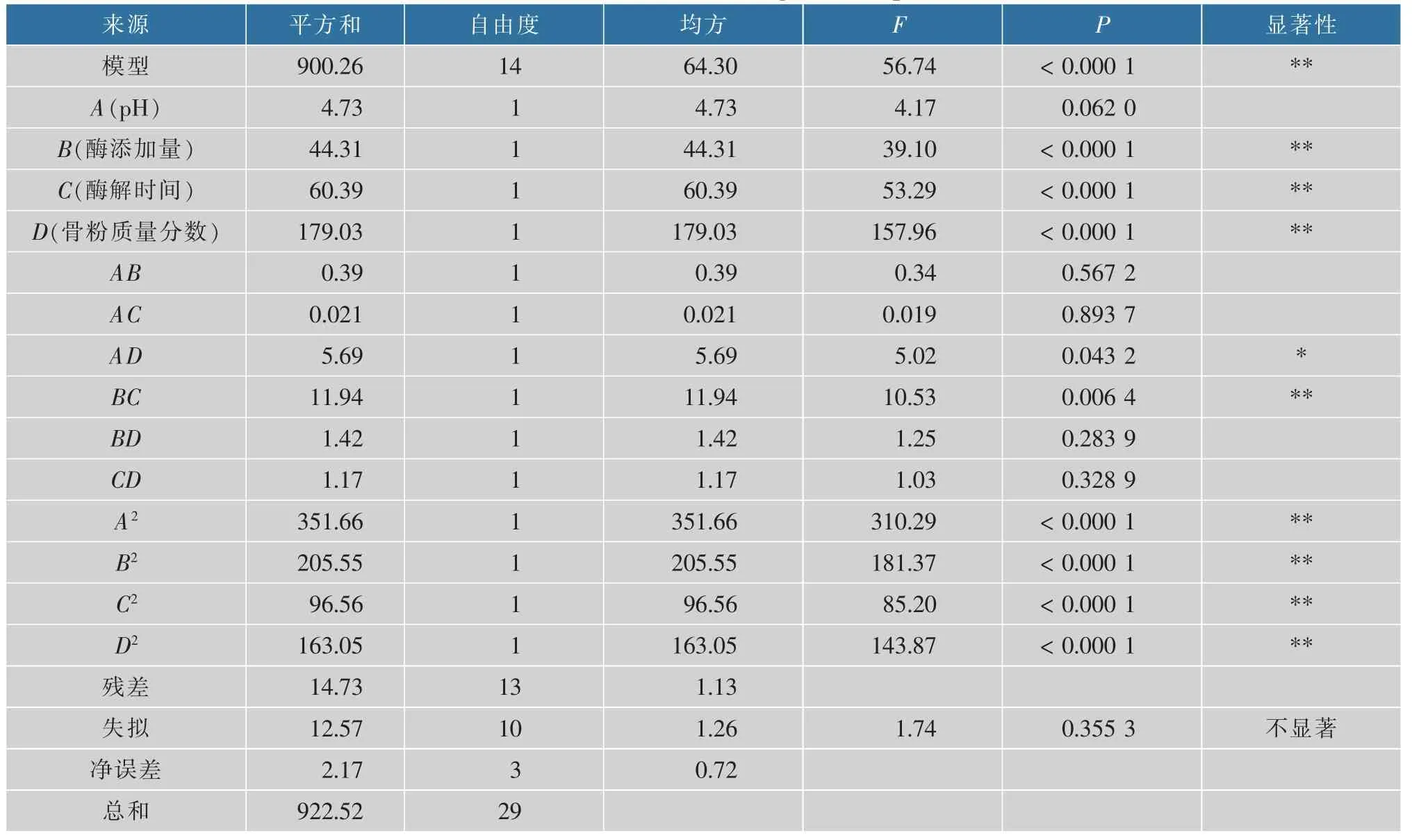
表3 模型回归方程方差分析Table 3 ANOVA of model regression equation
2.3.3 响应面分析 结果如图5所示,当等高线趋于椭圆形时,表示两因素交互作用显著,圆形则结论相反[28]。图5(a)等高线表现为近圆形,说明pH和酶添加量两因素交互作用不明显。图5(b)等高线表现为圆形,说明pH和酶解时间两因素交互作用不明显。同时响应面坡度的陡峭程度也反映出处理条件的改变对响应值的影响[25]。图5(e)、(f)显示,骨粉质量分数方向的响应曲面坡度较陡峭,说明骨粉质量分数的变化对·OH清除率的影响比酶添加量和酶解时间对其的影响大。图5(c)表示骨粉质量分数和pH对·OH清除率的影响,从等高线图中可看出骨粉质量分数以及pH之间交互作用显著。随pH的增加,·OH清除率的变化不大,说明pH对清除率的影响不明显。在图5(d)中,控制pH和骨粉质量分数为零水平,酶添加量和酶解时间相互作用显著。·OH清除率随酶添加量和酶解时间的增加均呈先上升后缓慢下降的趋势,且酶解时间的上升速度稍快于酶添加量的上升速度,说明酶解时间对·OH清除率的影响较大,这与方差分析的结果一致。
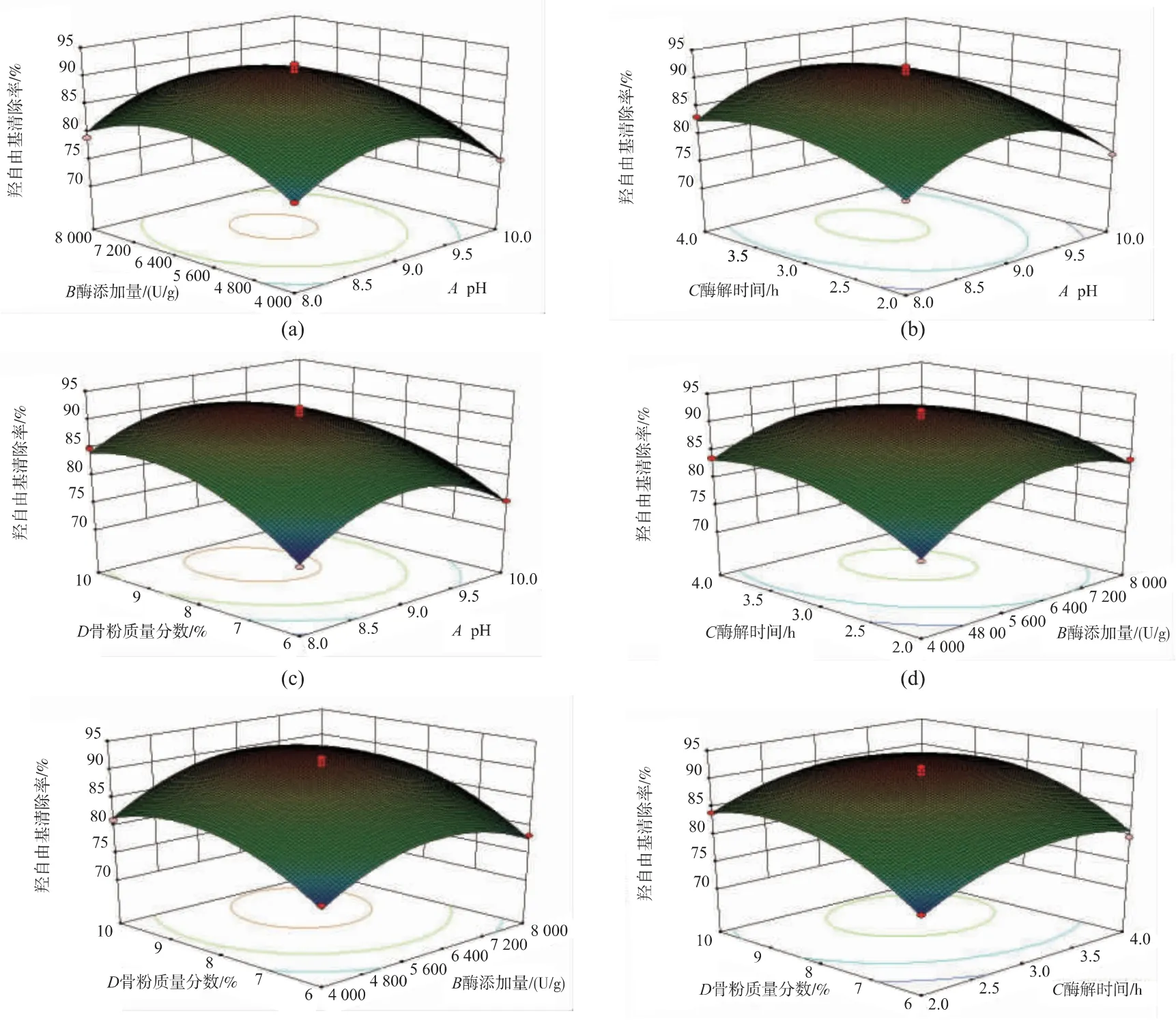
图5 各因素交互作用对·OH清除率的响应面图Fig.5 Response surface plots of variable parameters on·OH radical scavenging rate
2.3.4 最佳酶解条件的确定及验证 采用软件对优化后的回归方程分析可知,当酶解条件为pH 8.92、酶添加量6 317.25 U/g、酶解时间3.23 h、骨粉质量分数8.81%、酶解温度50℃时,此时的·OH清除率最高,其理论值为91.67%。按照该条件进行验证实验,为了方便操作,选取pH 8.9、酶添加量6 400 U/g、酶解时间3.25 h、骨粉质量分数8.8%、酶解温度50℃,验证实验重复3次,测定·OH清除率为(91.31±0.48)%,非常接近理论值,证明拟合模型优化出的条件较为准确。
2.4 羊骨多肽液及超滤组分体外抗氧化活性测定结果
抗氧化肽通过清除活性氧自由基来保护人体,通过氢原子或电子传递延缓脂质过氧化过程来延长食品货架期[29]。由于氧化过程涉及一系列反应步骤,蛋白质水解物可以通过多种反应机制表现出抗氧化活性,因此,必须进行几种不同的测定,以提供有关所测化合物总抗氧化能力的全面信息[30]。本实验通过测定酶解液及其超滤组分的·OH清除活性、Fe3+还原能力和DPPH·清除活性来评估羊骨抗氧化肽的抗氧化潜力,实验结果如表4所示。所有组分均表现出不同程度的·OH、DPPH·清除能力和Fe3+还原能力,表明不同相对分子质量的抗氧化肽活性存在差异。组分Ⅰ(Mr≤3 000)清除·OH、DPPH·能力和Fe3+还原力显著高于其他组分,未经超滤分离纯化的酶解液抗氧化活性相对较低。张周莉[31]用超滤法对猪肩胛骨抗氧化肽进行初步分离纯化,发现Mr<5 000组分的抗氧化活性高于其他超滤组分。李娇娇[32]对鹅骨抗氧化肽进行分离富集,发现各超滤组分的抗氧化活性大小顺序依次为:Mr<5 000组分,5 00 表4 碱性蛋白酶酶解物及其超滤组分的抗氧化活性Table 4 Antioxidant activity of alkaline protease hydrolysates and their ultrafiltration components 多肽的抗氧化能力取决于肽的各种属性,包括氨基酸组成、序列、结构和浓度等,此外,Sah等[30]报道,含有Pro、His、Met、Tyr、Val、Lys和Cys的水解产物具有很强的自由基清除能力。由表5可知,羊骨多肽粉末中氨基酸含量丰富,必需氨基酸质量占总氨基酸质量的27.03%,疏水性氨基酸多达39.96%。膜分离得到的不同组分抗氧化肽氨基酸组成一致,组分Ⅱ(3 000 表5 羊骨粉和多肽液及其超滤组分的氨基酸质量分数比较Table 5 Comparison of amino acid contents in sheep bone,polypeptide solution and the ultrafiltration components 作者以提高肉类加工副产物羊骨利用率为目的,通过酶解脱脂羊骨粉制备抗氧化肽。经碱性蛋白酶在pH 8.9、酶添加量6 400 U/g、酶解时间3.25 h、骨粉质量分数8.8%、酶解温度50℃条件下,得到具有抗氧化活性的多肽溶液,其·OH清除率为(91.31±0.48)%,Fe3+还原能力为0.085±0.003,DPPH·清除率为(32.00±0.12)%。超滤组分Ⅰ(Mr<3 000)抗氧化活性最强且疏水性氨基酸所占比例最高,为43.13%。通过优化酶解工艺处理羊骨,降低了蛋白质相对分子质量,增加了活性多肽及氨基酸成分,酶解产物活性更强且易于吸收,该工艺操作简单,加工成本不高。在本实验梯级肽制备和抗氧化活性研究基础上,可进一步对小肽的纯化和功能鉴定进行深入研究,为羊骨的高值化利用提供科学依据。
2.5 氨基酸组成分析

3 结 语
