邻苯二甲酸酯及邻苯二甲酸在碳管上的吸附
2021-07-23孙天杭沈晓芳张占恩陈淑敏徐舒艺陈勇宏郭笑盈
孙天杭,沈晓芳*,张占恩,2,陈淑敏,刘 丹,徐舒艺,陈勇宏,张 萌,郭笑盈
邻苯二甲酸酯及邻苯二甲酸在碳管上的吸附
孙天杭1,沈晓芳1*,张占恩1,2,陈淑敏1,刘 丹1,徐舒艺1,陈勇宏1,张 萌3,郭笑盈4
(1.苏州科技大学环境科学与工程学院,江苏 苏州 215000;2.苏州科技大学水处理技术与材料协同创新中心,江苏 苏州 215000;3.南京林业大学生物与环境学院,江苏 南京 210037;4.郑州大学生态与环境学院,河南 郑州 450001)
以邻苯二甲酸(PA)和邻苯二甲酸二乙酯(DEP)为目标污染物,碳纳米管(CNTs)为吸附剂,通过不同pH值条件下单、双溶质的吸附实验,结合能量分布理论,分析PA对DEP在CNTs上的竞争和取代吸附.结果表明,在同一pH值下,DEP在CNTs上的吸附性强于PA.对于DEP,pH值改变导致的CNTs分散稳定性的变化是影响其吸附的决定因素.对于PA,溶液pH值会影响CNTs的表面电荷及PA的解离程度,两者均会产生影响.双溶质体系下,PA对DEP在CNTs上的吸附存在竞争和取代效应.在不同pH值条件下,PA对DEP在CNTs上的竞争和取代的程度与CNTs的分散稳定性和PA的解离程度有关.基于能量分布的分析表明,虽然PA的加入导致DEP在CNTs上可利用的高能吸附位点数量显著下降,但是其可利用的低能吸附位点数量增加.
能量分布;竞争吸附;取代吸附;碳纳米管;邻苯二甲酸;邻苯二甲酸二乙酯
邻苯二甲酸酯类化合物(PAEs)是一种常见的塑化剂[1],是一类环境内分泌干扰物,容易从塑料产品中迁移出来进入土壤、空气和水体中.PAEs在环境中残留期较长,易于生物富集,从而对公众健康带来极大潜在危害[2].邻苯二甲酸二乙酯(DEP)是使用最广泛的PAEs之一,已被美国环境保护署、欧盟和中国国家环境监测中心列为主要污染物[3].邻苯二甲酸(PA)作为多种邻苯二甲酸酯的降解产物,广泛存在于有机废水中[4]. PA可通过呼吸系统、皮肤接触和消化系统等进入人体内,使人类内分泌失调和免疫力下降,甚至出现生殖病变或癌变[5].
由于简单高效,吸附被广泛应用于水环境中有机污染物的去除[6].碳纳米管(简称碳管,CNTs)作为一种新型材料,由于其巨大的比表面积和较强的疏水性,是环境中有机污染物的优良吸附剂[7-10].目前关于CNTs吸附去除有机污染物的研究侧重于单化合物体系[9,11],而多种污染物共存时,在吸附过程中出现的竞争或者协同作用对其在CNTs的吸附产生影响.Wang等[12]研究表明,在较低浓度酸性红183的溶液中,阳离子染料亚甲基蓝与其表现出协同作用,促进了2种染料在碳纳米管上的吸附,而浓度较高时,亚甲基蓝在碳纳米管上的吸附减少. Ou等[13]对单一体系和复合体系下苯酚和双酚A在2种土壤上的吸附行为研究发现,苯酚可以被双酚A抑制吸附,而反过来不成立,且竞争强度与其物质的疏水性有极大关系.水环境中的污染物并非单一存在,共存有机物之间必定会相互影响[14],需要进一步研究.
吸附位点能量分布理论(SEDT)是从能量分布的角度分析吸附过程的理论方法,可以提供吸附剂表面吸附位点的能量分布函数[15].大多数研究都是从等温线模型获得参数讨论有机物在CNTs上的吸附机理[16-17],而基于吸附位点能量分布研究可以看出位点的移动以及不同位点的数量变化.Carter等[18]应用SEDT研究了预先负载天然有机质对活性炭吸附三氯乙烯及1,2,4-三氯苯的机理,得到被不可解吸的溶质预加载会导致吸附剂表面不均匀性的降低,表现为高能位点最先消失,而低能位点的数量增加,且高能位点的减少导致了在低浓度范围内吸附量显著降低的结论.Abdurahman等[19]将SEDT用于水生环境中河腐殖酸和河富勒酸对聚苯乙烯微塑料的吸附研究中,发现2种有机物均首先占据高能吸附位点,然后扩散到聚苯乙烯微塑料的低能吸附位点.Zhou等[20]将SEDT应用于城市污泥生物炭吸附四环素的研究,推导了平均吸附位点能量和相应的吸附位点能量分布的标准偏差,以探究四环素在改性生物炭上的吸附强度和吸附位点的异质性,通过定量平均位能来探索四环素的吸附机理.
本文从吸附等温特性和吸附位点能量分布的角度分析在不同pH值条件时:单溶质体系下,DEP与PA在CNTs上的吸附性;双溶质体系下,DEP和PA在CNTs上的竞争与取代吸附行为.
1 材料与方法
1.1 材料与仪器设备
材料:PA(纯度为99%,AIfaAesar公司);DEP(纯度为99%, AIfaAesar公司);CNTs(中科时代纳米公司,制备方法:CVD法);乙腈(色谱纯,美国Tedia公司);实验用水为德国赛多利斯集团 Arium® Comfort纯水系统制备的超纯水.
仪器:岛津LC-20AT高效液相色谱仪(日本岛津公司)、ZD-8801Ⅱ台式回转摇床(太仓市华利达实验设备有限公司)、TDL-50 台式低速离心机(金坛市开发区吉特实验仪器厂)、PHS-3C型pH 计(上海仪电科学仪器有限公司)等.
1.2 表征方法
采用透射电子显微镜(TEM)(TECNAI G2F20, FEI,USA)获取CNTs的表面形态信息.为获得CNTs不同pH值条件下的表面电荷信息,用马尔文Zeta电位仪(Malvern Instruments Ltd., Malvern, UK)测定CNTs的Zeta电位,测定温度条件为室温,每次测定前对悬浮液进行超声分散20min.本研究中碳管的基本理化性质在本课题前期研究中已有报道[21-22],如比表面积、孔隙度、元素组成和灰分含量,结果列于表1中.比表面积和孔隙度由比表面积分析仪(Quantachrome Instruments,FL,USA)在77K下测定N2的吸附-脱附曲线获得.采用PE2400元素分析仪(Waltham, MA)分析了CNTs的元素的组成,包括C,H和N元素含量,结合900℃下加热4h得到的灰分含量,通过质量守恒计算O元素含量.

表1 CNTs的理化特性
注:a在本课题前期研究中已有报道[21].
1.3 吸附实验
在单化合物吸附实验中,调节溶液pH值为1、3、5、7,PA溶液的质量浓度为1,5,10,15,20,25,30,35,40, 45mg/L,DEP溶液的质量浓度为1,10,20,30,40,50,60, 80,100mg/L.溶液采用含有200mg/L NaN3和0.02mg/ L CaCl2的背景溶液配制,NaN3用于抑制生物活性,CaCl2用于保持恒定的离子强度.配制完成后,加入到装有一定量吸附剂的玻璃螺口瓶中,密封后在旋转振动筛上振荡3d(振荡时间通过预实验获得以确保吸附达到平衡).吸附平衡后,以3000r/min离心30min,然后用滴管吸取上清液.用岛津LC-20AT高效液相色谱仪和紫外分光光度计分别测定上清液中DEP和PA的浓度,同时配制相同pH值条件下PA和DEP的标准曲线.
在竞争吸附实验中,调节溶液pH值为1、3、5,DEP的初始浓度与单化合物体系相同,PA的初始质量浓度为25mg/L,将含有DEP与PA的40mL溶液加入到称有一定量CNTs的样品瓶中,振荡平衡后,测定上清液中DEP含量.在取代吸附实验中, DEP溶液的浓度及pH值系列与竞争体系相同,在CNTs上吸附平衡后,加入PA储备液,使取代化合物PA的初始浓度为25mg/L,同时为了避免因溶液体积变化而导致对DEP吸附平衡的扰动,尽量减少加入的PA的体积.因此,参考文献[23],将加入PA的体积控制在100μL以内,即溶液的体积增加控制在0.25%以内.振荡平衡后,测定上清液中DEP含量,测定步骤同单化合物体系吸附实验.所有实验做2组平行,同时做2组空白.
1.4 检测条件
本研究采用岛津LC-20AT高效液相色谱仪检测DEP,检测条件:安捷伦Eclipse XDB C-18色谱柱(5μm,4.6mm×250mm);流动相:乙腈/水,50%/50% (/);流速:1mL/min;波长:228nm.采用紫外分光光度计测定PA,波长为280nm.
1.5 吸附等温线模型
固-液吸附体系中常用的吸附模型是Langmuir和Freundlich模型,Langmuir模型公式如下:

式中:e为吸附平衡时吸附质在溶液中的浓度, mg/L;e为吸附平衡时的吸附量,mg/g;max为最大吸附量,mg/g;常数L为Langmuir吸附常数,L/mg.
Freundlich模型公式如下:
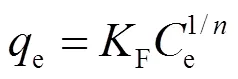
式中:e为吸附平衡时吸附质在溶液中的浓度,mg/ L;e为吸附平衡时的吸附量,mg/g;F是吸附亲和性系数,[(mg/kg)/(mg/L)]1/n;是指数系数,无量纲.
1.6 吸附位点能量分布理论
根据非均匀表面的吸附理论,位点能量分布可根据一般的积分方程来确定.该方程假设在一定能量范围内,非均匀的表面吸附剂对吸附质总的吸附量e(e)等于能量均匀的局部吸附位点上吸附等温式h(,e) 乘以能量分布函数()的积分[18],此积分方程即非均匀表面上的吸附等温通式:
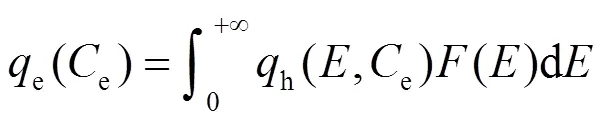
式中:是指在特定吸附位点上溶质与溶剂的吸附能之间的差异[14].对h(,e)()积分的界限应基于吸附能的最小值和最大值,然而很难确定吸附能的最小值和最大值,该范围通常取(0,+∞)[24].
采用Cerofolini提出的“近似凝聚法”建立*与e的关系式:
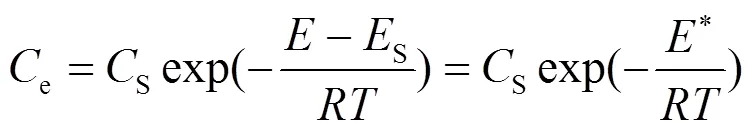
式中:s为溶质的最大溶解度,mg/L;e为平衡时溶液中溶质的浓度,mg/L;为气体常数,8.314×10-3kJ/ (mol·K);为绝对温度,K;为浓度为e时的吸附能,kJ/mol;s为浓度为s时的吸附能,kJ/mol;*为参考点s的基础上的吸附剂表面溶质与溶剂之间的吸附能量差.
相关研究表明,疏水性物质在吸附过程中会导致吸附位点能量分布改变[25],因此提出了将吸附等温和点位能量分布相关联的模型:
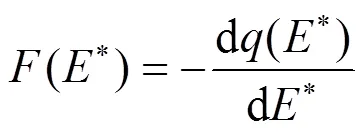
式中:(*)为吸附位点的能量分布函数,mg·mol/ (kg·kJ);(*)为溶质吸附态浓度mg/L.由Freundlich模型及公式(4)和(5)可得基于Freundlich模型吸附位点能量分布方程:
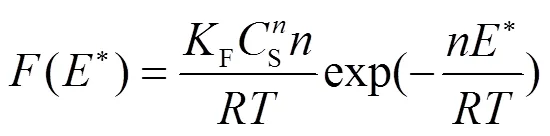
2 结果与讨论
2.1 CNTs的表征结果
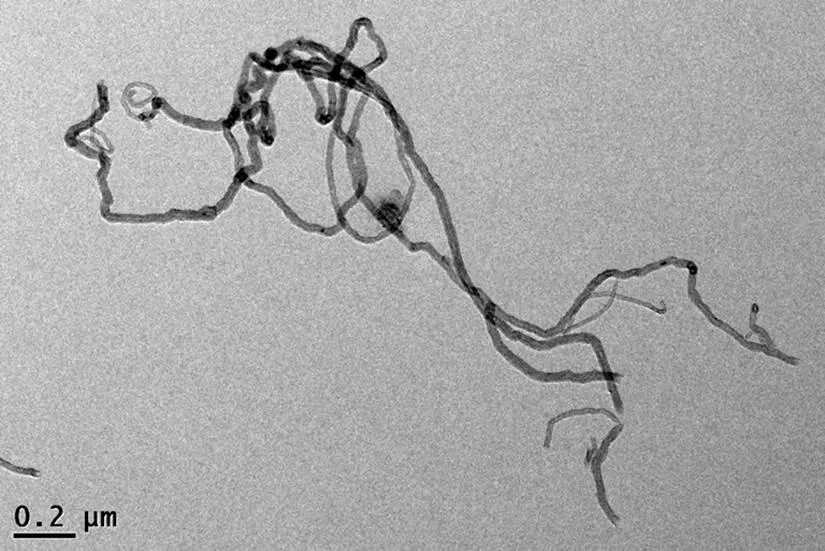
由元素含量(O+N)/C比值可知,本研究中的碳管疏水性较强[26].Zeta电位是对颗粒之间相互排斥或吸引力的强度的度量,分子或分散粒子越小,Zeta电位的绝对值越高,分散体系越稳定.CNTs在不同pH值条件下的分散稳定性由强到弱的顺序为:pH = 7>pH=5>pH=3>pH=1.TEM分析结果见图1,可以发现CNTs呈无序排列.
2.2 单溶质体系下CNTs对DEP和PA的吸附性
由表2可知,与Langmuir相比,Freundlich模型对DEP和PA在CNTs上的吸附等温线拟合更好.因此,基于Freundlich 模型对污染物在CNTs上的吸附性进行研究.比较d值发现,在同一pH值条件下,2种化合物在CNTs上的吸附能力大小均为:DEP>PA.对于在水环境中电离程度较低的污染物分子,碳质材料可通过调控表面亲疏水性能,通过疏水相互作用,增强对污染的去除能力,特别是针对芳香类有机污染物或者含油废水,疏水相互作用在去除过程中发挥了重要作用[27].碳纳米管表面可以提供大量疏水位点,因此,疏水作用在CNTs吸附有机污染物(特别是疏水性有机污染物)时起着重要影响[28-29]. DEP(lgow=2.44)[30]的疏水性远大于PA(lgow= -1.42,pH=7),因此在相同的溶液环境下,DEP在CNTs上的吸附强于PA.
不同pH值条件下,DEP在CNTs上的吸附遵循这样的规律:pH = 7 > pH = 5 > pH = 3 > pH = 1(图2,表2).CNTs在水中分散的等电点介于pH = 1和pH = 3之间(表1),当pH > 3时,pH值越高,Zeta电位越负,体系分散稳定性强,可利用的吸附位点数量越多,吸附性越强.当pH = 1,Zeta电位为正,然而其绝对值小于pH = 3时(表1),因此吸附性较弱.因此,CNTs在不同pH值条件下的分散稳定性由强到弱的顺序为:pH = 7 > pH = 5 > pH = 3 > pH = 1,与不同pH值下在碳管上吸附强弱的规律一致.DEP在酸性条件下不会产生降解,pH=9且有电子束辐照的情况下才会产生较高的降解,本文只探究了酸性和中性溶液体系,所以没有考虑DEP的水解效应[31].由此可见,对于非解离性化合物DEP在CNTs上的吸附,CNTs的分散稳定性是决定性因素.
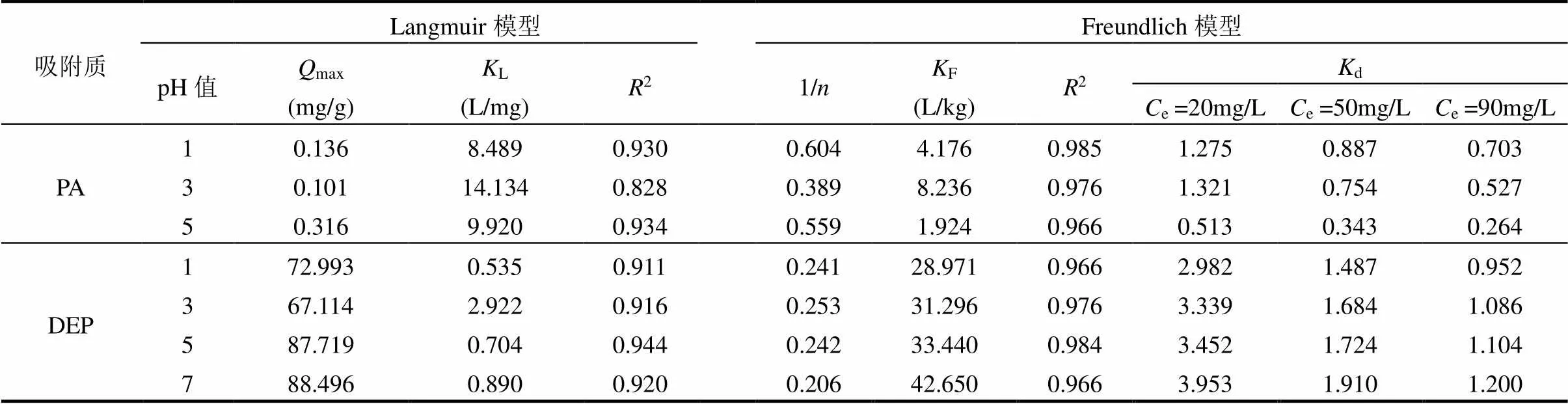
表2 单溶质体系下PA和DEP的吸附等温线拟合参数
注:固液分配系数d=e/e;吸附实验中,当pH = 7时,PA在CNTs上未观察到发生吸附现象.
不同pH值条件下,PA在碳管上的吸附强弱顺序为:pH = 3 > pH = 1 > pH = 5,与碳管的分散稳定性强弱顺序不一致.由此可见,在这个体系下,CNTs的分散稳定性不是影响其吸附性能的主导性因素.如图2所示,溶液的pH值对PA在溶液中的存在形式有着重要影响[32],而PA的电离常数pa1=2.98, pa2= 5.28[33].因此,当pH = 1时,PA在水中几乎完全以分子形态存在;pH = 3时,PA在水中约50%的分子形态和50%的离子形态共存;pH = 5时,PA在水中以完全解离态的形式存在.当pH = 5时,CNTs带负电,与几乎完全解离的PA存在较强的静电斥力,因此在此酸度条件下,PA在CNTs上的吸附最弱.
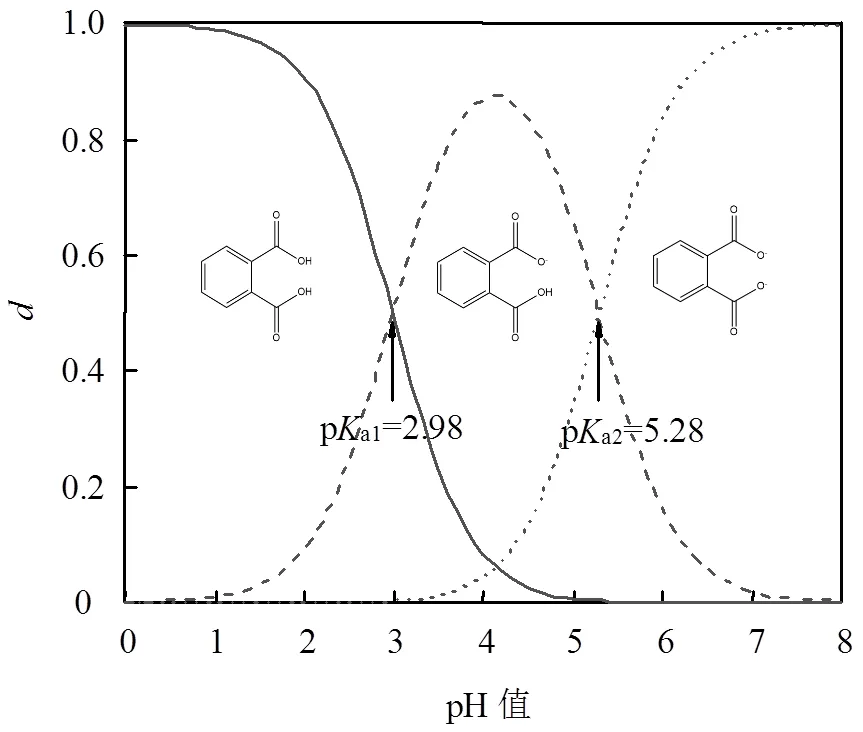
图2 邻苯二甲酸溶液中各种存在形式的分布系数与溶液pH值的关系
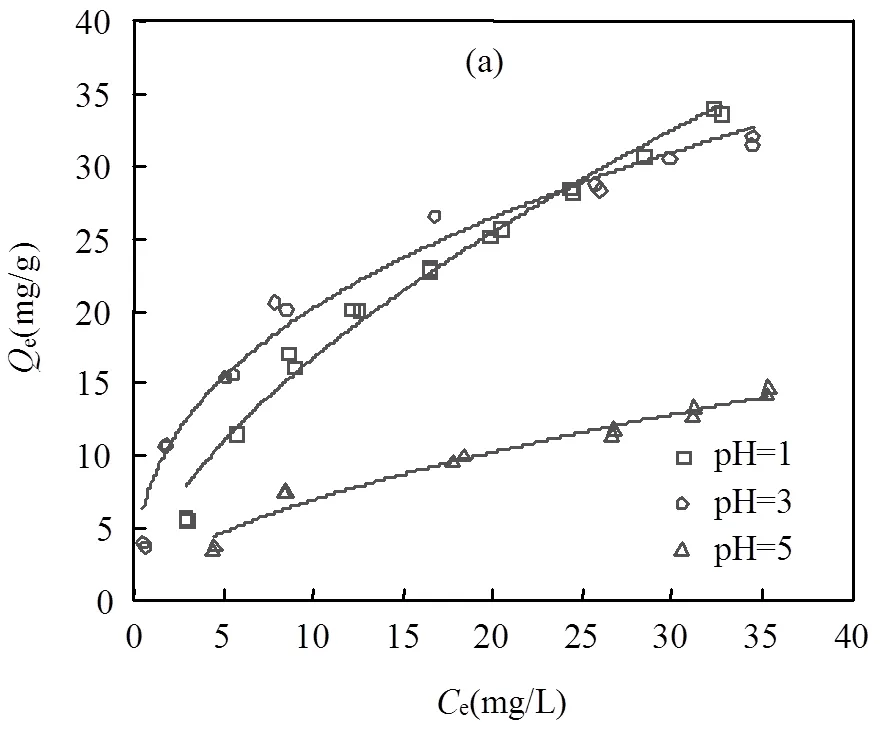
由图3可看出,当e>24.15mg/L时,pH = 1时PA在CNTs上的吸附优于pH = 3时,这是因为分子态形式存在更利于吸附.而当e在0~24.15mg/L时,pH = 3时PA在CNTs上的吸附更优,d值较大与上述理论相悖,回归溶液中溶质的存在形式及吸附剂的分散稳定性,可以得到这样的解释:游离态吸附质仍能提供部分吸附位点,CNTs Zeta电位的绝对值pH = 3 >pH=1,因此在浓度较低时,良好的分散性使得CNTs更好暴露吸附位点,在静电斥力作用下仍旧使得pH = 3时PA在CNTs上的吸附略胜于pH=1时的吸附.吸附平衡前后的pH值通过单因素方差分析表明, pH值在吸附前后无显著性差异(<临界值).由此可见,对于解离性化合物PA在CNTs上的吸附,静电斥力及CNTs的分散稳定性均具有一定的影响.
2.3 双溶质体系下CNTs对DEP的吸附性
与单溶质体系相比,在相同pH值条件下,双溶质体系中DEP的d值均有所减小(表3),说明PA对DEP在CNTs上的吸附存在明显的竞争与取代作用.取代吸附体系中DEP在CNTs上的吸附:pH = 5 > pH = 3 > pH = 1,与单溶质体系下DEP的吸附规律一致,因此可以认为此体系下,影响DEP吸附性的CNTs的分散稳定性为主要影响因素.与单溶质吸附体系相比,取代吸附体系中DEP在CNTs上的吸附量明显减少(图4,表3),这是因为在PA加入体系之前,DEP在CNTs上的吸附已经达到平衡,表明在单位时间内被吸附和被解吸的DEP分子数量是相同的.当PA被加入到吸附体系中,最初建立的平衡受到干扰.吸附平衡是一个动态过程,在此过程中,PA可与被解吸的DEP分子竞争[22].竞争吸附体系中DEP在CNTs上的吸附:pH = 5 > pH = 1 > pH = 3,这与不同pH值条件下PA在CNTs上的吸附能力有关,PA在CNTs上的吸附趋势:pH = 3 > pH = 1 > pH = 5(图3,表2).
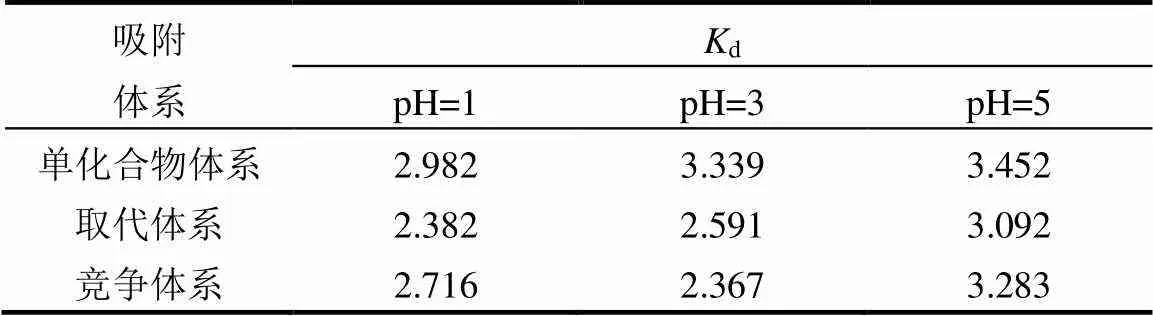
表3 不同吸附体系下DEP在碳管上吸附的Kd值
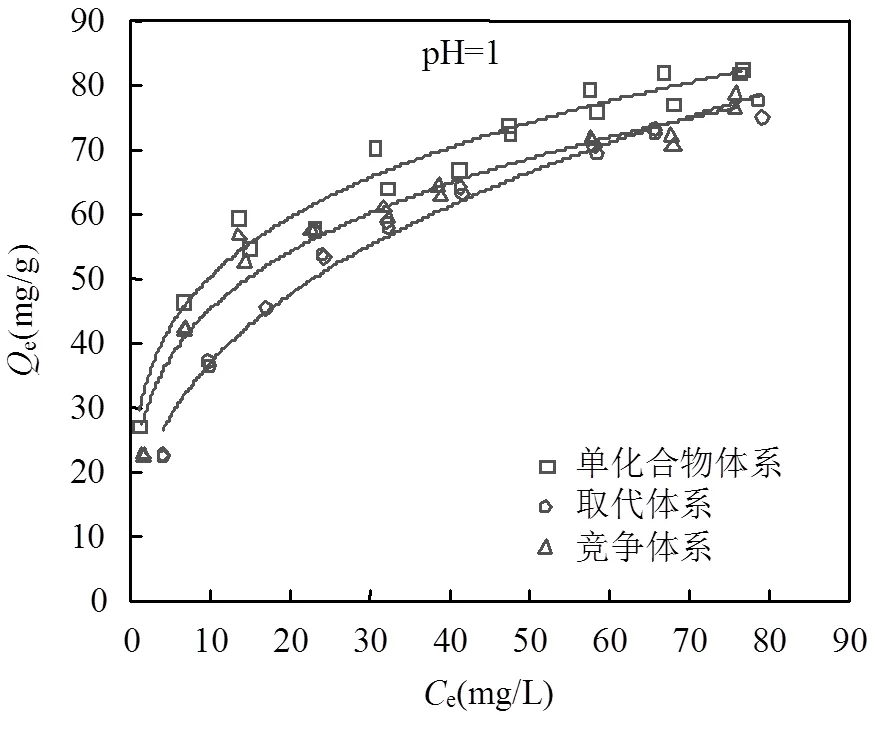
PA在CNTs上的吸附量增加,对DEP在CNTs上吸附的竞争性增强,从而DEP在CNTs上的吸附量也会减少.溶液pH值对PA和DEP取代和竞争吸附的不同影响,表明污染物与吸附剂接触的先后顺序对其吸附效果存在一定的影响.
2.4 基于吸附位点能量分布对DEP和PA竞争和取代吸附行为分析
从图5可看出,双溶质体系中,频率函数(*)随着位点能量*的增大而按指数函数迅速衰减,与单溶质体系的曲线分布相似,表明CNTs上的高能吸附位点数较少.DEP在CNTs上首先占据有限的高能位点,随着溶液浓度的增加,可利用的高能位点数量逐渐减少.与单溶质体系相比,在双溶质体系中DEP所占据的高能吸附位点明显减少,DEP的吸附位点向低能位点移动,说明共存DEP和PA在CNTs上的吸附产生明显的竞争作用,DEP吸附平衡后加入的PA也会取代部分高能位点上的DEP.

研究表明[18,34],吸附剂上预先负载的化合物使该吸附剂可利用的高能吸附位点数量减少,而低能吸附位点数量增多.Cater等[18]推测,减少的高能吸附位点没有完全消失,而是因为吸附剂与预先负载的化合物之间的分子作用形成了新的低能吸附位点.在本研究中,加入的PA溶液在碳管上存在吸附,吸附在碳管上的PA可能改变了碳管表面的性质,比如疏水性.同时,也改变了DEP在碳管上的可利用的吸附位点.研究表明,碳质材料表面含氧量的升高,会降低这类材料对同一疏水性有机污染的吸附位点平均能量[23].碳质材料含氧量的升高导致其疏水作用降低,这可能是其平均能量降低的原因之一.针对疏水性有机污染物在碳质材料上的吸附:疏水作用可能是高能吸附位点;而与含氧官能团相关的作用,如静电作用和氢键作用,可能是低能吸附位点.PA在碳管上的吸附使碳管表面的含氧量增加、极性升高,使原本可利用的部分疏水高能位点转变成了相对低能的极性低能作用位点,从而导致DEP在CNTs上的高能吸附位点数量下降、低能吸附位点数量增加.
某一能量范围内,能量分布曲线下方的面积可看作是该范围能量的吸附位点数或吸附容量.因此,当pH = 1时,在3000.00~6513.51kJ/mol的低能位点范围内,取代吸附体系中DEP在CNTs上的吸附量大于在竞争吸附体系中的吸附量;而当位点能量较高,在6513.51~30000.00kJ/mol时,竞争吸附体系中DEP的吸附量大于在取代吸附体系中的吸附量.上述结果表明,当pH = 1时,在竞争吸附体系中DEP占据的中、高能吸附位点较取代吸附体系多.当pH = 3时,在3000.00~5486.49kJ/mol的低能位点范围内,竞争吸附体系中DEP在CNTs上的吸附量大于在取代吸附体系中的吸附量;而当位点能量在5486.49~ 30000.00kJ/mol时,取代吸附体系中的DEP的吸附量大于竞争吸附体系中的吸附量.上述结果表明,当pH = 3时,在取代吸附体系中DEP占据的中、高能位点较竞争吸附体系多.当pH = 5时,竞争和取代体系中DEP在CNTs上吸附位点能量分布与单化合物体系无显著差异,主要与当pH = 5时,PA在CNTs上的吸附较弱有关.由能量分布和等温曲线以及d值所呈现的规律来看,PA的共存对DEP在CNTs上吸附的高能位点的影响较大.
3 结论
3.1 疏水作用和分散稳定性对CNTs的吸附性有着重要影响.同一pH值时, CNTs对DEP的吸附强于PA. pH值的升高促进了DEP在CNTs上的吸附,而PA在CNTs上的吸附还与PA的解离程度有关.
3.2 与单溶质体系相比,双溶质体系中PA对DEP在CNTs上的吸附存在竞争和取代效应.在不同pH值条件下, PA对DEP在CNTs上的竞争和取代的程度与PA的吸附强弱和CNTs的分散稳定性有关.在竞争体系中, PA在碳管上的吸附越强, PA对DEP的竞争性越强;在取代体系中, CNTs的分散性增强, PA对DEP的取代越弱.
3.3 基于吸附位点能量分布的分析表明, PA的加入改变了DEP在CNTs上的可利用吸附位点. PA在CNTs上的吸附使得原本可利用的部分疏水高能位点转变成相对低能的极性低能作用位点,从而导致DEP在CNTs上的高能吸附位点数量下降、低能吸附位点数量增加.
[1] Shuai W, Gu C, Fang G, et al. Effects of iron (hydr)oxides on the degradation of diethyl phthalate ester in heterogeneous (photo)-Fenton reactions [J]. Journal of Environmental Sciences, 2019,80(6):5-13.
[2] Guo R, Yan L, Rao P, et al. Nitrogen and sulfur co-doped biochar derived from peanut shell with enhanced adsorption capacity for diethyl phthalate [J]. Environmental Pollution, 2019,258,DOI:10.1016/ j.envpol.2019.113674.
[3] Sun Z, Feng L, Fang G, et al. Nano Fe2O3embedded in montmorillonite with citric acid enhanced photocatalytic activity of nanoparticles towards diethyl phthalate [J]. Journal of Environmental Sciences, 2021,101:248-259.
[4] 杨盈利,闫新龙,胡晓燕,等.不同锌铝比水滑石的合成及其吸附脱除水中邻苯二甲酸性能[J]. 无机化学学报, 2017,33(10):1748-1756.
Yang Y L, Yan X L, Hu X Y, et al. Synthesis of hydrotalcite with different ratios of zinc to aluminum and its adsorption and removal of phthalic acid from water [J]. Chinese Journal of Inorganic Chemistry, 2017,33(10):1748-1756.
[5] 穆希岩,李成龙,黄 瑛,等.两种邻苯二甲酸酯类污染物对斑马鱼胚胎发育的影响[J]. 中国环境科学, 2017,37(9):3566-3575.
Mu X Y, Li C L, Huang Y, et al. Effects of two phthalate pollutants on zebrafish embryo development [J]. China Environmental Science, 2017,37(9):3566-3575.
[6] Li H, Cao Y, Zhang D, et al. pH-dependent K-OW provides new insights in understanding the adsorption mechanism of ionizable organic chemicals on carbonaceous materials [J]. Science of the Total Environment, 2018,618:269-275.
[7] Li H, Zhang D, Han X, et al. Adsorption of antibiotic ciprofloxacin on carbon nanotubes: pH dependence and thermodynamics [J]. Chemosphere, 2014,95(J):150-155.
[8] Xu J, Cao Z, Zhang Y, et al. A review of functionalized carbon nanotubes and graphene for heavy metal adsorption from water: Preparation, application, and mechanism [J]. Chemosphere, 2018,195: 351-364.
[9] Li H, Wei C, Zhang D, et al. Adsorption of bisphenol A on dispersed carbon nanotubes: Role of different dispersing agents [J]. Science of the Total Environment, 2019,655:807-813.
[10] 吴利瑞,张蓝心,于 飞,等.氨基化碳纳米管/石墨烯气凝胶对甲醛吸附研究[J]. 中国环境科学, 2015,35(11):3251-3256.
Wu L R, Zhang L X, Yu F, et al. Adsorption of formaldehyde on aminated carbon nanotubes/graphene aerogels [J]. China Environmental Science, 2015,35(11):3251-3256.
[11] Ni J Z, Pignatello J J, Xing B S. Adsorption of aromatic carboxylate ions to charcoal black carbon (biochar) is accompanied by proton exchange with water [J]. Journal of Environmental Sciences, 2011, 45(21):9240-9248.
[12] Wang S B, Wei C, Wang W T, et al. Synergistic and competitive adsorption of organic dyes on multiwalled carbon nanotubes [J]. Chemical Engineering Journal, 2012,197(1):34-40.
[13] Ou Y H, Chang Y J, Lin F, et al. Competitive sorption of bisphenol A and phenol in soils and the contribution of black carbon [J]. Ecological Engineering, 2016,92:270-276.
[14] Li X Y, Gamiz B, Pignatello J J, et al. Competitive sorption used to probe Strong hydrogen bonding sites for weak organic acids on carbon nanotubes [J]. Environmental Science & Technology, 2015,49(3): 1409-1417.
[15] Duan S, Gu M, Tao M, et al. Adsorption of methane on shale: Statistical physics model and site energy distribution studies [J]. Energy & Fuels, 2020,34(1):304-318.
[16] Kalies G, Bruer P, Szombathely M V. Design of liquid/solid adsorption isotherms by energy distribution functions [J]. Journal of Colloid & Interface Science, 2009,331(2):329-334.
[17] Wang X, Liu Y, Tao S, et al. Relative importance of multiple mechanisms in sorption of organic compounds by multiwalled carbon nanotubes [J]. Carbon, 2010,48(13):3721-3728.
[18] Carter M C, Kilduff J E, Weber W J. Site energy distribution analysis of preloaded absorbents [J]. Environmental Science & Technology, 1995,29(7):1773-1780.
[19] Abdurahman A, Cui K, Wu J, et al. Adsorption of dissolved organic matter (DOM) on polystyrene microplastics in aquatic environments: Kinetic, isotherm and site energy distribution analysis [J]. Ecotoxicology and Environmental Safety, 2020,198,DOI:10.1016/ j.ecoenv.2020.110658.
[20] Zhou Y, He Y, He Y, et al. Analyses of tetracycline adsorption on alkali-acid modified magnetic biochar: Site energy distribution consideration [J]. Science of the Total Environment, 2018,650:2260-2266.
[21] Shen X, Li S, Zhang H,et al. Effect of multiwalled carbon nanotubes on uptake of pyrene by cucumber (Cucumis sativus L.): Mechanistic perspectives [J]. NanoImpact, 2018,10:168-176.
[22] Shen X, Wang X, Tao S, et al. Displacement and competitive sorption of organic pollutants on multiwalled carbon nanotubes [J]. Environmental Science & Pollution Research, 2014,21(20):11979- 11986.
[23] Shen X, Guo X, Zhang M, et al. Sorption mechanisms of organic compounds by carbonaceous materials: Site energy distribution consideration [J]. Environmental Science & Technology, 2015,49(8): 4894-4902.
[24] Yuan G, Xing B. Site-energy distribution analysis of organic chemicals sorption by soil organic matter [J]. Soil Science, 1999, 164(7):503-509.
[25] Wang X P, Chen A X, Chen B, et al. Competitive adsorption of phenol and bisphenol A on sediment by site energy distribution theory [J]. Acta Scientiae Circumstantiae, 2019,39(4):1220-1225.
[26] 王 亮,田伟君,乔凯丽,等.改性大豆秸秆生物炭对咪唑乙烟酸的吸附 [J]. 中国环境科学, 2020,40(10):4488-4495.
Wang L, Tian W J, Qiao K L, et al. Adsorption of Imidazolium by Modified Soybean Straw Biochar [J]. China Environmental Science, 2020,40(10):4488-4495.
[27] Zhang B, Zhao R, Sun D, et al. Sustainable fabrication of graphene oxide/manganese oxide composites for removing phenolic compounds by adsorption-oxidation process [J]. Journal of Cleaner Production, 2019,215:165-174.
[28] Gotovac S, Song L, Kanoh H, et al. Assembly structure control of single wall carbon nanotubes with liquid phase naphthalene adsorption [J]. Colloids & Surfaces A Physicochemical & Engineering Aspects, 2007,300(1/2):117-121.
[29] Pyrzynska K, Stafiej A, Biesaga M. Sorption behavior of acidic herbicides on carbon nanotubes [J]. Microchimica. Acta, 2007, 159(3/4):293-298.
[30] Qu Y F, Ma Y W, Wan J Q, et al. Quantitative structure-property relationships on n-octanol/water partition coefficients of phthalic acid esters [J]. Environmental Chemistry, 2017,36(11):2325-2332.
[31] 刘 宁,吴明红,徐 刚,等.邻苯二甲酸二乙酯(DEP)的电子束辐照降解 [C].//中国核学会学术年会.中国核学会, 2009,11(1):9-14.
Liu N, Wu M H, Xu G, et al. Degradation of diethyl phthalate (DEP) by electron beam irradiation [C].//Chinese Nuclear Society Annual Conference. Chinese Nuclear Society, 2009,11(1):9-14.
[32] He Y, Yao T, Tan S, et al. Effects of pH and gallic acid on the adsorption of two ionizable organic contaminants to rice straw-derived biochar-amended soils [J]. Ecotoxicology and Environmental Safety, 2019,184:DOI:10.1016/j.ecoenv.2019.109656.
[33] 张金龙,李霄云,包万鸿,等.邻苯二甲酸和苯甲酸在功能化碳纳米管上的吸附行为[J]. 中国环境科学, 2018,38(11):4106-4113.
Zhang J L, Li X Y, Bao W H, et al. Adsorption behavior of phthalic acid and benzoic acid on functionalized carbon nanotubes [J]. China Environmental Science, 2018,38(11):4106-4113.
[34] Carter M C, Olmstead W K P. Designing water treatment facilities || effects of background dissolved organic matter on TCE adsorption by GAC [J]. Journal (American Water Works Association), 1992,84(8): 81-91.
Sorption of phthalic acid esters and low-molecular weight acid on carbon nanotubes.
SUN Tian-hang1, SHEN Xiao-fang1*, ZHANG Zhan-en1,2, CHEN Shu-min1, LIU Dan1, XU Shu-yi1, CHEN Yong-hong1, ZHANG Meng3, GUO Xiao-ying4
(1.School of Environmental Science and Engineering, Suzhou University of Science and Technology, Suzhou 215000, China;2.Innovation Center of Water Treatment Technology and Material, Suzhou University of Science and Technology, Suzhou 215000, China;3.College of Biology and the Environment, Nanjing Forestry University, Nanjing 210037, China;4.School of Ecology and Environment, Zhengzhou University, Zhengzhou 450001, China)., 2021,41(6):2717~2724
Phthalic acid (PA) and diethyl phthalate (DEP) were the target pollutants, and carbon nanotubes (CNTs) were used as sorbents. Based on the sorption site energy distribution theory, the competitive and displacement sorption of DEP by PA on CNTs were analyzed by the single- and dual-solute sorption experiments under different pH conditions. Sorption intensity of DEP on CNTs was stronger than that of PA under specific pH condition. For the sorption of DEP on CNTs, the dispersion stability of CNTs affected by the solution pH was the dominant factor to the sorption process. For the sorption of PA, both of the surface charge of CNTs and the dissociation degree of PA affected by solution pH, impacted the sorption process. In the dual-solute system, PA had competition and displacement effects on the sorption of DEP by CNTs. Under different pH conditions, the competition and displacement strength of PA to the sorption of DEP on CNTs was related to the dispersion stability of CNTs and the degree of dissociation of PA. Analysis based on site energy distribution showed that the number of available low-energy sorption sites increased although the addition of PA caused a significant decrease in the number of available high-energy sorption sites for DEP on CNTs.
site energy distribution;competitive sorption;displacement sorption;carbon nanotubes;phthalic acid;diethyl phthalate
X522
A
1000-6923(2021)06-2717-08
孙天杭(1995-),女,江苏南通人,苏州科技大学硕士研究生,主要研究方向为环境监测技术.
2020-10-21
国家自然科学基金资助项目(41701545);苏州科技大学科学研究基金(331711204)
* 责任作者, 讲师, xiaofang@mail.usts.edu.cn
