MiR-193a-3p通过调控S100A4表达对oxLDL诱导的血管内皮细胞损伤影响
2021-07-21王彬齐县伟张宪亮
王彬,齐县伟,张宪亮
动脉粥样硬化是临床常见疾病之一,其发生发展与内皮细胞损伤有关,内皮细胞功能紊乱是心血管疾病的早期病理特征之一,研究表明内皮细胞损伤可引起动脉粥样硬化发生及发展[1]。氧化型低密度脂蛋白(oxLDL)可以促使内皮细胞损伤进而促进动脉粥样硬化的发生,如何减轻内皮细胞损伤成为预防及治疗心血管疾病的重点研究[2,3]。微小RNA(miRNA)可调控细胞增殖、分化、凋亡等过程,研究表明miRNA可参与oxLDL诱导的主动脉内皮细胞损伤过程[4],积极探寻新型miRNA分子有助于揭示血管内皮细胞损伤的分子机制。微小RNA-193a-3p(miR-193a-3p)在骨关节炎中表达下调,上调其表达可抑制炎症因子的表达及细胞凋亡[5]。但miR-193a-3p在动脉粥样硬化发生发展中的作用机制尚处未知。生物信息学分析显示S100钙结合蛋白A4(S100A4)可能是miR-193a-3p的靶基因,S100A4可促进炎症反应的发生,并可在动脉粥硬化斑块内上调表达[6,7]。但miR-193a-3p是否可通过调控S100A4表达而影响oxLDL诱导的血管内皮细胞损伤尚未可知。因此,本研究通过oxLDL诱导的血管内皮细胞,观察miR-193a-3p与S100A4的表达变化,探讨其对细胞氧化应激及细胞凋亡的影响,为miR-193a-3p靶向调控S100A4治疗动脉粥样硬化的临床应用提供理论依据。
1 材料与方法
1.1 材料与试剂人脐静脉血管内皮细胞株EVC-304(美国ATCC细胞库)。oxLDL(上海鲁汶生物科技有限公司)。杜氏改良培养基(DMEM)、胎牛血清(美国Gibco公司);Lipofectamine 2000(美国Invitrogen公司);Trizol试剂(北京全式金生物技术有限公司);反转录及SYBR荧光染料试剂盒(日本TaKaRa公司);miR-193a-3p寡核苷酸模拟物(miR-193a-3p mimics)及阴性对照mimic NC序列(miR-NC)、S100A4小干扰RNA(si-S100A4)、乱序无意义阴性序列(si-NC)、miR-193a-3p特异性寡核苷酸抑制剂(anti-miR-193a-3p)、阴性对照序列(anti-miR-NC)(上海吉玛制药技术有限公司);pcDNA3.1(上海柯雷生物科技有限公司);细胞凋亡试剂盒(美国Sigma公司);兔抗人S100A4抗体(美国Santa Cruz公司);兔抗人Bax、Bcl-2抗体(美国CST公司);辣根过氧化物酶(HRP)标记的山羊抗兔IgG二抗(北京中杉金桥生物公司);超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)活性检测试剂盒(上海碧云天生物技术有限公司);丙二醛(MDA)含量检测试剂盒(北京吉美生物技术有限公司)。
1.2 方法
1.2.1 细胞培养及实验分组EVC-304细胞加入0.25%胰蛋白酶消化,调整细胞密度为1×106/ml,接种于24孔板(100 μl/孔),使用含有100 μg/ml的oxLDL的培养基处理细胞24 h[8],命名为oxLDL组,将未经任何处理的细胞作为Con组。分别将miR-NC、miR-193a-3p mimics、si-NC、si-S100A4、miR-193a-3p mimics与pcDNA、miR-193a-3p mimics与pcDNA-S100A4转染至EVC-304细胞48 h,用含有100 μg/ml的oxLDL的培养基处理细胞24 h,分别命名为oxLDL+miRNC组、oxLDL+miR-193a-3p组、oxLDL+si-NC组、oxLDL+si-S100A4组、oxLDL+miR-193a-3p+pcDNA组、oxLDL+miR-193a-3p+pcDN A-S100A 4组。转染过程参照Lipofectamine2000试剂说明书。
1.2.2 qRT-PCR检测细胞中miR-193a-3p、S100A4 mRNA的表达水平采用Trizol法提取细胞中总RNA,应用紫外分光光度计测定RNA浓度。根据反转录试剂盒说明书操作将总RNA反转录合成cDNA。参照荧光定量PCR试剂盒说明书配置反应体系,反应条件:95℃ 2 min,95℃ 15 s,60℃ 30 s,72℃ 30 s,共循环40次。miR-193a-3p以U6为内参,S100A4以GAPDH为内参,采用2-ΔΔCt法计算miR-193a-3p、S100A4 mRNA的相对表达量。
1.2.3 检测MDA含量与SOD、GSH-Px活性收集各组细胞,加入裂解液,冰上裂解2 h,离心收集上清液,采用硫代巴比妥酸法检测MDA含量,采用黄嘌呤氧化酶法检测SOD活性,按照试剂盒说明书检测GSH-Px活性。
1.2.4 流式细胞术检测细胞凋亡率收集各组EVC-304细胞,预冷PBS洗涤,收集细胞沉淀,加入500 μl Binding Buffer悬浮细胞,参照细胞凋亡检测试剂盒依次加入5 μl Annexin V-FITC与5 μl PI,应用流式细胞仪检测细胞凋亡率。
1.2.5 双荧光素酶报告基因检测miR-193a-3p的靶基因StarBase预测显示S100A4的3’UTR区含有miR-193a-3p的结合位点,构建野生型载体WT-S100A4、突变型载体MUT-S100A4,分别将WT-S100A4、MUT-S100A4与miR-NC、miR-193a-3p mimics共转染至EVC-304细胞,继续培养48 h,检测各组荧光素酶活性。分别将miRNC、miR-193a-3p mimics、anti-miR-NC、antimiR-193a-3p转染至EVC-304细胞,继续培养 48 h,收集细胞,采用蛋白免疫印迹法(Western blot)检测各组细胞中S100A4蛋白水平。
1.2.6 Western blot检测S100A4、Bax、Bcl-2蛋白表达收集各组EVC-304细胞,加入适量RIPA蛋白裂解液,冰上裂解30 min,4℃条件下经 12 000 r/min离心15 min,收集上清液。检测蛋白浓度,SDS-PAGE分离蛋白,转膜、封闭,加入S100A4、Bax、Bcl-2一抗稀释液(1:1000),4℃孵育24 h,分别加入二抗稀释液(1:2000),滴加ECL显影,采用Quantityone软件检测条带灰度值。
1.3 统计学处理应用SPSS 21.0统计学软件分析数据,计量资料以(±s)表示且均符合正态分布,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析,两组间比较采用LSD-t检验,P<0.05为差异具有统计学意义。
2 结果
2.1 miR-193a-3p和S100A4在oxLDL诱导的血管内皮细胞损伤中的表达与Con组比较,oxLDL组血管内皮细胞中miR-193a-3p的表达水平显著降低(P<0.05),S100A4 mRNA及蛋白表达水平显著升高(P<0.05)(图1,表1)。

图1 S100A4蛋白表达
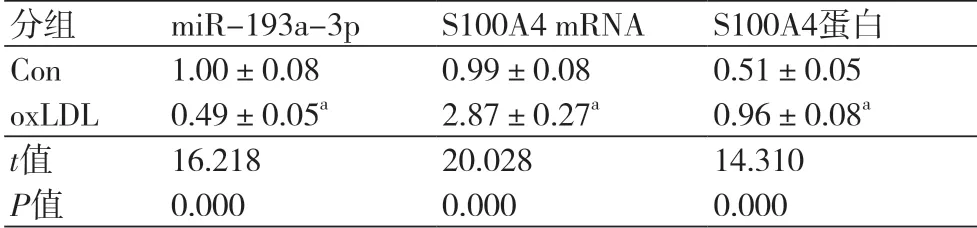
表1 miR-193a-3p和S100A4在oxLDL诱导的血管内皮细胞损伤中的表达(n=9)
2.2 miR-193a-3p过表达对oxLDL诱导的血管内皮细胞氧化应激的影响与Con组比较,oxLDL组血管内皮细胞中MDA含量显著升高(P<0.05),SOD、GSH-Px活性显著降低(P<0.05);与oxLDL+miR-NC组比较,oxLDL+miR-193a-3p组血管内皮细胞中MDA含量显著降低(P<0.05),SOD、GSH-Px活性显著升高(P<0.05)(表2)。

表2 miR-193a-3p过表达对oxLDL诱导的血管内皮细胞氧化应激的影响(n=9)
2.3 miR-193a-3p过表达对oxLDL诱导的血管内皮细胞凋亡的影响与Con组比较,oxLDL组血管内皮细胞凋亡率显著升高(P<0.05),Bax蛋白水平显著升高(P<0.05),Bcl-2蛋白水平显著降低(P<0.05);与oxLDL+miR-NC组比较,oxLDL+miR-193a-3p组血管内皮细胞凋亡率显著降低(P<0.05),Bax蛋白水平显著降低(P<0.05),Bcl-2蛋白水平显著升高(P<0.05)(图2,表3)。
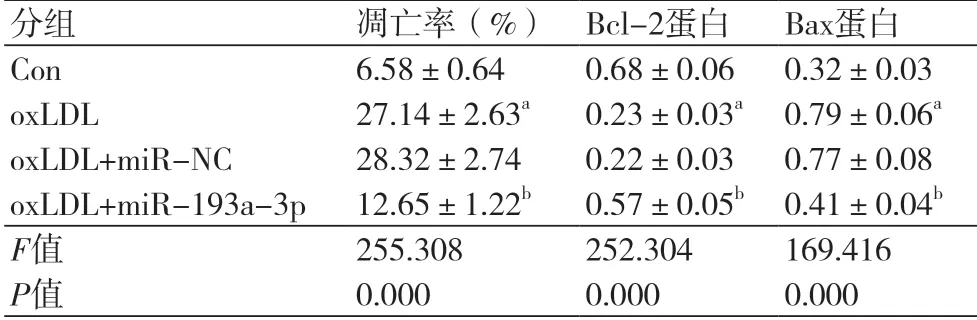
表3 miR-193a-3p过表达对oxLDL诱导的血管内皮细胞凋亡的影响(n=9)

图2 miR-193a-3p过表达对oxLDL诱导的血管内皮细胞凋亡的影响(A:凋亡相关蛋白表达;B:细胞凋亡流式图)
2.4 抑制S100A4表达对oxLDL诱导的血管内皮细胞损伤的影响与oxLDL+si-NC组比较,oxLDL+si-S100A4组血管内皮细胞中MDA含量显著降低(P<0.05),SOD、GSH-Px活性显著升高(P<0.05),细胞凋亡率显著降低(P<0.05),Bax蛋白水平显著降低(P<0.05),Bcl-2蛋白水平显著升高(P<0.05)(图3,表4)。
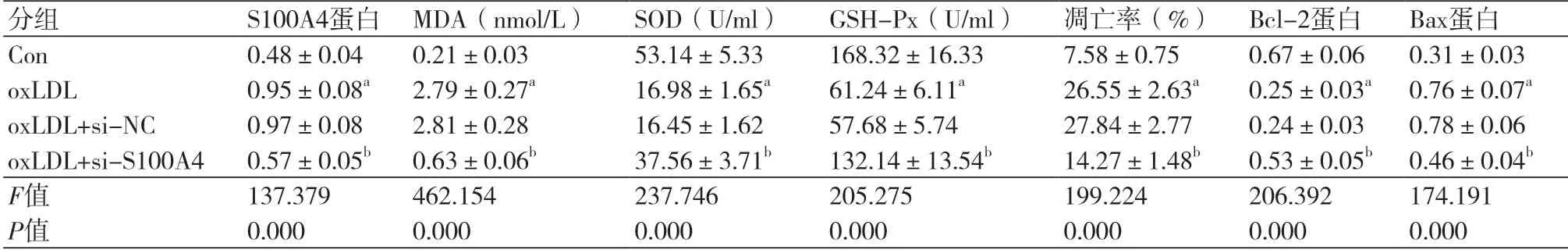
表4 抑制S100A4表达对oxLDL诱导的血管内皮细胞损伤的影响(n=9)
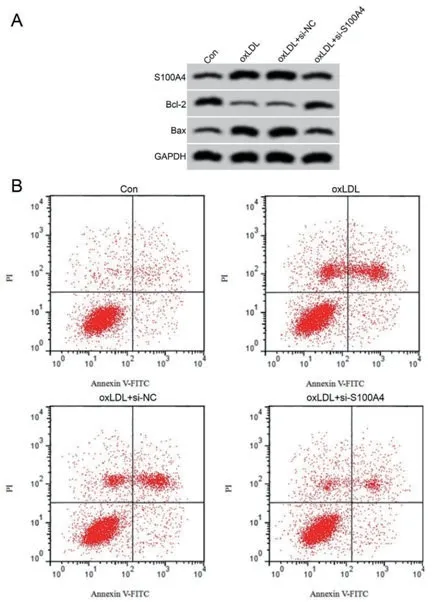
图3 抑制S100A4表达对oxLDL诱导的血管内皮细胞损伤的影响(A:S100A4和凋亡相关蛋白表达;B:细胞凋亡流式图)
2.5 miR-193a-3p靶向调控S100A4的表达StarBase预测显示miR-193a-3p与S100A4存在结合位点(图4A)。双荧光素酶报告实验结果显示,转染野生型载体WT-S100A4的细胞实验中,miR-193a-3p组荧光素酶活性显著低于miR-NC组(P<0.05);转染突变型载体MUT-S100A4的细胞实验中,miR-193a-3p组荧光素酶活性与miRNC组比较差异无统计学意义(P>0.05)(表5)。Western blot检测结果显示,与miR-NC组比较,miR-193a-3p组细胞中S100A4蛋白水平显著降低(P<0.05);与anti-miR-NC组比较,antimiR-193a-3p组细胞中S100A4蛋白水平显著升高(P<0.05)(图4B,表6)。

表5 双荧光素酶报告实验(n=9)

表6 miR-193a-3p调控S100A4的表达(n=9)

图4 miR-193a-3p靶向调控S100A4的表达(A: S100A4的3’UTR中含有与miR-193a-3p互补的核苷酸序列;B:S100A4蛋白表达)
2.6 S100A4过表达逆转了miR-193a-3p过表达对oxLDL诱导的血管内皮细胞损伤的作用与oxLDL+miR-193a-3p+pcDNA组比较,oxLDL+miR-193a-3p+pcDNA-S100A4组血管内皮细胞中MDA含量显著升高(P<0.05),SOD、GSH-Px活性显著降低(P<0.05),细胞凋亡率显著升高(P<0.05),Bax蛋白水平显著升高(P<0.05),Bcl-2蛋白水平显著降低(P<0.05)(图5,表7)。
3 讨论
oxLDL可引起内皮细胞氧化应激损伤而促进动脉粥样硬化的发生及发展,调控miRNA表达可减轻内皮细胞损伤及抑制炎症因子的释放[9,10]。但仍有部分miRNA在血管内皮细胞损伤过程中的分子机制尚未阐明,因而本研究积极探索新型miRNA分子并分析其对oxLDL诱导的血管内皮细胞损伤的影响及其分子机制。
miR-193a-3p表达水平升高可抑制肠道炎症反应的发生[11]。研究表明miR-193a-3p表达量降低可促进脂多糖诱导的细胞凋亡及炎性损伤[12]。相关报道指出miR-193a-3p在阿尔茨海默病患者和阿尔茨海默病细胞模型中表达下调,过表达miR-193a-3p可降低Aβ25-35诱导的PC12细胞凋亡[13]。与上述研究报道相似,本研究结果显示miR-193a-3p在oxLDL诱导的血管内皮细胞中表达下调,提示miR-193a-3p表达量降低可能促进oxLDL诱导的血管内皮细胞损伤。本研究结果显示oxLDL处理后血管内皮细胞中MDA含量升高,而SOD、GSH-Px活性降低,进一步分析显示miR-193a-3p过表达后明显降低MDA含量,增强SOD、GSH-Px活性。研究表明氧化应激是造成动脉粥样硬化血管内皮细胞损伤的重要分子机制,oxLDL可促使血管内皮细胞中SOD、GSHPx活性降低,增加MDA含量,细胞中MDA含量与SOD、GSH-Px活性可间接反映细胞氧化损伤程度[14,15]。本研究结果提示miR-193a-3p过表达具有抗oxLDL诱导的血管内皮细胞氧化损伤的作用。研究表明氧化应激水平升高还可能促进细胞凋亡,Bcl-2属于抑制细胞凋亡的关键蛋白,其表达增强可抑制细胞凋亡,Bax是促凋亡蛋白,其表达增强可诱导细胞凋亡,Bax与Bcl-2可通过调控线粒体膜通透性调节细胞凋亡[16]。本研究结果显示oxLDL处理后血管内皮细胞凋亡率显著升高,而miR-193a-3p过表达能够明显降低血管内皮细胞凋亡率,还可抑制Bax表达,促进Bcl-2表达,提示miR-193a-3p过表达可降低血管内皮细胞凋亡率而保护血管内皮细胞。
S100A4表达量升高可促进脂多糖诱导的小鼠子宫内膜炎的发展[17]。研究表明S100A4表达量升高可促进骨质疏松症的发生及发展[18]。相关报道指出S100A4在不稳定型心绞痛患者血浆中表达上调,其表达量升高可增加心血管疾病发生的风险[19]。与上述研究结果相似,本研究结果显示oxLDL诱导的血管内皮细胞中S100A4的表达量明显增高,进一步分析显示抑制S100A4表达可明显减弱oxLDL诱导的血管内皮细胞氧化损伤,并可降低MDA含量及增强SOD、GSH-Px活性,还可抑制oxLDL诱导的血管内皮细胞凋亡,其主要机制可能是通过调控Bax、Bcl-2蛋白表达而发挥作用。提示抑制S100A4表达可明显抑制oxLDL诱导的血管内皮细胞氧化损伤及细胞凋亡。研究通过双荧光素酶报告实验与Western blot实验证实miR-193a-3p能够靶向结合S100A4,还可负向调控S100A4的表达,进一步研究显示S100A4过表达可明显减弱miR-193a-3p过表达对oxLDL诱导的血管内皮细胞损伤的作用,提示miR-193a-3p过表达可能通过靶向调控S100A4的表达从而增强oxLDL诱导的血管内皮细胞抗氧化能力,并可抑制细胞凋亡,从而对血管内皮细胞发挥保护作用。
综上所述,miR-193a-3p可靶向调控S100A4表达从而减轻oxLDL诱导的血管内皮细胞氧化损伤及抑制细胞凋亡,可为揭示血管内皮细胞损伤修复的分子机制提供理论依据,还可为临床上动脉粥样硬化的靶向治疗提供科学依据。
