链带藻Desmodesmus sp. QL96蛋白质的营养价值评价与生理活性研究
2021-07-20程慧莹李贵丽韩志萍权乔凤李甜甜李积华王飞
程慧莹 李贵丽 韩志萍 权乔凤 李甜甜 李积华 王飞


摘 要:链带藻Desmodesmus sp. QL96是从我国西藏地区分离的一株链带藻,前期研究表明其含有丰富的蛋白质。本文对这株链带藻的主要细胞组分的含量进行了检测,并采用改进的TCA-丙酮法提取其蛋白质,分析了蛋白粗提物的氨基酸组成及其体外抗氧化和抑菌活性。结果表明:链带藻Desmodesmus. sp. QL96的蛋白质平均含量为(56.653.76)%,蛋白粗提物中含有17种氨基酸,其中7种人体必需氨基酸含量占总氨基酸含量的26.86%;Desmodesmus sp. QL96蛋白质具有一定的自由基清除能力,对·OH和DPPH·的半数清除浓度(IC50)分别为0.18、7.88 mg/mL;Desmodesmus sp. QL96蛋白质具有一定的抑菌作用,对化脓性链球菌、大肠杆菌和鼠伤寒沙门氏菌的最小抑菌浓度(MIC)分别为1.56、3.13、1.56 mg/mL。本研究为该链带藻进一步开发功能性蛋白提供了依据与参考。
关键词:链带藻;蛋白质;营养价值;抗氧化;抑菌
中图分类号:TS201.2 文献标识码:A
Abstract: Microalga Desmodesmus sp. QL96 was originally isolated from Tibet, China. Previous studies have shown that it is rich in protein. In this work, the primary cell compositions were determined, and proteins were extracted by the improved TCA-acetone method. The amino acid composition, antioxidant and antibacterial activity of the extracted proteins were analyzed. The results suggested that the mean protein content of the microalga was (56.65±3.76)%. The raw proteins were tested to contain 17 amino acids, including 7 essential amino acids which accounted for 26.86% of the total amino acids. The extracted proteins showed scavenging ability against free radical, with the half scavenging concentration (IC50) of ·OH and DPPH· being 0.18 and 7.88 mg/mL, respectively. Also, an inhibition against bacteria was demonstrated by the raw protein, with the minimum inhibitory concentration against Streptococcus pyogenes, Escherichia coli and Salmonella typhimurium being 1.56, 3.13, 1.56 mg/mL, respectively. This study could provide a basis and reference for the further development of functional proteins of Desmodesmus sp. QL96.
Keywords: Desmodesmus; protein; nutrition value; antioxidant; antibacterial
DOI: 10.3969/j.issn.1000-2561.2021.05.033
微藻是一种微型藻类生物,生长在各种水域中,其个体细小,只有在显微镜下才能分辨其形态[1]。微藻是自养生物,通过光合作用将二氧化碳等无机物转化成有机物,供自身生长需要,其细胞代谢产物包括多糖、蛋白质、脂类、维生素等多种高价值的营养成分和化工原料,具有重大的经济价值[2]。因其潜在的经济价值,微藻逐渐成为研究领域的重点课题,我国的研究人员先后从巢湖蓝藻中发现了荧光蛋白[3],培育了耐热微藻[4],分离了诸多产油微藻[5-6],以及将微藻应用于环境污染治理当中[7-8],研发的技术中已有部分实现了转化。目前蓝藻门的螺旋藻和绿藻门的小球藻得到了较好地开发,微藻虾青素、微藻饲料等产品已经开始市售。
Desmodesmus sp. QL96是从我国西藏那曲地区分离出来的一种微藻,属于链带藻[9]。前期研究结果表明,在特定条件下,Desmodesmus sp. QL96细胞中蛋白质含量最高达细胞干重的71.68%(W/W),是目前报道的蛋白质含量较高的微藻种类之一,与小球藻、螺旋藻等公认的蛋白高产微藻中蛋白质含量相当[9],较常见的蛋白食品如牛肉、鸡蛋、黄豆等的蛋白含量高约14%~ 50% [10],具有潜在的开发价值。
微藻蛋白資源近年来受到越来越多的关注,其中螺旋藻和小球藻相关的研究最多[10]。研究证明,螺旋藻蛋白有助于降低人体的甘油三酯水平,同时增加高密度脂蛋白水平,具有开发新型营养素辅助治疗肥胖和糖尿病的潜力[11-12];小球藻的蛋白降解产物在体外具有抗氧化、抗癌、消炎、降血压4种功效[13];藻蓝蛋白因其在红光区有最大激发峰的特性,较多地应用于荧光探针,还可作为医学中的光敏剂和抗肿瘤物质[14];蓝藻菌中的类菌胞素氨基酸由于在紫外光区有较强的吸收能力,在防晒化妆品中具有广阔的应用前景[15]。
在前期研究基础上,本研究探索了常温常压条件下链带藻Desmodesmus sp. QL96细胞中各成分的含量,针对含量最高的组分(蛋白质)进行了分离提取,分析其氨基酸组成,并对其体外抗氧化和抑菌活性开展试验,旨在探讨链带藻Desmodesmus sp. QL96蛋白质的营养价值和对人体健康的改善作用,有利于后续的功能性蛋白产品的生产研发。
1 材料与方法
1.1 材料
1.1.1 材料与试剂 本研究所用的链带藻Des-modesmus sp. QL96是由中国科学院水生生物研究所提供。该链带藻是从海拔4500 m左右的西藏那曲青龙乡巴木错湖分离得到[9]。
试验菌种:3种革兰氏阳性菌,分别为金黄色葡萄球菌、化脓性链球菌、单增李斯特菌;3种革兰氏阴性菌,分别为大肠埃希氏杆菌、鼠伤寒沙门氏菌、铜绿假单胞菌。所有菌株均为本实验室保藏。
BG11培养基、磷酸氢二钠、磷酸二氢钠、甲醇、丙酮、柠檬酸、柠檬酸钠,均为分析纯,广州光华科技股份有限公司;AAS18-10ML型氨基酸标品,上海北诺生物科技有限公司。
1.1.2 仪器与设备 ZQZY-88BV型恒温光照培养箱,上海知楚仪器仪器有限公司;3-30K型低温高速离心机,美国Sigma-Aldrich公司;835-50型氨基酸自动分析仪,日本日立公司;UV-6100型紫外分光光度计,上海美谱达仪器有限公司。
1.2 方法
1.2.1 链带藻Desmodesmus sp. QL96的培养及预处理 链带藻Desmodesmus sp. QL96的培养选用BG11培养基(氮∶碳∶磷含量=75∶1∶2)。在无菌操作条件下,将100 mL的藻液装入250 mL的三角瓶中,并确保每瓶接种的微藻细胞数为5107个。培养条件为温度25 ℃、光照强度8000 lx、光暗周期比12 h∶12 h。培养过程中定时摇晃培养物,3~5次/d。在细胞生长中期12 d时通过抽滤进行收集,再进行真空冷冻干燥获得冻干藻粉,于?20 ℃下保存。
1.2.2 主要营养成分分析 将冻干藻粉复溶于pH 7.4的磷酸盐缓冲液(74∶1,V/V),并加入25%(W/V)的氢氧化钠甲醇溶液[15],制备细胞溶解液,参照 Chen等[16]的方法测定其中的总糖、蛋白质、脂质、叶绿素和类胡萝卜素的含量。
1.2.3 蛋白质提取方法 采用改进的TCA-丙酮法提取链带藻蛋白质。称取适量冻干藻粉于研钵中,为防止蛋白质分解或变性失活,须将研钵置于冰上降温研磨,然后用0.67%(W/V)的磷酸盐缓冲液对微藻粉进行反复洗脱。待悬浮液静置4 h左右后,于4 ℃、8460 r/min离心15 min,取上清液。随后加入5倍体积含10%(W/V)TCA的丙酮溶液,在?20 ℃下静置4 h或过夜,再次离心(11580 r/min、4 ℃、15 min),得到沉淀。采用预冷的丙酮溶液进行清洗、离心,重复2~3次,直至沉淀中的杂质被完全清洗干净。在常温条件下,将沉淀物干燥5 min后用于氨基酸定性定量分析。
1.2.4 氨基酸定性定量分析 氨基酸定性定量分析采用氨基酸自动分析仪进行,分析条件参照GB/T 5009.124—2016[17]。具体条件如下:色谱柱采用磺酸型阳离子树脂分离柱(4.6 mm×6.0 mm),进样量为30 μL;检测器为荧光检测器;流动相采用磷酸盐缓冲液(0.01 mol/L、pH 7.0),流速为0.5 mL/min;分离柱柱温为57 ℃,反应柱温为135 ℃;检测波长通道1为570 nm,通道2为440 nm。
取1 mL样品加到入玻璃水解管中,加入10 mL 6 mol/L的HCl溶液,加重蒸酚3~4滴,冷却5 min后,向水解管中充入一定量的氮气,迅速封管,使样品在110 ℃下水解22 h。水解反应完毕,冷却后打开水解管,将水解液全部移至50 mL容量瓶中,用去离子水清洗、过滤及定容。再取2 mL滤液真空冷冻干。加入1 mL磷酸盐缓冲液(0.01 mol/L、pH 7.0),过0.22 μm滤膜后上机。采用外标法测定链带藻Desmodesmus sp. QL96蛋白质中氨基酸含量。
1.2.5 蛋白营养价值评价方法 通过FAO/WHO建议的氨基酸评价体系对链带藻Desmodesmus sp. QL96氨基酸进行营养价值评价。选取研究较广泛的螺旋藻Spirulina、小球藻Chlorella sorokiniana C74以及Desmodesmus sp. WC08与Desmodesmus sp. QL96进行氨基酸评价比较[2, 14]。
采用氨基酸比值系数法对链带藻Desmo?desmus sp. QL96蛋白质中氨基酸进行营养价值分析。氨基酸比值系数法是世界卫生组织/联合国粮农组织(WHO/FAO)的必需氨基酸计算模式,计算蛋白质样品中的必需氨基酸总量(essential amino acid, EAA)、氨基酸总量(total amino acid, TAA)、氨基酸比值(ratio of amino acid, RAA)、氨基酸比值系数(ratio coefficient of amino acid, RC)与比值系数分(score of ratio coefficient of amino acid, SRCAA)。
1.2.6 蛋白质抗氧化能力测定 (1)羟基自由基清除能力测定。采用邻二氮菲法对Desmodesmus sp. QL96蛋白质清除羟基自由基的能力进行测定。吸取7.5 mmol/L的邻二氮菲0.15 mL,加入0.4 mL 磷酸盐缓冲液(pH 7.0、0.1 mol/L),0.25 mL去离子水和0.1 mL的0.75 mmol/L硫酸亞铁溶液并振荡混匀。加入0.1 mL不同浓度(0.2、0.4、0.6、0.8、1.0 mg/mL)的待测样品和0.1 mL 1%的双氧水的反应管吸光度记作A0;二者均不加记作A1;只加入0.1 mL不同待测样品的记作A;加入0.1 mL去离子水和0.1 mL 1%的双氧水的反应管吸光度记作A2。4组反应管均在37 ℃恒温箱中保温60 min,以去离子水调零,用紫外分光光度计测定其在536 nm处的吸光度,根据下列公式计算·OH清除率。
1.2.7 蛋白质抑菌活性测定 (1)最小抑菌浓度(MIC)的测定。采用试管法测定链带藻Desmo-desmus sp. QL96蛋白质的最小抑菌浓度。取0.1 mL细菌量为105~106 CFU/mL的各菌悬液,移入含有1.4 mL液体培养基的试管中,加入不同浓度的蛋白质样品溶液1 mL并振荡混匀。37 ℃培养24 h,用无菌水做空白对照,紫外分光光度计测定其在600 nm处吸光度。
(2)抑菌圈直径的测定。将事先灭好菌的营养琼脂培养基倒入一次性无菌培养皿,每个皿倾倒约20 mL,待其凝固后备用。向倾倒好的培养皿中分别加入100 μL的细菌菌悬液,依次涂布平板,每种细菌平板设置3个平行。涂布平板后,将灭菌的滤纸片(直径为0.6 cm)小心地放到培养基上,按照浓度梯度顺序向每张滤纸片上滴加4.0 mg/mL蛋白质水溶液10 μL,加样完成后,将培养皿放到培养箱中37 ℃培养24 h,测量抑菌圈的直径。以无菌水做空白对照,5%苯甲酸钠为阳性对照。
1.3 数据处理
每组实验均进行3次重复,采用Origin 8.5软件进行数据分析并制图。
2 结果与分析
2.1 链带藻Desmodesmus sp. QL96的主要营养成分
链带藻Desmodesmus sp. QL96成分分析结果见表1。Desmodesmus sp. QL96在BG11培养基中25 ℃下生长的主要细胞代谢产物是蛋白质,含量平均占细胞干重的(56.653.76)%;其次为脂质含量约占(10.500.19)%;碳水化合物约占(7.64 0.76)%。其他代谢物如叶绿素和类胡萝卜素的含量均小于1.5%。Desmodesmus sp. QL96的蛋白质含量颇高,优于小球藻和普通食物蛋白含量,与螺旋藻的产蛋白质能力不分伯仲。深入研究其氨基酸组成与生理活性对于营养价值评价具有指导性作用。
2.2 Desmodesmus sp. QL96蛋白质的氨基酸组成
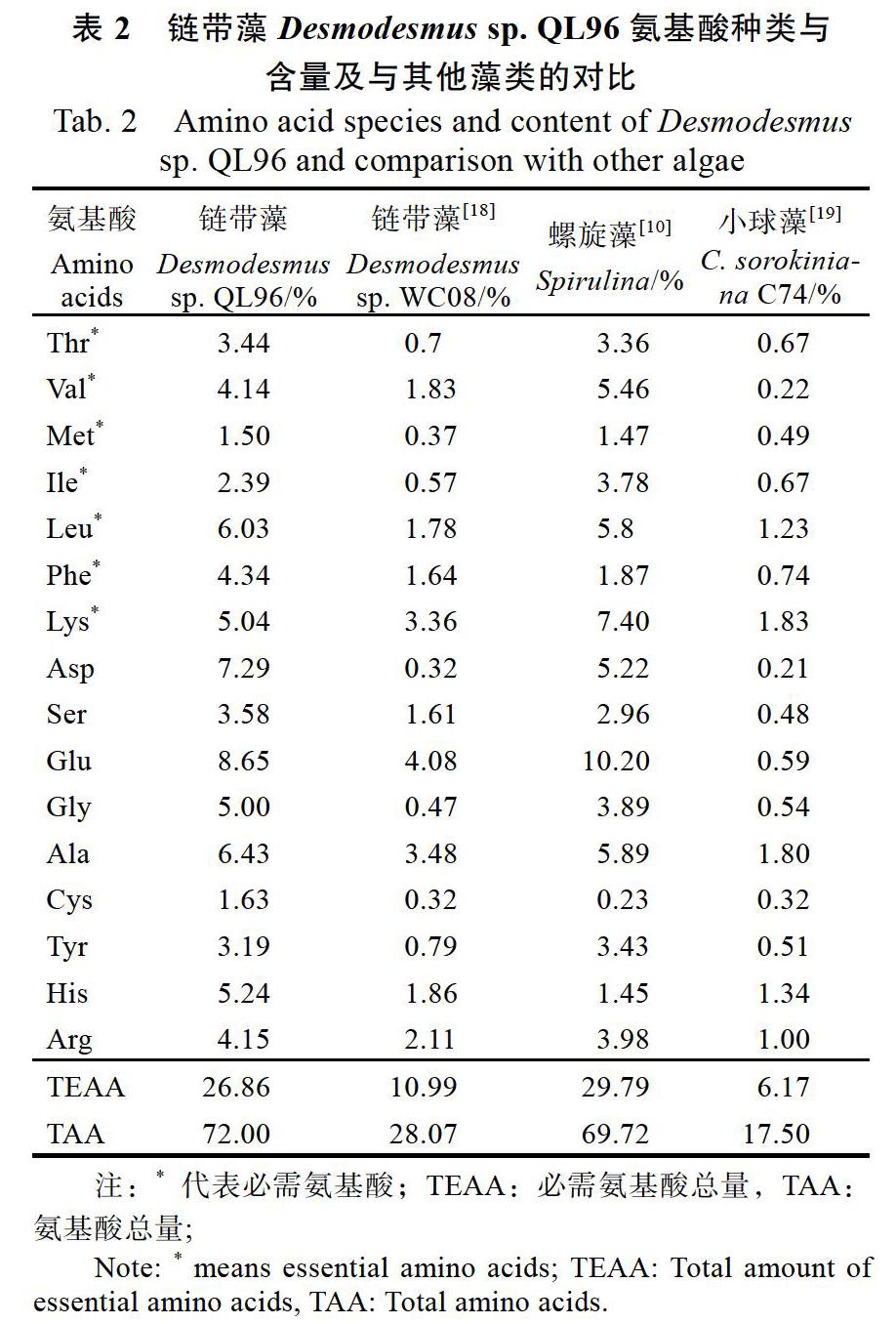
氨基酸是构成人体营养所需蛋白质的基本物质,不仅为蛋白质的合成提供原料,并且为人体正常代谢、维持生命提供了物质基础。Desmo?desmus sp. QL96蛋白质氨基酸检测结果表明,Desmodesmus sp. QL96蛋白质中共检测到17种氨基酸,包括7种人体必需氨基酸。氨基酸相对含量72.00%,必需氨基酸含量占比为26.86%(表2)。其中公认具有较高生物活性的谷氨酸、天冬氨酸、丙氨酸和亮氨酸含量分别为8.65%、7.29%、6.43%和6.03%,明显高于小球藻,具有较高的营养价值和潜在应用价值。
我们对比了Desmodesmus sp. QL96和其他3种常见的蛋白高产微藻的氨基酸组成,结果显示氨基酸总量的排列顺序为链带藻Desmodesmus sp. QL96 > 螺旋藻Spirulina > 链带藻Desmodesmus sp.WC08 > 小球藻C. sorokiniana C74;必需氨基酸总量的排列顺序为螺旋藻Spirulina >链带藻Desmodesmus sp. QL96 > 链带藻Desmodesmus sp.WC08 > 小球藻C. sorokiniana C74(表2)。Desmodesmus sp. QL96的氨基酸与必需氨基酸总量均远高于Desmodesmus sp.WC08与小球藻,与目前市面上开发较为广泛的螺旋藻相当,是一种具有开发潜力的蛋白源。
2.3 Desmodesmus sp. QL96蛋白质营养价值评价
一种蛋白质营养价值的高低取决于其所含人体必需氨基酸的种类、含量以及比例,其中尤为重要的是必需氨基酸的组成比例。链带藻Desmodesmus sp. QL96与常见食物和WHO/FAO模式中的EAA值比较结果如表3所示。由表3可知,Desmodesmus sp. QL96蛋白质中除异亮氨酸(Ile)的必需氨基酸总值3.30,低于WHO/FAO模式所规定的4.00值以外,其余监测到的氨基酸的必需氨基酸总值皆高于WHO/ FAO模式的对应值。将Desmodesmus sp. QL96的EAA值与几种常见食物和螺旋藻进行比较,Desmodesmus sp. QL96的EAA值高于黄豆,低于海带和鸡蛋,与螺旋藻和牛肉较为接近。参照WHO/FAO模式提出的蛋白质评价标准模式,Desmodesmus sp. QL96中氨基酸的数量和组成符合蛋白质评价标准模式,说明Desmo?desmus sp. QL96蛋白质营养价值较高,符合人体生理作用的需要。
链带藻Desmodesmus sp. QL96与常见食物中必需氨基酸的RAA、RC和SRCAA值按照公式计算,其值如表4所示。氨基酸比值(RAA)与氨基酸比值系数(RC)指标可考察氨基酸的比例。若食物中蛋白质的氨基酸组成比例与WHO/FAO模式中一致,则RC=1,RC>1表明该种必需氨基酸相对过剩,RC<1表明该种必需氨基酸相对不足,RC最小者为第一限制氨基酸。另可通过比值系数(SRCAA)来考察营养价值,SRCAA=100时,表明必需氨基酸的组成比例与WHO/FAO模式一致,SRCAA越接近100,表明营养价值越高,SRCAA越小,表明营养价值越低。
由表4可见,链带藻Desmodesmus sp. QL96的SRCAA值为100.00,与黄豆、鸡蛋、螺旋藻的SRCAA值相等,高于海帶与牛肉。且由RC值可看出,链带藻Desmodesmus sp. QL96中氨基酸RC值最小为异亮氨酸(Ile),值为0.67;其次为亮氨酸(Leu),值为0.90,即第一限制性氨基酸为异亮氨酸(Ile),第二限制性氨基酸为亮氨酸(Leu)。根据蛋白质互补理论,Desmodesmus sp. QL96蛋白质可与其他富含异亮氨酸与亮氨酸的蛋白质按一定比例混合食用,以达到相互补充氨基酸的目的,从而提高其营养价值。
通过对比链带藻Desmodesmus sp. QL96与常见食物和螺旋藻的各项指标,说明Desmo?desmus sp. QL96氨基酸种类丰富,氨基酸含量与组成比例较为平衡,并且易于被人体消化吸收,是一种优质植物蛋白源。
2.4 Desmodesmus sp. QL96蛋白质的抗氧化能力
链带藻Desmodesmus sp. QL96蛋白质体外抗氧化活性测定结果如图1、图2所示。由图1可知,蛋白质溶液浓度增大有利于提高·OH的清除能力。以维生素C(Vc)作为对照试验组,当Vc浓度为0.6 mg/mL时能清除96.47%的·OH,而Desmodesmus sp. QL96蛋白质浓度为0.8 mg/mL时抑制·OH的能力最强,为83.53%。此后,再增加蛋白质浓度,·OH的清除能力反而略有下降。经数据分析,Desmodesmus sp. QL96蛋白质对·OH的半数清除浓度(IC50)为0.18 mg/mL。结果表明,Desmodesmus sp. QL96蛋白质对·OH有一定的清除能力,但其能力略逊于Vc。
图2所示为不同浓度的Vc和Desmodesmus sp. QL96蛋白质对DPPH·的清除能力。由图可以看出,随着Vc浓度的增大,DPPH·的清除率迅速增强,之后呈平缓趋势;而Desmodesmus sp. QL96蛋白质的DPPH·清除率随蛋白质溶液浓度增大先缓慢增加,之后迅速上升。Vc浓度为0.5 mg/mL时对DPPH·清除率达93.39%,Desmodesmus sp. QL96蛋白质浓度为10 mg/mL时,DPPH·清除率达79.74%。经数据分析,Desmodesmus sp. QL96蛋白質对DPPH·的半数清除浓度(IC50)为7.88 mg/mL。结果表明,Desmodesmus sp. QL96蛋白质也有一定的DPPH·清除能力,但该能力弱于Vc。
2.5 Desmodesmus sp. QL96蛋白质的抑菌活性
表5所示为链带藻Desmodesmus sp. QL96蛋白质对6种常见的细菌的抑菌效果。在所选的6种常见有害细菌中,Desmodesmus sp. QL96蛋白质对化脓性链球菌、大肠杆菌和鼠伤寒沙门氏菌有抑制效果,且抑菌效果皆优于阳性对照5%苯甲酸钠,而对金黄色葡萄球菌、单增李斯特菌和铜绿假单胞菌未检测到抑菌效果。
表6所示为链带藻Desmodesmus sp. QL96蛋白质对表5中具有抑菌效果细菌的最小抑菌浓度(MIC值)。结果表明,Desmodesmus sp. QL96蛋白质对化脓性链球菌、大肠杆菌和鼠伤寒沙门氏菌的最小抑菌浓度(MIC值)分别为1.563、3.125、1.563 mg/mL,这与抑菌圈试验结果一致,也进一步证明Des?mo?desmus sp. QL96蛋白质对化脓性链球菌、大肠杆菌和鼠伤寒沙门氏菌具有抑菌活性。
3 讨论
本研究对链带藻Desmodesmus sp. QL96主要细胞代谢产物进行分析,结果显示蛋白质含量占比达细胞干重的(56.653.76)%,是Desmodesmus sp. QL96的优势产物。采用氨基酸自动分析仪检测出Desmodesmus sp. QL96蛋白质具有17种氨基酸,其中人体必需氨基酸有7种,含量远高于小球藻,与螺旋藻相当。根据WHO/FAO模式计算Desmo-desmus sp. QL96的EAA值为43.90,高于模式标准,氨基酸比值系数为100.00,证实Desmodesmus sp. QL96蛋白质氨基酸种类丰富,必需氨基酸的组成比例适当,且易于人体消化吸收。
Desmodesmus sp. QL96蛋白质具有一定的抗氧化能力。当蛋白水溶液浓度为0.8 mg/mL时,对·OH的清除能力分别达到了83.53%,但对DPPH的清除能力在蛋白浓度为10 mg/mL时达到了79.74%。Desmodesmus sp. QL96蛋白质针对两种自由基所表现出的不同清除能力可能与其作用机制不同,其作用机制可能是由于自由基引起肽键断裂,从而达到清除自由基的效果。据文献报道,藻红蛋白、藻胆蛋白在质量浓度为1 mg/mL时,对应的羟基自由基清除率分别为34.10%、67.42%,明显低于同质量浓度的Desmodesmus sp. QL96蛋白质的羟基自由基清除率[24]。Senthilkumar等[25]研究了红藻来源藻红蛋白质量浓度在4 mg/mL时,DPPH自由基清除率达到最大为29.81%,说明该藻红蛋白DPPH自由基清除能力弱于Desmo?de?smus sp. QL96蛋白质。
抑菌性实验结果表明Desmodesmus sp. QL96蛋白质对化脓性链球菌、大肠杆菌和鼠伤寒沙门氏菌的最小抑菌浓度分别为1.563、3.125、1.563 mg/mL,且对化脓性链球菌和鼠伤寒沙门氏菌的抑菌效果较好。蒋雨晴等[26]采用滤纸片法研究了卵白蛋白水解物对大肠杆菌和沙门氏菌的抑制作用,结果表明在卵白蛋白水解物为2.0 mg/mL时抑菌圈直径最大分别为11.53、9.34 mm,远低于Desmodesmus sp. QL96蛋白质对大肠杆菌和沙门氏菌的抑制效果。但由于抑菌物的作用机理十分复杂,不同物种不同细菌其抑制机理也存在较大差异[27],因此链带藻蛋白质对细菌的抑菌机理与差异还需进一步研究。
本文通过对链带藻Desmodesmus sp. QL96蛋白质的营养价值评价和体外抗氧化、抑菌活性研究,结果表明链带藻Desmodesmus sp. QL96蛋白质具有较高的营养价值,可以作为人或动物食品的蛋白来源,且具有一定的抗氧化活性和抑菌能力,可作为天然抗氧化剂、防腐剂等使用,具有很高的营养价值和开发利用前景。但目前对链带藻蛋白质的研究处于起步阶段,随着对其生理生化、结构功能、遗传代谢等领域的深入,对链带藻蛋白系列产品的开发是未来趋势。本研究为链带藻Desmodesmus sp. QL96代谢产物与代谢机制的研究和产品的开发利用提供基础。
参考文献
[1] Wijffels R H, Kruse O, Hellingwerf K J. Potential of indus-trial biotechnology with cyanobacteria and eukaryotic mi-croalgae[J]. Current Opinion in Biotechnology, 2013, 24(3): 405-413.
[2] Bux F. Biotechnological applications of microalgae: biodie-sel and value added products[M]. Boca Raton, United States: CRC Press. 2013: 12-40.
[3] 赵冰冰, 张发宇, 陈 裕, 等. 四步盐析提取巢湖新鲜蓝藻中藻蓝蛋白及其稳定性[J]. 环境工程学报, 2016, 10(5): 2302-2308.
[4] 谢友坪, 阳需求, 陈剑锋, 等. 室内外培养对耐温微藻Desmodesmus sp. F51细胞生长和叶黄素积累的影响[J]. 过程工程学报, 2016, 16(5): 849-855.
[5] 王亚洁, 赵阳国, 白 洁, 等. 一株海洋微藻的分离鉴定及其产油条件优化[J]. 中国海洋大学学报(自然科学版), 2014, 44(2): 95-101.
[6] 何 瑞, 徐 宁, 段舜山. 九种海洋微藻总脂含量及脂肪酸组成分析[J]. 生态科学, 2014, 33(1): 93-98.
[7] 刘 盼, 贾成霞, 杨 慕, 等. 2种微藻对养殖水体中氨氮和亚硝态氮的净化作用[J]. 水产科学, 2018, 37(3): 389-393.
[8] 韩松芳, 金文标, 涂仁杰, 等. 基于城市污水资源化的微藻筛选与污水预处理[J]. 环境科学, 2017, 38(8): 3347-3353.
[9] 李贵丽, 魏晓奕, 周 伟, 等. 2株高产蛋白微藻细胞代谢物的比较[J]. 热带作物学报, 2019, 40(4): 781-786.
[10] 王盛林, 刘平怀, 曹 猛. 微藻营养价值及微藻饵料的开发利用[J]. 食品工业, 2019, 40(7):275-279.
[11] Maria S, Amirhossein S, Simona D, et al. A systematic review and meta-analysis of the impact of the impact of Spirulina supplementation on plasma lipid concentrations[J]. Clinical Nutrition, 2015, 4(35): 842-851.
[12] Derosa G, Limas C P, Macias P C, et al. Dietary and nutra-ceutical approach to type 2 diabetes[J]. Archives of Medical Science, 2014(2): 336-344.
[13] Barkia I, Saari N, Manning S R. Microalgae for high-value products towards human health and nutrition[J]. Marine Drugs, 2019, 17(5): e304.
[14] 李华佳, 杨方美. 藻胆蛋白的的提取技术与生物活性研究[J]. 食品科学, 2005, 26(7): 243-246.
[15] Converti A, Casazza A A, Ortiz E Y, et al. Effect of temper-ature and nitrogen concentration on the growth and lipid content of Nannochloropsis oculata and Chlorella vulgaris for biodiesel production[J]. Chemical Engineering & Processing: Process Intensification, 2009, 48(6): 1146- 1151.
[16] Chen Y, Vaidyanathan S. Simultaneous assay of pigments, carbohydrates, proteins and lipids in microalgae[J]. Analytica Chimica Acta, 2013, 776(9): 31-40.
[17] 羅龙皂, 林小爱, 朱 峰, 等. 曝二氧化碳气体对近具刺链带藻在高氨氮废水中生长的影响[J]. 浙江农业学报, 2019, 31(9): 1541-1548.
[18] 牛 晴, 刘平怀, 李 昂, 等. 海洋链带藻营养成分分析[J]. 食品工业, 2018, 39(10): 313-318.
[19] 郝宗娣, 刘洋洋, 续晓光, 等. 小球藻(Chlorella)活性成分的研究进展[J].食品工业科技, 2010, 31(12): 369-372.
[20] 姜 雪, 刘 楠, 孙 永, 等. 基于主成分分析的鲜海带营养品质评价[J]. 食品工业科技, 2018, 39(19): 220-224, 231.
[21] 王小庆, 任 健. 黑豆与黄豆分离蛋白结构性质的对比分析[J]. 现代食品, 2016, 3(5): 59-61.
[22] 徐 焕, 郝力壮,刘书杰, 等. 不同地区淘汰母牦牛肉营养品质的比较分析[J]. 食品工业科技, 2020, 41(9): 232-237.
[23] 江潇潇, 朱 勇, 章 豪, 等. 品牌鸡蛋与普通鸡蛋的氨基酸含量分析比较[J]. 安徽农业科学, 2018,46(27): 176-178.
[24] 余 佳, 王 生, 许文琦, 等. 葛仙米藻胆蛋白粗提物、藻蓝蛋白和藻红蛋白的体外抗氧化活性比较研究[J]. 食品研究与开发, 2019, 40(23): 104-108.
[25] Senthilkumar N, Kunrinjimalar C, Thangamr, et al. Further studies and biological activities of macromolecular protein R-Phycoerythrin from Portieria hornemannii [J]. Interna-tional Journal of Biological Macromolecules, 2013, 62: 107-116. ?
[26] 蒋雨晴, 迟玉杰. 卵白蛋白源抗菌肽的分离纯化与结构鉴定[J]. 食品与机械, 2019, 35(7): 1-6, 86.
[27] 孙宜君. 螺旋藻抗菌肽的纯化鉴定及其抑菌机理的研究[D]. 北京: 北京林业大学, 2016.
责任编辑:崔丽虹
