细胞毒性T淋巴细胞相关抗原4(CTLA4)敲除和人源化小鼠模型的建立
2021-07-17黄艺滢张文龙石桂英雷雪裴高苒白琳
黄艺滢,张文龙,石桂英,雷雪裴,高苒,白琳
(国家卫生健康委员会人类疾病比较医学重点实验室,中国医学科学院医学实验动物研究所,北京协和医学院比较医学中心,北京市人类重大疾病实验动物模型工程技术研究中心,北京 100021)
细胞毒性T淋巴细胞相关抗原4(cytotoxic Tlymphocyte associated protein 4,CTLA4)和CD28是表达在CD4+和CD8+T细胞的同源受体,两者共享在抗原呈递细胞表面表达的一对配体,并且在T细胞活化中介导相反的功能。配体与CD28相互作用,介导T细胞与T细胞受体信号共刺激。而配体与CTLA4的相互作用可以介导T细胞功能的抑制[1]。目前,癌症免疫疗法已成为治疗癌症的有效方法,CTLA4是经过验证的免疫检查点的靶标之一[2]。由于CTLA4功能的重要性,在许多临床前和临床研究中都对anti-CTLA4抗体[3]及CTLA4阻滞剂[4-10]进行了癌症治疗的测试。人类和小鼠的CTLA4只具有75.16%的同源性,目前批准用于临床的anti-CTLA4抗体可以与人源CTLA4结合,但不会与鼠源CTLA4交叉反应[11]。因此,在利用小鼠进行药物有效性和安全性评价时,使用CTLA4人源化的小鼠是更好的选择。
采用CRISPR/Cas9的方法将人源CTLA4基因导入到小鼠的受精卵中,同时敲除小鼠内源CTLA4基因的表达。CTLA4敲除小鼠在出生后3~5周内死亡,而CTLA4人源化小鼠表型正常。通过建立基因结构和调节方式与人类相似的模型,改善由于CTLA4在人与小鼠中的种属差异导致的在临床测试与动物实验结果的差异,从而使药物评价的结果更加客观。
1 材料与方法
1.1 材料
1.1.1 实验动物
SPF级C57BL/6J(雌性,3~4周龄,7~12 g,15只;雄性,8周龄,19~25 g,30只)及ICR小鼠(雌性,8~10周龄,25~33 g,4只),购买于北京华阜康生物科技股份有限公司【SCXK(京)2020-0004】并在本所SPF级动物屏障环境动物房【SYXK(京)2019-0014】中长期饲养繁殖。饲养环境:温度20~26℃,湿度40%~70%,光照周期明暗比12 h:12 h。饲养期间小鼠自由进食饮水,垫料、鼠盒、水瓶、均经过高温高压灭菌处理。涉及动物操作程序和动物实验经本所动物使用与管理委员会(IACUC)批准,批准号为BL18003。
1.1.2 主要试剂与仪器
载体构建:试剂盒 MEGAshortscriptTMT7 Transcription Kit(Ambion,Am1354);试剂盒mMESSAGE mMACHINETMT7 ULTRA Transcription Kit(Ambion,Am1345)。基因型鉴定:EasyPure®Genomic DNA Kit(Transgen,EE101-12);鼠尾直接PCR试剂盒(Bimake,B45012)。蛋白免疫印迹:RIPA裂解液(碧云天,P0013B);一抗稀释液(碧云天,P0256);PAGE凝胶快速制备试剂盒(12.5%)(雅酶,PG113)一抗:CTLA4(Abcam,ab134090),βactin(Bioss,bs-0061R);二抗:山羊抗兔(中杉金桥,ZB-5301)。细胞培养:MEM培养基(Gibco,12571063);RPMI 1640培养基(Gibco,11875093);胎牛血清(Gibco,10099141C)青链霉素(Gibco,15140122),CD3抗体(Santa,sc-20047)。RT-PCR:TRIzol(Invitrogen,15596018);反转录试剂盒(Thermo,K1682)。流式细胞术:红细胞裂解液(BD,555899);抗体:CD4-FITC、B220-PE-Cy7、CD8-APC、CD11b-APC-Cy7、NK1.1-SB436、CD3-SB702(Invitrogen)。
多样品研磨珠均质仪(OMNI,Bead Ruptor 24 Elite),电泳仪(Bio-Rad),PCR仪(Hema),细胞培养箱(Thermo),流式细胞仪(BD FACSAria),组织脱水机、石蜡包埋机、石蜡切片机(德国Leica)。
1.2 方法
1.2.1 载体构建
(1)sgRNA表达载体构建:小鼠CTLA4基因位于第一号染色体的1C2区段(ENSMUSG00000026011)。针对该基因,设计并合成一对向导RNA(single-guide RNA,sgRNA)作用靶点(上海英潍捷基),分别为靶点1:GGGTTCAAACACATCTCAAGG(寡核苷酸序列为:m-CTLA4-gRNA UP1∶5’-TAGGGGGTTCAAACAC ATCTCA-3’和 m-CTLA4-gRNA DOWN1∶5’-AAACTGAGATGTGTTTGAACCC-3’)和 靶 点 2:GAGACTTCTGGAACATGGAGG(寡核苷酸序列为:m-CTLA4-gRNA UP2:5’-TAGGGAGACTTCTGGAACA TGG-3’和m-CTLA4-gRNA DOWN2∶5’-AAACCCATG TTCCAGAAGTCTC-3’)。对克隆进行测序,测序结果正确的用于后续实验。
将合成的CTLA4 sgRNA单链通过退火复性结合成小片段。用Bsa I酶切pUC57-sgRNA表达载体使其线性化,然后与CTLA4 sgRNA双链进行连接。构建完成的 sgRNA载体利用试剂盒MEGAshortscriptTMT7 Transcription Kit,通过体外转录为sgRNA。
(2)CAS9载体构建:pST1374-NLS-flag-linker-Cas9载体利用试剂盒mMESSAGE mMACHINETMT7 ULTRA Transcription Kit通过体外转录成为Cas9-RNA。
1.2.2 显微注射
将转录后的sgRNA与Cas9-RNA混合,并将终浓度调整为每种sgRNA 20 ng/μL与10 ng/μL。用显微注射法注射于C57小鼠受精卵中,用ICR雌鼠作为假孕受体,将注射后的受精卵移植到受体鼠输卵管壶腹部,等待小鼠出生。
1.2.3 基因型鉴定
小鼠出生后进行编号,并取尾尖进行鉴定。使用Genomic DNA Kit提取基因组DNA,根据序列信息分别设计2对人源化及1对敲除检测引物(上海英潍捷基),2对人源化检测引物分别为:M-CTLA4-UP-S:5’-CTACCACTGAGCTACATCTATACCTCTGAG-3’,M-CTLA4-UP-A:5’-GCCACGTGCATTGCTTTG-3’(产 物 1098 bp)和 M-CTLA4-DOWM-S:5’-GGAACCCAGATTTATGTAATTGATCC-3’,M-CTLA4-DOWM-A:5’-TTATTGGATAGTCAGCTGGTGTGC-3’产物(1254 bp),可以分别检测转入人源CTLA4基因的上游和下游;1对敲除引物为:M-CTLA4-KO-S:5’-AGAAATTATACTCTCCAAGACTCCACG-3’和MCTLA4-KO-A:5’-CCTTAAGTCCCAGCTGAGATCC-3’,可以检测鼠源CTLA4基因。使用鼠尾直接PCR试剂盒进行PCR,扩增程序为95℃15 min;(95℃30 s,60℃30 s,72℃2 min)×30循环;72℃10 min。加入6×蛋白上样缓冲液后,用1.5%的琼脂糖凝胶进行电泳。使用敲除引物时,小鼠子代PCR产物中若含有727 bp的片段,则小鼠含有正常鼠源CTLA4基因,若含有528 bp的片段,则小鼠含有敲除后的CTLA4基因,若含有1511 bp的片段,则小鼠含人源化的CTLA4基因。敲除小鼠子代若只含有敲除后的CTLA4基因而无正常鼠源基因,则为纯合敲除小鼠。使用2对人源化检测引物时,人源化小鼠子代PCR产物中CTLA4人源基因上下游表达,且大小正确,则小鼠含有该人源基因且插入位置正确,为杂合或纯合小鼠,若同时使用敲除引物检测未表达鼠源CTLA4基因,则为人源化纯合小鼠。
随后,选取包含突变的PCR产物进行TA克隆,并进行测序分析,确定DNA缺失片段信息。
1.2.4 CTLA4敲除及人源化小鼠出生后体重及生存率观测
从出生后开始记录CTLA4人源化小鼠纯合(CTLA4h/h)、同窝野生型(CTLA4m/m)、敲除小鼠纯合(CTLA4-/-)、同窝野生型(CTLA4+/+)的生存率及体重变化,其中CTLA4h/h、CTLA4m/m小鼠的生存率及体重从出生后1月记录至6月,CTLA4-/-、CTLA4+/+小鼠生存率记录至第6周,体重从第14天记录至第28天。
1.2.5 Western Blot检测CTLA4蛋白在脾和肺中的表达。
取后续繁育的雄性CTLA4人源化小鼠纯合(CTLA4h/h)(3月龄)及其同窝野生型(CTLA4m/m)各1只,雄性敲除小鼠纯合(CTLA4-/-)(2周龄)及其同窝野生型(CTLA4+/+)各1只。将脾及肺组织置于研磨管中加入RIPA裂解液,使用多样品研磨珠均质仪提取蛋白,使用PAGE凝胶快速制备试剂盒(12.5%)制备胶,上样量为每孔50μg。一抗CTLA4(1∶2500)和β-actin(1∶2000)使用一抗稀释液进行稀释,二抗山羊抗兔(1∶5000)。
1.2.6 RT-PCR(reverse transcription-polymerase chain reaction,逆转录PCR)检测CTLA4 mRNA在脾中的表达
取后续繁育的CTLA4人源化小鼠纯合及其同窝野生各2只,获取脾细胞后用MEM培养基加入10%胎牛血清和1%青链霉素,在37℃及5%CO2环境中培养,并用CD3抗体(0.1μg/mL)刺激培养4 d。培养后,用TRIzol分离总RNA,并使用反转录试剂盒获得cDNA。根据序列信息分别设计1对人源及1对小鼠源CTLA4 mRNA检测引物(上海英潍捷基),分别为hCTLA4-F:5’-CCCTGCACTCTCCTG TTTTTTCT-3’,hCTLA4-R:5’-TTGATTTCCACTGGA GGTGCC-3’和mCTLA4-F:5’-CCTTTTGTAGCCCTG CTCACT-3’,mCTLA4-R:5’-TTCACTCTGCTTTCAT TAAAGGTAC-3’。使用针对人CTLA4的引物扩增片段为273个碱基对,而使用针对小鼠CTLA4的引物扩增片段为278个碱基对。
1.2.7 HE染色检测淋巴细胞在组织中的分布
选用4周龄的CTLA4敲除小鼠和同窝野生型小鼠、3月龄CTLA4人源化小鼠和同窝野生型小鼠,福尔马林固定24 h以上,取心脏及肝脱水、包埋、切片,最后进行HE染色。
1.2.8 流式细胞术检测小鼠外周血中各类细胞的比例
后续繁育的CTLA4h/h小鼠(3月龄)4只和CTLA4m/m小鼠(3月龄)5只,取外周血50μL(EDTA抗凝),使用红细胞裂解液去除红细胞。每管血中加入40μL PBS+CD4(FITC)、B220(PE-Cy7)、CD8(APC)、CD11b(APC-Cy7)、NK1.1(SB436)、CD3(SB702)小鼠单克隆抗体各0.2μL。避光4℃孵育30 min,PBS洗3次,1500 r/min离心5 min,200μL PBS重悬,过滤后使用流式细胞仪分析染色细胞,FlowJo软件计算细胞表面抗原阳性表达率。
1.2.9 肿瘤细胞细胞培养
鼠源黑色素瘤细胞系B16获赠于本所肿瘤课题组。其所需培养基为RPMI 1640+10%FBS,培养条件:37℃,5%CO2。
1.2.10 肿瘤生长和分析
在CTLA4h/h(左腋下)和CTLA4m/m小鼠(右腋下)皮下注射5×105个B16黑色素瘤细胞,并在细胞注射后第3、5、7天,腹腔注射伊匹木单抗(ipilimumab)每只100μg/100μL PBS。跟踪测量肿瘤体积,计算公式为:V=ab2/2,其中a是长径,而b是短径。在第14天处死小鼠,取肿瘤组织称重。使用GraphPad Prism 5.0软件分析数据,数据表示为平均值±标准差(±s),使用t检验。在整个研究中,P<0.05差异具有显著性。
2 结果
2.1 表达载体的构建
pUC57-sgRNA表达载体经Bsa I酶切线性化,合成的CTLA4 sgRNA双链的粘性末端与表达载体Bsa I酶切后的粘性末端相匹配,两者连接,成功构建CTLA4 sgRNA表达载体,经测序验证序列正确。
2.2 CTLA4敲除及人源化小鼠的构建
按照实验方案(图1),将转录后的sgRNA和Cas9 mRNA混合后通过显微注射技术注射到C57小鼠受精卵中,移植到ICR假孕鼠子宫内,共出生23只幼仔,剪取7~10日龄小鼠的鼠尾组织,提取DNA并进行PCR(图2a,c,d)。根据PCR结果,选取分子量不同于野生型条带的PCR产物测序并与野生型小鼠CTLA4基因序列比较。结果显示,3#,5#,9#,14#,23#小鼠发生基因敲入,4#,6#,7#,10#,15#小鼠发生基因敲除。将F0代敲除小鼠7#(雄)与C57小鼠进行杂交,获得杂合子CTLA4+/-,将F0代人源化小鼠14#(雄)与C57小鼠进行杂交,获得杂合子CTLA4h/m,将杂合子互交并将子代进行基因型鉴定,得到纯合敲除小鼠CTLA4-/-(图2b)或纯合人源化小鼠CTLA4h/h(图2e~g),突变可稳定传代。

图1 CTLA4人源化及敲除小鼠建立方案Note.With the participation of sgRNA and Cas9 mRNA,the first exon of mouse CTLA4 was cut.a.The 921 bp reading frame composed of the CDSregion of human CTLA4 and BGH Poly A was used to replace the coding region of the first exon of mouse CTLA4 to establish a humanized CTLA4 mouse.b.The reading frame did not replace the coding region of the first exon of mouse CTLA4 and a CTLA4 knockout mouse was established.Figure 1 Establishment of CTLA4 humanization and knockout mice
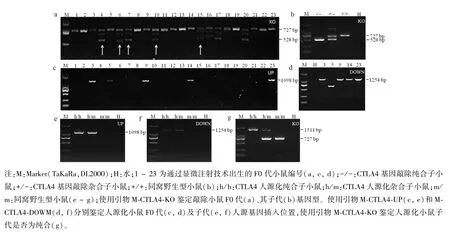
图2 PCR鉴定F0代及子代小鼠基因型Note.M.Marker(TaKaRa,DL2000).H.H2O.1~23.F0 generation mice were generated by microinjection(a,c,d).-/-.CTLA4 homozygous mice.+/-.CTLA4 heterogeneous mice.+/+.Wild-type littermate mice(b).h/h.Humanized CTLA4 homozygous mouse.h/m.Humanized CTLA4 heterogeneous mouse.m/m.Wild-type littermate mice(e~g).The primer M-CTLA4-KO was used to identify the genotypes of knockout mice F0 generation(a)and its offspring(b).The primers M-CTLA4-UP(c,e)and M-CTLA4-DOWM(d,f)were used to identify the insertion position of the human gene in the F0 generation(c,d)and the offspring(e,f)of the CTLA4 humanized mice.The primer M-CTLA4-KO was used to identify the homozygous mouse(g).Figure 2 Identify the genotype of the F0 generation and offspring mice by PCR
2.3 CTLA4敲除及人源化小鼠生存率及体重变化
早有研究表明,CTLA4基因敲除小鼠会在出生后1月内,由于严重的自身免疫疾病死亡[12]。统计了小鼠出生后的生存率及体重变化,CTLA4-/-小鼠在出生后3~5周内死亡(图3a),而CTLA4h/h小鼠在6月内生长正常,未发生死亡(图3b)。CTLA4-/-小鼠在出生后2周时体重与同窝野生型小鼠CTLA4+/+相似,但在3~4周时体重明显低于CTLA4+/+小鼠(图3c),体型也更小(图3e),而CTLA4h/h小鼠在出生后6个月内体重与同窝CTLA4m/m小鼠基本一致(图3d),未见明显异常。

图3 CTLA4基因敲除小鼠生存率及体重变化Note.a.Survival rate of CTLA4-/-and CTLA4+/+mice within 6 weeks of birth.CTLA4-/-mice died within 3~5 weeks after birth(n≥9).B.Survival rate of CTLA4h/h and CTLA4m/m mice within 6 months of birth(n≥7).c.Weight of CTLA4-/-and CTLA4+/+mice within 28 d of birth.CTLA4-/-mice gain weight slowly after 14 d of birth(n≥8).d.Weight of CTLA4h/h and CTLA4m/m mice within 6 months of birth(n≥7).e.Comparison of CTLA4-/-and CTLA4+/+mice of 4 weeks old.Figure 3 Changes of survival rate and weight of CTLA4 knockout mice
2.4 CTLA4敲除及人源化小鼠组织中蛋白及mRNA表达
为了鉴定CTLA4敲除及人源化小鼠是否在蛋白水平发生CTLA4敲除或人源化转入,取1~2月龄小鼠脾、肺进行Western Blot,分别使用种属反应性为小鼠和人的CTLA4抗体检测蛋白表达(图4a)。结果显示,在CTLA4-/-小鼠的脾和肺中,CTLA4表达被敲除。
由于市售的种属反应性为人的CTLA4抗体无法区分人源与鼠源的蛋白,为了区分人源与小鼠源CTLA4表达,使用RT-PCR鉴定CTLA4h/h小鼠脾细胞(CD3抗体刺激4 d)中mRNA表达(图4b)。结果可见人特异性引物只能扩增CTLA4h/h的cDNA,而小鼠特异性引物也只能扩增CTLA4m/m的cDNA,可见CTLA4h/h小鼠中只表达人源CTLA4的mRNA。
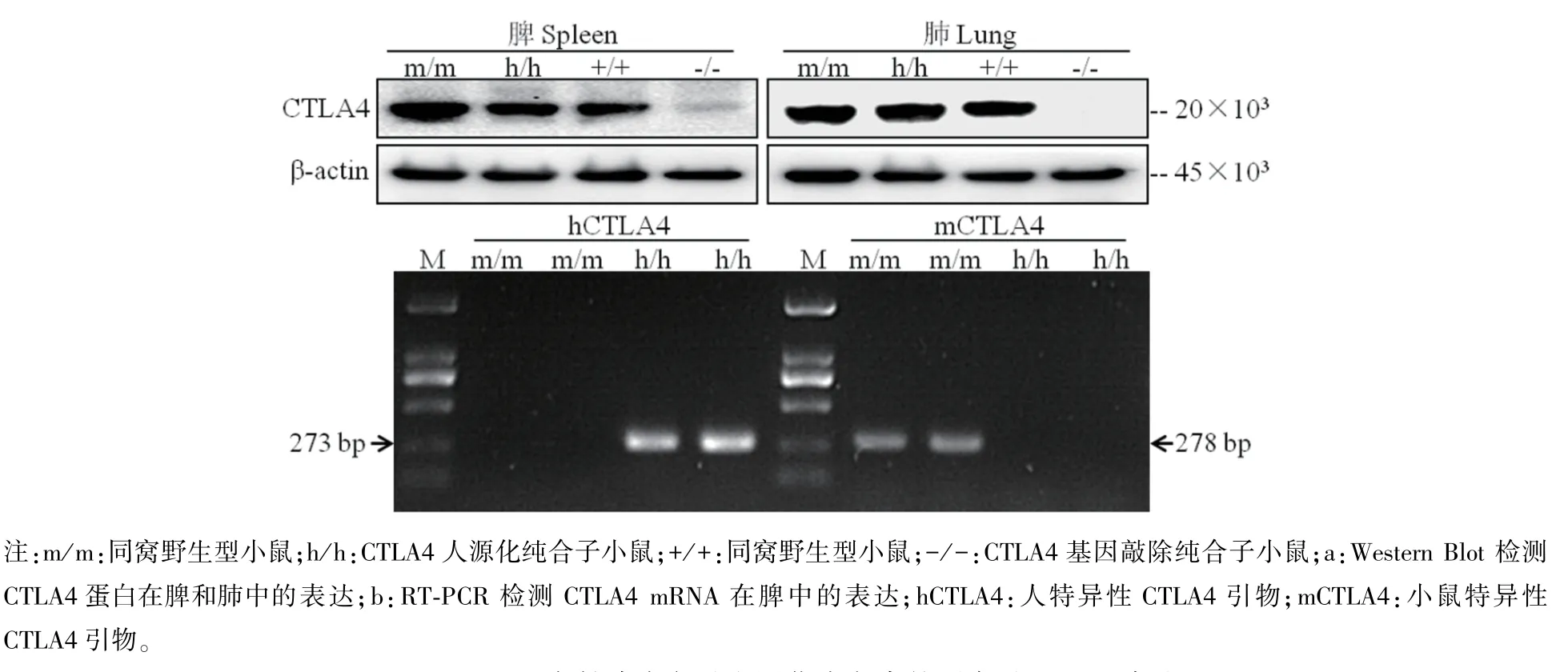
图4 CTLA4在敲除小鼠及人源化小鼠中的蛋白及mRNA表达Note.m/m.Wild type littermate mouse.h/h.Humanized CTLA4 homozygous mouse.+/+.Wild type littermate mouse.-/-.CTLA4 knockout homozygous mouse.a.CTLA4 protein expression of spleen and lung in mice detected by Western Blot.b.CTLA4 mRNA expression of spleen in mice detected by RT-PCR.hCTLA4.Human specific CTLA4 primer.mCTLA4.Mouse specific CTLA4 primer.Figure 4 Expression of protein and mRNA in CTLA4 knockout and humanized mice
2.5 人源CTLA4基因可正常替代小鼠CTLA4基因
文献报道,CTLA4-/-小鼠会由于严重的自身免疫疾病,在出生后3~4周内死亡[12],这与观察到的结果相似。HE染色结果显示,相比于CTLA4+/+小鼠(图5a,e),CTLA4-/-小鼠表现出淋巴样细胞向非淋巴组织(如心脏、肝)的浸润(图5b,f)。文献报道,CTLA4敲除可导致动物患有严重胰腺炎和致命的心肌炎[12-13]。但在CTLA4m/m小鼠(图5c,g)及CTLA4h/h小鼠(图5d,h)中,没有观察到淋巴细胞的浸润,且全身病理检查未发现异常。结果表明,CTLA4h/h小鼠寿命正常,在6个月内没有观察到自身免疫性疾病发展的迹象。利用流式细胞术检测了CTLA4m/m和CTLA4h/h小鼠外周血中各类细胞的比例,发现其外周血中B细胞(B220+)、T细胞(CD3+、CD4+、CD8+)、粒细胞(CD11b+)和NK细胞(NK1.1+)的比例都没有明显差异(图6)。结果说明人源化CTLA4基因后没有改变正常生理状态下小鼠免疫系统的组成。因此,在CTLA4h/h小鼠中,人源CTLA4等位基因已功能性替代了小鼠CTLA4基因。

图5 组织中淋巴细胞浸润Note.In CTLA4-/-mice,lymphocytes infiltrated extensively into non-lymphoid tissues(b,f),while in CTLA4+/+(a,e),CTLA4m/m(c,g)and CTLA4h/h(d,h)mice there was no significant infiltration.Figure 5 Lymphocyte infiltration in tissues
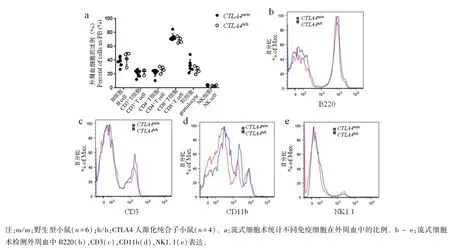
图6 在CTLA4h/h小鼠外周血中不同免疫细胞的比例Note.m/m.Wild type mouse(n=6).h/h.Humanized CTLA4 homozygous mouse(n=4).a.Proportion of different immune cells in peripheral blood by flow cytometry.b~e.The expression of B220(b),CD3(c),CD11b(d),NK1.1(e)in peripheral blood by flow cytometry.Figure 6 Proportion of different immune cells in peripheral blood of CTLA4h/h mice
2.6 在CTLA4人源化小鼠中,CTLA4单克隆抗体伊匹木减缓肿瘤生长速度
目前批准用于临床的抗CTLA4抗体可以与人源CTLA4结合,但不会与鼠源CTLA4交叉反应[11]。为了检测建立的CTLA4h/h小鼠是否可以用于临床药物筛选,对比了CTLA4单克隆抗体伊匹木[3]在CTLA4h/h和CTLA4m/m小鼠中抑制肿瘤生长的能力。用黑色素瘤细胞系B16分别移植入CTLA4h/h和CTLA4m/m小鼠皮下,在移植后第3、5、7天,伊匹木单抗以每只100μg的剂量进行3次腹腔注射,观察肿瘤生长至14 d。在CTLA4h/h小鼠中,伊匹木单抗减缓肿瘤生长速度(图7a,b),在第14天时,CTLA4h/h小鼠中肿瘤质量低于CTLA4m/m小鼠(图7c,d)。结果显示,伊匹木单抗可以在建立的CTLA4h/h小鼠中发挥有效作用。

图7 在CTLA4h/h小鼠中,伊匹木抑制B16黑色素实体瘤恶性增殖Note.5×105 B16 melanoma cells were injected(s.c.)into CTLA4h/h(n=8)and CTLA4m/m(n=6)mice,and mice were treated(i.p.)with 100 μg ipilimumab per mouse on days 3,5 and 7,as indicated by arrows.Measure the tumor diameter to 14 d after cell injected(a,b).Weigh the tumor on the 14th day after cell injected(c,d).Compared with CTLA4m/m group,*P<0.05,**P<0.01.Figure 7 In CTLA4h/h mice,ipilimumab induced the malignant proliferation of B16 melanoma
3 讨论
如今,小鼠常被用于新药物研发和疾病机制研究。但由于物种差异,小鼠在药物的代谢和毒理学特征方面不一定与人类相同,导致药物在临床测试的效果和安全性与动物实验结果所预测不同的现象时有发生。为了减少物种差异,提高临床前实验的可靠性,通常使用人源化小鼠进行实验,人源化小鼠是指携带人类基因、细胞或组织的嵌合体小鼠。在本实验中,使用CRISPR/Cas9这一常用方法[14]建立CTLA4基因敲除及人源化小鼠。
抗体疗法是备受关注的免疫疗法之一,治疗性抗体大致分为两类,第一类是抗体与癌细胞直接结合,通过免疫依赖性和/或非依赖性机制诱导癌细胞死亡[15-18]。第二类是通过与免疫系统的细胞(如T细胞)结合并激活而引起肿瘤排斥反应[19-20]。初始T细胞活化需要两个信号,即T细胞受体和T细胞共刺激途径[21]。CTLA4最初被发现为一种传递抑制信号,对于终止免疫反应非常重要[12-13]。T细胞活化受到CTLA4的负面调节,例如与CD28竞争与它们共同配体B7.1和B7.2的结合[22]。尽管CTLA4调节免疫系统的确切机制仍存在争议,但CTLA4的抑制功能受到广泛认可[23]。所有CTLA4敲除小鼠在淋巴结和脾均显示大量淋巴细胞增殖,随后白细胞对几乎所有组织进行自身免疫攻击,并导致小鼠过早死亡[12-13,24]。在纯合CTLA4人源化小鼠中,一段时间内(超过6个月)没有观察到致命的自身免疫疾病,这证明在人源化小鼠中,人和小鼠的CTLA4具有相同的生物学功能。
在研究治疗性抗体的效果时,可以使用免疫系统人源化小鼠进行研究。如使用免疫缺陷小鼠进行人外周血重构,从而在小鼠中建立功能正常的人免疫系统[25]。虽然这种模型可以用于筛选抗体的潜在抗癌作用,但在评估其它临床参数,如自身免疫性方面受到一定限制。此外免疫系统人源化小鼠容易产生移植物抗宿主病,或需要人细胞因子刺激使移植后的细胞存活增殖[26]。相比之下,CTLA4基因人源化小鼠的免疫应答是在自然环境中产生的。并且,CTLA4基因人源化小鼠模型可以用于评估与潜在人类治疗性抗体相关的自身免疫副作用的能力[3]。
因此,本研究建立的CTLA4人源化小鼠模型改善了CTLA4在人与小鼠中种属差异导致的实验结果差异,从而使药物评价的结果更加客观,为治疗性抗体的验证提供了更有价值的实验动物模型。
