抑郁症失眠大鼠模型的构建与评价
2021-07-17黄会珍赵洪庆王宇红张尚霞金狮罗薇絮李姿蓉
黄会珍,赵洪庆,王宇红*,张尚霞,金狮,罗薇絮,李姿蓉
(1.湖南中医药大学科技创新中心,长沙 410208;2.山东省药学科学院,济南 250013)
近年来,抑郁症的发病率逐年递增。据世界卫生组织的最新数据统计,全球共有约3.5亿抑郁症患者,我国抑郁症患病率达4.2%,每年因抑郁症而自杀的人数高达100万人[1],预计到2030年抑郁症将在全球疾病总负担中排名首位[2]。睡眠障碍是抑郁症患者中最常见的躯体症状,据调查90%抑郁症患者存在睡眠障碍,而其中88%抑郁症睡眠障碍患者主要表现为失眠[3]。目前关于抑郁症失眠的研究大多集中于临床[4-5],主要是因为缺乏一种稳定性高、可实施性强又能最大限度模拟抑郁症失眠患者临床发病特征的动物模型及一套相关的评价体系。目前可以肯定的是生物、心理与社会环境等诸多因素参与了抑郁症失眠的发病过程,且这些因素并不是单独起作用的,而是各因素联合作用导致疾病的发生[6]。所以复合模型比单纯的躯体应激或药物刺激更能模拟该病的临床表征。因此,本实验旨在构建一种最佳的慢性应激联合睡眠剥夺的方法,为抑郁症失眠的实验研究提供一种相对可靠的动物模型。
1 材料与方法
1.1 材料
1.1.1 实验动物
84只6~7周龄SPF级SD雄性大鼠,体重180~200 g,购自湖南斯莱克景达实验动物操作有限公司【SCXK(湘)2016-0002】。实验单位为湖南中医药大学第一附属医院实验动物中心SPF级动物房【SYXK(湘)2020-0010】。研究内容和过程涉及的实验动物操作均符合国家对医学实验动物的有关要求(伦理批准编号:HN-LL-KY-2019-012-01)。实验条件为:室温(25±2)℃、房间相对湿度(50%±5%)、保持12 h/12 h光暗周期,动物可自由摄取食物与水。
1.1.2 主要试剂与仪器
戊巴比妥钠(69020183,国药集团)、CORT、ACTH、CRH、Glu、GABA酶联免疫试剂盒均购自上海晶天生物科技有限公司、NE(B24713)、DA(B25300)、5-HT(B21833)对照品均购自上海源叶生物科技有限公司、生理、药理电子刺激仪(YLS-9A型,济南益延科技)、高效液相色谱仪(1260型,Aglient)、ECD电化学检测器(Antec)、生物组织包埋机(BM-Ⅷ型,湖北孝感宏业)、石蜡切片机(HM325型,Thermo Scientific)、酶标仪(MK3型,Thermo Scientific)。
1.2 方法
1.2.1 动物分组、造模
适应性饲养5 d后将所有大鼠按体重随机分为7组,慢性不可预见性中度应激组(chronic unpredictable middle stress,CUMS)、72 h睡眠剥夺组(72 h sleep deprivation,72 h SD)、慢性不可预见性中度应激+72 h睡眠剥夺组(CUMS+72 h SD)、21 d睡眠剥夺组(21 d SD)、慢性不可预见性中度应激+21 d睡眠剥夺组(CUMS+21 d SD),另设空白组、环境对照组,每组12只。造模前14 d为CUMS造模,CUMS具体方法为:动物实行孤笼饲养,应激方法包括禁食24 h、4℃冰水4 min、倾笼45℃+噪音4 h、潮湿垫料+昼夜颠倒24 h、电压70 V,电流强度2 mA,间断持续1 min的足底电击、禁水24 h、夹尾1 min。每天1种刺激,7种刺激不重复出现[7-8]。15~35 d为SD造模,采用改良多平台水环境法对大鼠进行快速眼动睡眠剥夺,睡眠剥夺箱为本课题组自制玻璃箱体,箱内置若干个连体不锈钢平台,其直径为6.5 cm,高为10 cm,注水至平台下方1 cm。平台上的大鼠进入快波睡眠时全身肌张力下降,身体接触到水面而不能完全入睡,达到睡眠剥夺的目的。环境对照组箱内放置一铁丝网,大鼠可在上面自由活动。所有大鼠均可自行饮水和摄食。21 d SD组每天15:00至隔天9:00进行18 h SD[9],连续21 d;72 h SD组于造模最后3 d进行连续72 h SD[10];复合模型组在进行失眠造模期间均不间断抑郁造模。分别于应激造模14 d后和复合造模结束后对各组部分大鼠进行行为学检测,取各大鼠血液、脑区进行多方面指标检测。
1.2.2 动物行为学检测
(1)体重变化情况:体重变化率(%)=(第7、14、21、28、35天的体重-第1天的体重)/第1天的体重。
(2)摄食量变化情况:每周对各组大鼠进行1次摄食统计。
(3)旷场实验:将大鼠从敞箱底面中央一格放入,适应30 s,记录4 min内大鼠水平活动次数、垂直站立次数和粪便粒数。
(4)强迫游泳实验:将大鼠放入水缸中计时30 s使其适应,记录4 min内大鼠的不动时间。大鼠仅留鼻孔露出水面呼吸呈自然漂浮状态即记为游泳不动时间。
(5)糖水消耗实验:禁食禁水24 h,每只大鼠放置1瓶1%的蔗糖水和1瓶蒸馏水,1 h后调换水瓶位置,计算2 h内蔗糖水消耗量,糖水消耗率(%)=蔗糖水总消耗量/(蔗糖水总消耗量+蒸馏水总消耗量)×100%。
(6)戊巴比妥钠翻正实验:经过预实验得出大鼠戊巴比妥钠阈上剂量为35 mg/kg。禁食不禁水12 h,腹腔注射,记录以下数据:①注射戊巴比妥钠的时间。②入睡时间:大鼠背向下姿势保持30 s以上,并且1 min内不出现翻正反射。③觉醒时间:大鼠自动翻转至背向上姿势且保持30 s以上,认为其翻正反射恢复。计算入睡潜伏期和睡眠时长。
1.2.3 ELISA法检测各组大鼠血清中HPA轴指标和下丘脑中Glu、GABA含量
收集血液于不含添加剂的采血管中,3500 r/min,10 min离心取上清液即为血清样本。大鼠下丘脑按质量体积比1:20比例加入磷酸缓冲盐溶液,冰上匀浆。4℃、12 000 r/min离心10 min后取上清液。根据试剂盒中的说明书进行操作,以标准品浓度与其对应的校正OD值作出线性回归方程,将样品的OD值代入回归方程中计算出每个样品浓度。
1.2.4 HPLC-ECD检测大鼠下丘脑中单胺递质含量
取冷冻保存的下丘脑,精密称重,按质量体积比为1∶3加入0.01 mol/L高氯酸溶液,冰上匀浆,4℃、13 000 r/min离心10 min后取上清液,0.22 μm针头过滤器过滤,进样。色谱条件为:色谱柱:Quattro 4 C18柱;流动相:磷酸二氢钠/柠檬酸混合液-甲醇(90∶10);流速:0.3 mL/min;柱温:35℃;进样量:20μL。精密称取适量对照品溶于0.01 mol/L高氯酸溶液中,配成1 mg/mL储备液,依次稀释成7个浓度点,根据各峰面积计算标准曲线(见表1)。
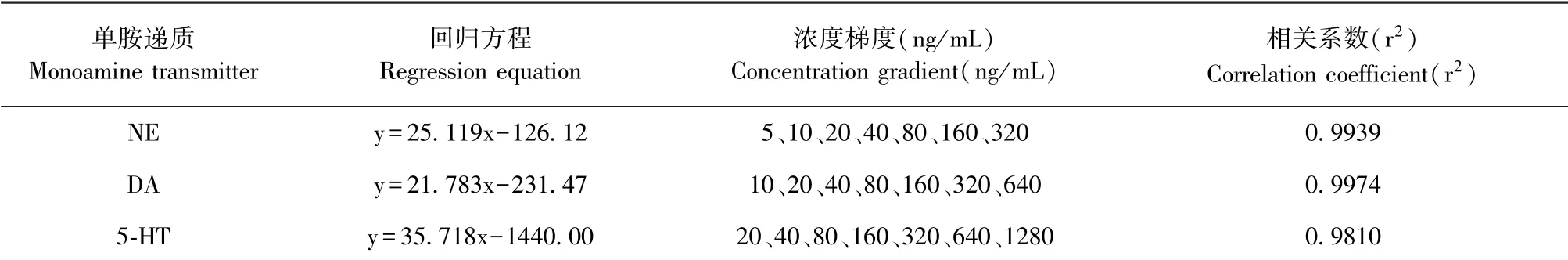
表1 单胺递质对照品的回归方程和浓度梯度Table 1 Regression equation and concentration gradient of monoamine transmitter control
1.2.5 HE染色观察下丘脑-海马组织病理状态
取4%多聚甲醛固定好的下丘脑组织,进行常规石蜡包埋,4μm切片后进行以下步骤。脱蜡、水化、染色、脱水、封片,玻片晾干后,即可观察下丘脑神经元细胞的形态学变化,显微镜下观察并拍照。
1.3 统计学分析
采用SPSS 21.0统计学软件分析,数据以平均值±标准差(±s)表示,多组间比较采用One-Way ANOVA分析,满足方差齐性采用LSD检验;方差不齐时选择Dunnett’s T3检验,P<0.05为差异具有统计学意义。每周1次的体重增长率和摄食量统计为重复测量数据,需用重复测量资料方差分析进行Mauchly球形检验,P>0.05即符合球形对称Huynh-Feldt条件,采用One-Way ANOVA分析;若P<0.05,说明不符合Huynh-Feldt条件,需对组内效应进行校正,选用多元方差分析。
2 结果
2.1 大鼠体重增长率变化
与空白组比较,各模型组中尤以CUMS+21 d SD组大鼠体重增长率下降明显;后期与CUMS+72 h组相比,CUMS+21 d SD组大鼠的体重增长率是显著下降的(P<0.01)(见图1)。

图1 各组大鼠体重增长率比较(±s,n=10)Note.Compared with control group,*P<0.05,**P<0.01.Compared with CUMS group,▲P<0.05,▲▲P<0.01.Compared with CUMS+72 h SD group,#P<0.05,##P<0.01.(The same in the following figures and tables)Figure 1 Comparison of body weight growth rate of rats in each group(±s,n=10)
2.2 大鼠摄食量变化
与空白组相比,各模型组大鼠摄食量均呈逐渐减少的趋势(P<0.05或P<0.01);与CUMS+72 h组相比,造模结束后CUMS+21 d SD组大鼠的摄食量是显著减少的(P<0.01)(见表2)。
表2 造模期间大鼠平均每天摄食情况(±s,n=10)Table 2 Average daily intake of rats(±s,n=10)

表2 造模期间大鼠平均每天摄食情况(±s,n=10)Table 2 Average daily intake of rats(±s,n=10)
组别Groups 7 d 14 d 21 d 28 d 35 d空白组Control group 23.04±0.86 25.65±1.46 29.74±1.83 30.69±0.53 30.29±0.69环境对照组Environental control group 22.99±0.57 24.49±0.81 28.99±0.77 29.98±2.81 29.64±1.17 CUMS组CUMSgroup 21.33±1.45* 21.20±0.27** 21.66±1.98** 20.33±1.29** 19.07±0.32**72 h SD组72 h SD group 22.75±0.70 25.10±0.99 29.48±1.13 29.78±0.42 24.44±1.24**CUMS+72 h SD组CUMS+72 h SD group 21.50±0.20* 22.15±1.20** 21.56±2.50** 21.42±0.39** 17.71±0.75**21 d SD组21 d SD group 22.89±0.45 25.73±0.57 18.93±0.40** 18.19±0.14** 17.99±0.27**CUMS+21 d SD组CUMS+21 d SD group 21.80±0.51 22.11±0.91** 17.88±0.44**▲▲## 17.65±0.18**▲## 15.98±0.51**▲▲#F 2.872 11.805 36.125 71.487 169.083 P 0.049 0.000 0.000 0.000 0.000
2.3 CUMS造模14 d和复合造模结束各行为学结果
2.3.1 旷场实验
与空白组相比,CUMS造模两周后,经过应激的各组大鼠均表现出了自主活动降低的趋势,粪便粒数增多。与CUMS+72 h SD组比,CUMS+21 d SD组大鼠的水平活动次数下降,站立次数明显减少(P<0.05),粪便粒数显著增加(P<0.05)(见图2)。

图2 各组大鼠结束旷场实验结果(±s,n=8)Figure 2 Open field test results of rats in each group(±s,n=8)
2.3.2 强迫游泳实验
与空白组比,经过CUMS造模的模型组大鼠不动时间明显增加(P<0.05),复合造模结束后,CUMS+21 d SD组大鼠不动时间明显较长(见表3)。
表3 各组大鼠强迫实验结果(±s,n=8)Table 3 Force swimming test results of rats in each group(±s,n=8)

表3 各组大鼠强迫实验结果(±s,n=8)Table 3 Force swimming test results of rats in each group(±s,n=8)
组别Groups 14 d不动时间14 d immobility time造模结束不动时间Immobility time at the end of modeling空白组Control group 1.67±1.64 6.68±3.52环境对照组Environental control group 1.60±0.80 6.45±2.04 CUMS组CUMSgroup 3.63±3.38* 14.17±6.81*72 h SD组72 h SD group 1.55±1.26 8.01±4.01 CUMS+72 h SD组CUMS+72 h SD group 3.54±2.28* 12.14±6.70*21 d SD组21 d SD group 2.90±2.65 13.54±6.28*CUMS+21 d SD组CUMS+21 d SD group 3.66±2.62* 18.31±12.50**F 1.613 3.469 P 0.164 0.006
2.3.3 糖水消耗实验
与空白组相比,经过14 d CUMS,各造模组的平均糖水消耗率显著下降(P<0.01);复合造模结束后,与CUMS+72 h SD组相比,CUMS+21 d SD组大鼠的糖水消耗率明显下降(P<0.05)。与上述两个行为学结果一致(见表4)。
表4 各组大鼠糖水消耗实验结果(±s,n=12)Table 4 Sugar water consumption test results of rats in each group(±s,n=12)
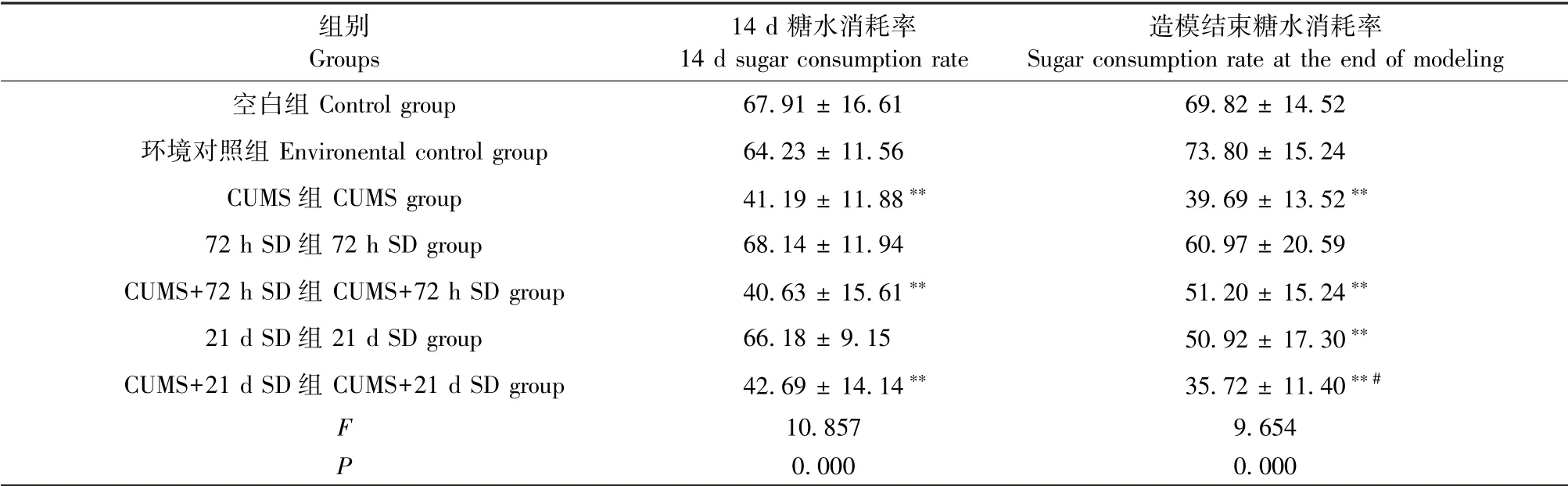
表4 各组大鼠糖水消耗实验结果(±s,n=12)Table 4 Sugar water consumption test results of rats in each group(±s,n=12)
组别Groups 14 d糖水消耗率14 d sugar consumption rate造模结束糖水消耗率Sugar consumption rate at the end of modeling空白组Control group 67.91±16.61 69.82±14.52环境对照组Environental control group 64.23±11.56 73.80±15.24 CUMS组CUMSgroup 41.19±11.88** 39.69±13.52**72 h SD组72 h SD group 68.14±11.94 60.97±20.59 CUMS+72 h SD组CUMS+72 h SD group 40.63±15.61** 51.20±15.24**21 d SD组21 d SD group 66.18±9.15 50.92±17.30**CUMS+21 d SD组CUMS+21 d SD group 42.69±14.14** 35.72±11.40**#F 10.857 9.654 P 0.000 0.000
2.3.4 戊巴比妥钠翻正实验
与空白组相比,各模型组大鼠睡眠潜伏期显著增长(P<0.05或P<0.01),睡眠时长明显缩短(P<0.01);与CUMS+72 h SD组相比,CUMS+21 d SD组大鼠表现虽无统计学差异,但睡眠潜伏期有所增加,睡眠时长有所减少(见表5)。
表5 造模结束翻正实验结果(±s,n=10)Table 5 Experimental results of righting at the end of modeling(±s,n=10)

表5 造模结束翻正实验结果(±s,n=10)Table 5 Experimental results of righting at the end of modeling(±s,n=10)
组别Groups 睡眠潜伏期Sleep latency 睡眠时长Sleep duration空白组Control group 6.30±1.42 111.50±47.09环境对照组Environental control group 6.44±1.67 95.56±18.40 CUMS组CUMSgroup 8.50±4.06 64.42±16.00**72 h SD组72 h SD group 11.10±10.42 89.30±29.97 CUMS+72 h SD组CUMS+72 h SD group 13.92±8.74* 61.08±24.90**21 d SD组21 d SD group 15.40±9.05** 58.60±26.29**CUMS+21 d SD组CUMS+21 d SD group 16.42±8.38**▲▲ 51.58±26.50**F 3.580 6.692 P 0.004 0.000
2.4 ELISA测定血清中HPA轴各指标和下丘脑中Glu、GABA含量
2.4.1 血清中HPA轴各指标含量
与空白组相比,CUMS+21 d SD组大鼠血清中各指标含量升高最明显(P<0.01);与CUMS+72 h SD组相比,CUMS+21 d SD组三个指标含量均显著增加(P<0.05或P<0.01)(见表6)。
表6 各组大鼠血清CRH、ACTH、CORT含量变化(±s,n=6)Table 6 Changes of CRH,ACTH and CORT in serum of rats in each group(±s,n=6)

表6 各组大鼠血清CRH、ACTH、CORT含量变化(±s,n=6)Table 6 Changes of CRH,ACTH and CORT in serum of rats in each group(±s,n=6)
组别Groups CRH(ng/mL) ACTH(ng/L) CORT(ng/mL)空白组Control group 3.27±0.18 26.66±3.59 6.37±0.32环境对照组Environental control group 3.28±0.17 28.46±3.78 5.52±0.26 CUMS组CUMSgroup 3.56±0.14* 35.28±5.76* 7.54±0.35*72 h SD组72 h SD group 2.87±0.12* 32.66±2.83 6.58±0.75 CUMS+72 h SD组CUMS+72 h SD group 3.63±0.20* 35.27±4.30* 7.58±1.33*21 d SD组21 d SD group 3.63±0.34* 33.79±2.04 7.73±0.36*CUMS+21 d SD组CUMS+21 d SD group 4.56±0.14**▲▲## 48.60±2.90**▲▲## 9.04±0.13**▲#F 21.161 11.688 9.918 P 0.000 0.000 0.000
2.4.2 下丘脑中Glu、GABA含量
与空白组相比,各模型组大鼠下丘脑Glu含量上升,GABA含量下降(P<0.05或P<0.01),与CUMS+72 h SD组比较,CUMS+21 d SD组Glu和GABA含量均有明显变化(见表7)。
表7 各组大鼠下丘脑Glu、GABA含量变化(±s,n=3)Table 7 Changes of Glu and GABA contents in hypothalamus of rats in each group(±s,n=3)
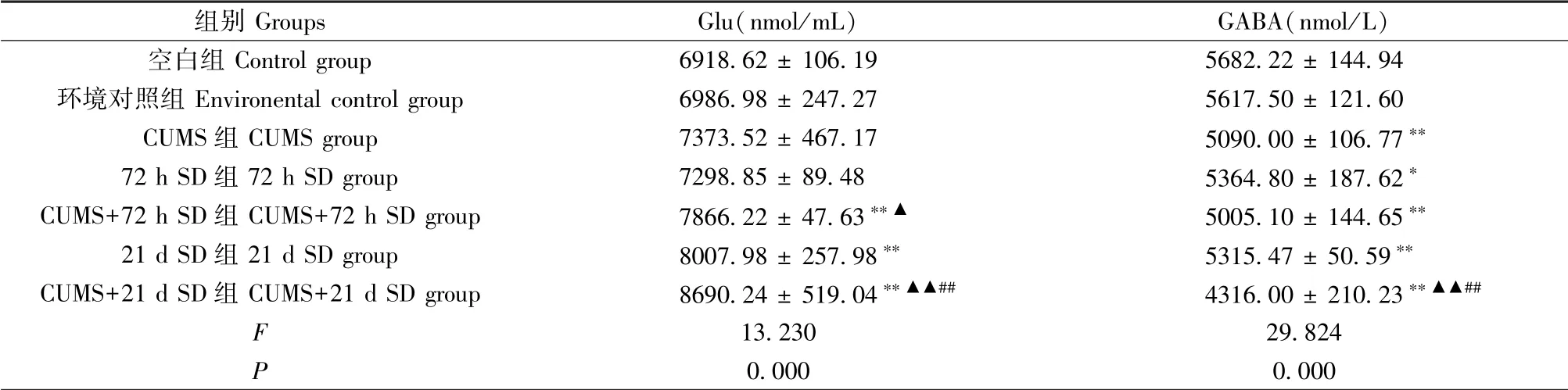
表7 各组大鼠下丘脑Glu、GABA含量变化(±s,n=3)Table 7 Changes of Glu and GABA contents in hypothalamus of rats in each group(±s,n=3)
组别Groups Glu(nmol/mL) GABA(nmol/L)空白组Control group 6918.62±106.19 5682.22±144.94环境对照组Environental control group 6986.98±247.27 5617.50±121.60 CUMS组CUMSgroup 7373.52±467.17 5090.00±106.77**72 h SD组72 h SD group 7298.85±89.48 5364.80±187.62*CUMS+72 h SD组CUMS+72 h SD group 7866.22±47.63**▲ 5005.10±144.65**21 d SD组21 d SD group 8007.98±257.98** 5315.47±50.59**CUMS+21 d SD组CUMS+21 d SD group 8690.24±519.04**▲▲## 4316.00±210.23**▲▲##F 13.230 29.824 P 0.000 0.000
2.5 HPLC-ECD法测定大鼠下丘脑单胺类神经递质含量
与空白对照组比,各模型组大鼠下丘脑中三种单胺递质含量均明显下降(P<0.05或P<0.01);与CUMS+72 h SD组比,CUMS+21 d SD组三种单胺递质含量明显减少(P<0.01)(见图3)。
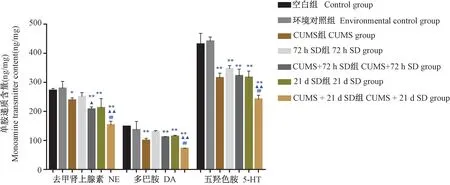
图3 各组大鼠下丘脑单胺递质含量变化(±s,n=3)Figure 3 Changes of monoamine transmitters in hypothalamus of rats in each group(±s,n=3)
2.6 HE染色观察下丘脑组织病理状态
空白对照组大鼠下丘脑细胞大小均匀,排列有序,细胞无空泡样现象;CUMS+72 h SD和CUMS+21 d SD两个复合模型组下丘脑神经元细胞形态结构损伤严重,后者更为明显,细胞排列紊乱、间隙变大,空泡样性状显著(见图4)。
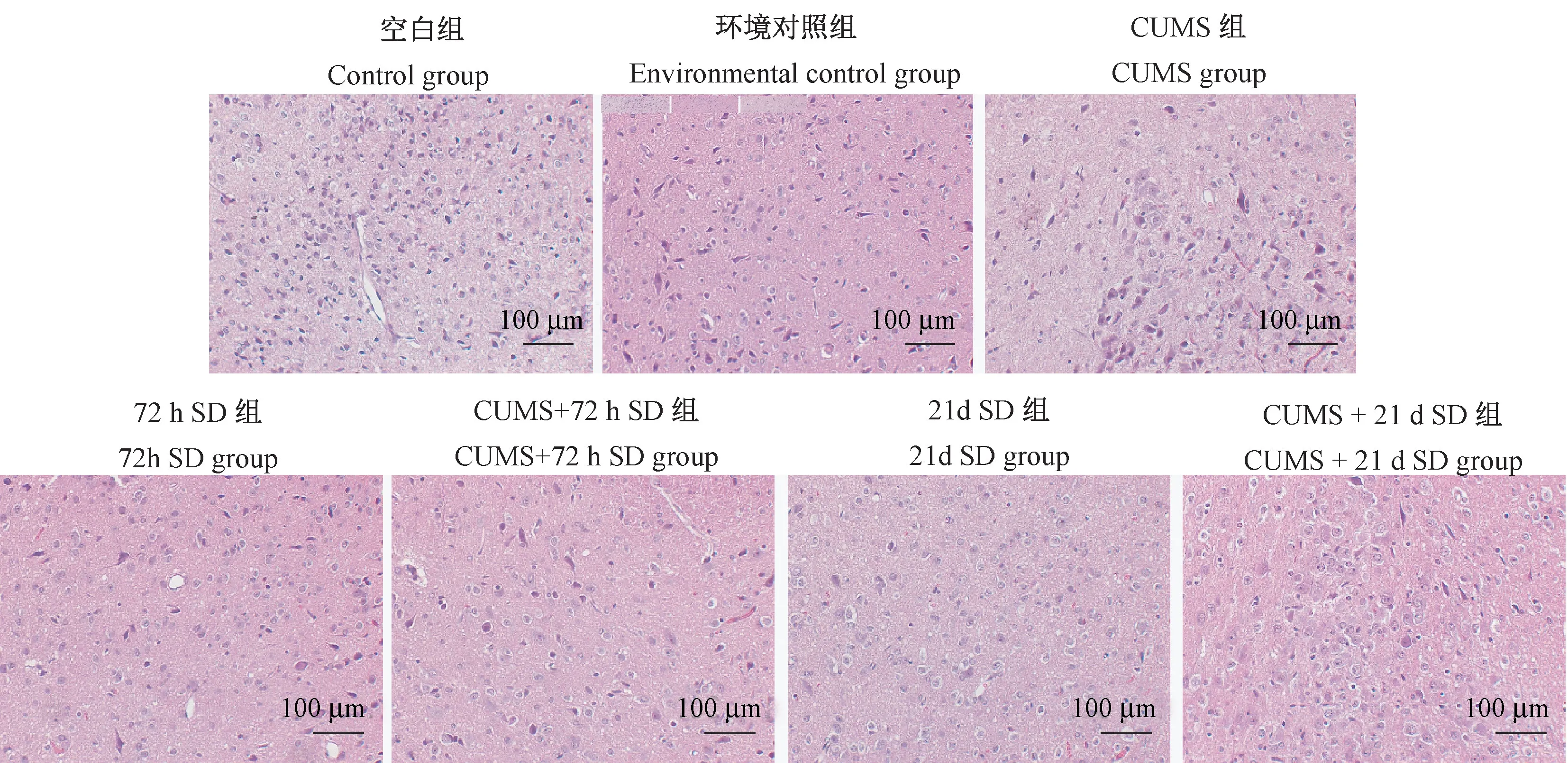
图4 各组大鼠下丘脑HE染色结果Figure 4 HE staining results of hypothalamus in each group
3 讨论
目前,关于抑郁症失眠大鼠模型的建立大致分为两种方法:一种是仅对动物进行抑郁症造模处理,认为抑郁症能够自发产生失眠,失眠是抑郁症发病的一种症状。通常在抑郁症造模期间进行脑电图监测睡眠情况,没有进行复合造模[11-12]。另一种是复合因子造模方法,通常采用慢性应激先建立抑郁症模型,后采用72 h睡眠剥夺建立失眠模型,认为抑郁症状态下不可能有100%的概率自发产生失眠,单一的造模方法无法完全模拟抑郁症失眠特征[13-14]。本实验在前人基础上同时设置快速和慢性睡眠剥夺两种方法,进行对比,选出能最大限度模拟临床发病特点的模型。
SD大鼠的神经系统与人类相似,广泛用于奖赏机制、认知记忆等高级神经活动的研究,且其垂体-肾上腺系统功能发达[15],常用作应激反应和肾上腺、垂体的反馈调节研究[16]。另外,此种属还具有获取简便、模拟率高、敏感度强及重复性好等特点。
本实验分别于抑郁造模14 d后和复合造模结束后对各组大鼠进行了行为学评价,目的是保证复合模型大鼠在抑郁状态前提下进行的失眠造模。结果显示,经过14 d的应激造模,CUMS+21 d SD组大鼠的各行为学已显示出抑郁样趋势;造模结束后,对比两个复合模型组,CUMS+21 d SD组大鼠表现精神萎靡、空间探索主动性降低、紧张恐惧心理增加。同样地,强迫游泳实验和糖水消耗实验结果显示经过长期的应激和慢性持续性的睡眠剥夺可大大增加大鼠的绝望程度,降低求生欲望,使得大鼠快感缺失严重,奖赏行为减少。
戊巴比妥钠翻正实验结果显示CUMS组大鼠睡眠潜伏期增长,睡眠时长显著缩短,说明抑郁症本身具有诱发失眠的倾向,但复合模型组比单纯抑郁症组的睡眠潜伏期更长,睡眠时长更短,进一步体现出复合因子造模的优势。且通过对比两个复合模型组,CUMS+21 d SD组大鼠的睡眠潜伏期有所增加,睡眠时长有所减少,进一步说明使用慢性应激联合长期睡眠剥夺复制抑郁症失眠模型成功率更高,稳定性更强。
下丘脑与垂体-肾上腺组成的HPA轴被称为是内分泌系统和神经系统的中心[17],HPA轴的活性中枢驱动因子CRH主要是由下丘脑室旁核分泌,故实验选择下丘脑作为关键区域。长期慢性应激状态下,CRH过度分泌,负反馈调节失灵,ACTH、CORT浓度显著增加,过多的CORT与其相应受体结合异常刺激CRH的分泌,这种恶性循环使得CORT一直处于高浓度状态,引发抑郁症慢性失眠[18]。同时,GABA对室旁核中的CRH神经元有抑制作用[19],HPA轴异常活化导致脑内Glu浓度明显上升,神经元兴奋性毒性增加,加重上述恶性循环,削弱下丘脑功能[20],这可能是抑郁症失眠的发病机制。另外,脑内单胺递质的含量常常作为评价抑郁模型的重要指标,许多研究表明单胺类神经递质与失眠的发生发展密切相关,对于睡眠-觉醒节律的调节具有重要意义[21]。本实验结果显示CUMS+21 d SD组大鼠相比于其他模型组大鼠血清中HPA轴指标水平较高,下丘脑中Glu含量增加、GABA含量减少、三种单胺递质水平降低。
综上所述,采用慢性不可预见性中度应激联合21 d睡眠剥夺的方法可以稳定复制抑郁症失眠大鼠模型,为后续实验的开展提供了一定的实践依据。
