Prnp-SNCA-A53T帕金森病转基因小鼠肠道菌群差异
2021-07-17徐美玲张帆张瑜桑明王普清
徐美玲张帆张瑜桑明王普清*
(1.湖北医药学院附属襄阳市第一人民医院,湖北 襄阳 441000;2.湖北省帕金森病临床医学研究中心,湖北 襄阳 441000)
帕金森病(Parkinson’s disease,PD)是常见的神经系统变性疾病,其主要病理改变为中脑黑质多巴胺能神经元的进行性脱失,残存神经元中α-突触核蛋白(α-synuclein,α-syn)聚集形成路易小体[1]。常见临床表现包括运动症状(肌强直、运动迟缓、静止性震颤、姿势步态障碍)和非运动症状(胃肠功能紊乱、便秘、嗅觉障碍、抑郁、睡眠紊乱、认知障碍和自闭等),其中部分非运动症状的出现明显早于运动症状。目前PD确切病因仍不清楚,过去的研究显示PD与遗传及环境等因素有关,但近年来,诸多的证据表明PD的发病可能起源于胃肠道且与肠道菌群失调有关[2-5]。其中1-甲基-4-苯基-1,2,3,6-四氢吡啶(MPTP)毒物模型及α-突触核蛋白转基因小鼠模型均被用于PD研究。MPTP帕金森病模型小鼠已被证实存在肠道菌群失调[6-7],而α-突触核蛋白转基因小鼠模型是否存在菌群失调尚未进行全面研究。
目前有多种α-突触核蛋白转基因小鼠模型,α-突触核蛋白点突变A53T被证实与PD相关[8-9]。其中Prnp-SNCA-A53T转基因小鼠模型是将A53T突变型人α-突触核蛋白基因导入小鼠体内,同时在Prnp启动子下表达。该模型可以很好的模拟帕金森症的发病情况,是研究PD发病机制较理想的小鼠模型。但是该模型小鼠是否也存在肠道菌群失调尚未见文献报道。
因此,本研究拟通过illumina高通量测序技术对Prnp-SNCA-A53T转基因模型小鼠肠道微生物生态特征进行分析研究,为探究粪便微生物与PD的相关性提供理论基础。
1 材料与方法
1.1 材料
1.1.1 实验动物
7只13周龄SPF级雌性A53T转基因小鼠及13只同性别同周龄野生型C57BL/6小鼠,共20只,体重20~24 g。Prnp-SNCA-A53T小鼠【SCXK(苏)2018-0008】由武汉大学张振涛教授实验室【SYXK(鄂)2015-0027】赠予,送至华中农业大学进行快速扩繁【SYXK(鄂)2015-0019】后,饲养于湖北医药学院附属襄阳市第一人民医院中心实验室【SYXK(鄂)2017-0093】,饲养期间各组小鼠可自由获得食物和水。饲养环境:昼夜各半循环照明,湿度控制在40%~60%,温度控制在(24±2)℃。本研究方案获湖北医药学院附属襄阳第一人民医院伦理委员会批准(2019DW008),并按实验动物使用的3R原则给予人道的关怀。
1.1.2 主要试剂与仪器
TIANamp粪便基因组DNA提取试剂盒(DP328-02,TIANGEN),AxyPrepDNA凝胶回收试剂盒APGX-250(Scipu003357,AXYGEN)。
生物安全柜(Hfsmfe-1500LC,上海力申科学(力康),中国),电泳仪,微量分光光度计(N50 Touch,Nanophotometer,德国),NovaSeq 6000测序仪(Illumina,美国)。
1.2 方法
1.2.1 动物分组与实验设计
选取7只SPF级雌性A53T转基因小鼠作为A53T组,同时选取同性别同周龄13只野生型C57BL/6小鼠作为对照组。所有小鼠在13周龄时收集粪便样品。
1.2.2 粪便的留取及其细菌DNA提取
在生物安全柜中分别收集每只小鼠新鲜粪便于无菌EP管中,按照粪便基因组DNA提取试剂盒说明书提取粪便细菌总DNA。用分光光度计检测DNA浓度和纯度。通过1%琼脂糖凝胶电泳对DNA进行质量检测,检测合格的DNA保存于-80℃冰箱备用。
1.2.3 16SrRNA扩增及测序
粪菌DNA冷链邮寄至微基生物科技(上海)有限公司,使用NGSIllumina进行细菌16SrRNA高通量测序。其中扩增16SV3-V4可变区的通用引物为357F(5′-ACTCCTACGGRAGGCAGCAG-3′),806R(5′-GGACTACHVGGGTWTCTAAT-3′)。
1.2.4 生物信息分析
下机后原始数据经过数据过滤,去除N含量超过10%、低质量(Q≤5)碱基数超过50%及barcode序列,以获得高质量的Clean data用于后期分析[10]。通过FastQC(v 0.11.8)软件对Clean data进行质量评估,利用QIIME2软件按照97%的相似性阈值序列划分为操作分类单元(operational taxonomic unit,OTU)。通过与Green genes 13.5数据库比对,对OTU进行物种注释。基于OTU和物种注释结果计算各样本在门(phylum),纲(class),目(order),科(family),属(genus)5个分类水平上的组成和相对丰度表,比较物种间差异。通过α多样性分析(αdiversity)得到粪便微生物的物种丰度和多样性信息。通过β多样性分析(β-diversity)分析两组组间物种的整体差异。最后利用PICRUSt软件对样本中可能存在的各级KEGG通路及丰度值进行预测。
1.2.5 序列登录号
研究所得序列均已提交至NCBI Sequence Read Archive数据库中,Bio Project编号为PRJNA675446。
1.3 统计学分析
利用R(4.0.2)软件及Graph Pad Prism(8.0.2)进行统计分析。使用独立样本t检验统计两组间差异。统计结果用平均值±标准误差(±s)表示,以P<0.05表示差异具有统计学意义。
2 结果
2.1 样本测序量及小鼠肠道菌群多样性评估
本次高通量焦磷酸测序共产生748 828条高质量序列,其中A53T组获得278 329条有效序列(平均每个样品序列数为39 761±3064);对照组获得470 499条有效序列(平均每个样品序列数为36 192±3311)。A53T组和对照组分别鉴定出672和1041个OTU,其中237种OTU为2组共有,A53T组包含435种特有OTU,而对照组包含804种特有OTU。α多样性可以体现组内微生物群落的丰富度和多样性。利用独立样本t检验对群落丰富度指数和群落多样性指数进行比较分析,结果如图1所示,其中Goods_coverage反映测序深度,两组测序的深度指数均接近1,结果说明测序深度均已经覆盖到样本中的所有物种(图1A)。ace指数和Shannon多样性指数分别反映菌群丰度和多样性,结果显示,A53T组的ace指数(图1B)和Shannon多样性指数(图1C)均大于对照组,但两者差异不显著。
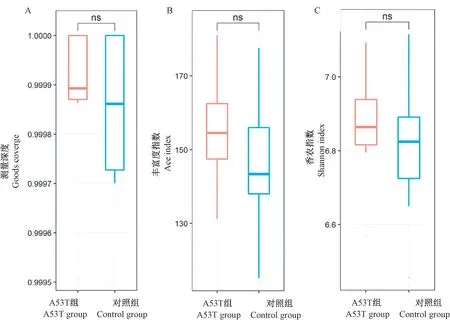
图1 A53T组与对照组小鼠肠道微生物α多样性分析Figure 1 α-diversity analysis of gut microbes in A53T and control group
2.2 肠道微生物β多样性分析
本文采用weighted UniFrac指数衡量β多样性,β多样性分析是用来比较物种多样性的差异大小,利用该指数得到的分析图中距离越大表示样本间的差异越大。主坐标分析PCoA显示A53T组和对照组基本处于不同区域,提示两组之间多样性存在差异(见图2)。
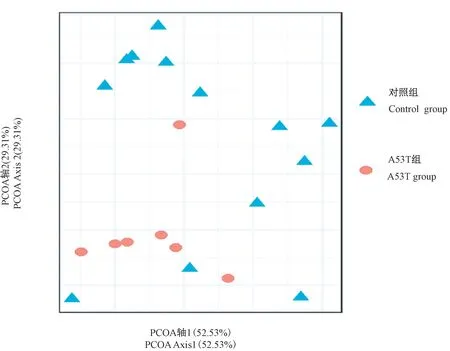
图2 A53T组与对照组小鼠肠道微生物β多样性分析Figure 2 β-diversity analysis of gut microbes in A53T and control group
2.3 小鼠肠道菌群结构组成
所有样本共鉴定得到8个门、18个纲、14个目、15个科和38个属。对A53T组及对照组小鼠肠道菌群结构进行分析,两组小鼠肠道菌群结构在门、纲、目、科及属水平均存在差异,其分组百分比堆积柱形图如图3所示。其中,两组小鼠肠道菌群结构在门水平主要由厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、变形菌门(Actinobacteria)及放线菌门(Actinobacteria)组成,其中A53T组的含量分别为17.1%、7.51%、0.88%及1.24%,而对照组分别为21.84%、11.94%、1.13%及0.57%,在属水平主要由毛螺旋菌属(Moryella)、拟杆菌属(Bacteroides)及李斯特氏菌属(Ammoniphilus)组成,其中A53T组的含量分别为11.95%、5.36%及1.95%,而对照组分别为17.38%、10.01%及1.66%。值得注意的是两组小鼠肠道中均存在大量无法鉴定的细菌。
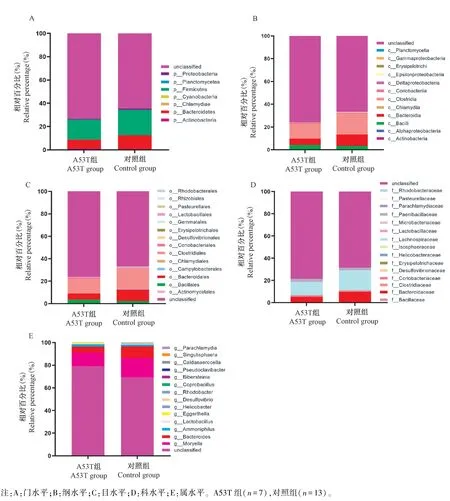
图3 A53T组与对照组小鼠肠道微生物在门、纲、目、科及属水平分组百分比堆积柱形图Note.A.Phylum level.B.Class level.C.Order level.D.Family level.E.Genus level.A53T mice(n=7),control mice(n=13).Figure 3 Analysis of the microbial structure at the phylum,class,order,family and genus level respectively in A53T and control group.
2.4 两组小鼠肠道菌群差异物种分析
为了比较两组小鼠肠道菌群的差异物种,本研究分别在门、纲、目、科及属水平分析肠道菌群的变化情况。在门水平,A53T组小鼠肠道微生物中放线菌门相对含量显著较高(P=0.0094),而拟杆菌门显著较低(P=0.0498);在纲水平,红蝽菌纲(Coriobacteriia)增高(P<0.0001),拟杆菌纲(Bacteroidia)降低(P=0.0398);在目水平,红蝽杆菌目(Coriobacteriales)增高(P<0.0001),拟杆菌目(Bacteroidales)降低(P=0.0398),红细菌目(Rhodobacterales)降低(P=0.0185);在科水平,红蝽杆菌科(Coriobacteriaceae)增高(P<0.0001),拟杆菌科(Bacteroidaceae)降低(P=0.0277),红杆菌科(Rhodobacteraceae)降低(P=0.0185);在属水平,伊格尔兹氏菌属(Eggerthella)显著较高(P=0.0002),而拟杆菌属(Bacteroides)(P=0.0277)和红杆菌属(Rhodobacter)显著较低(P=0.0249)(见图4)。
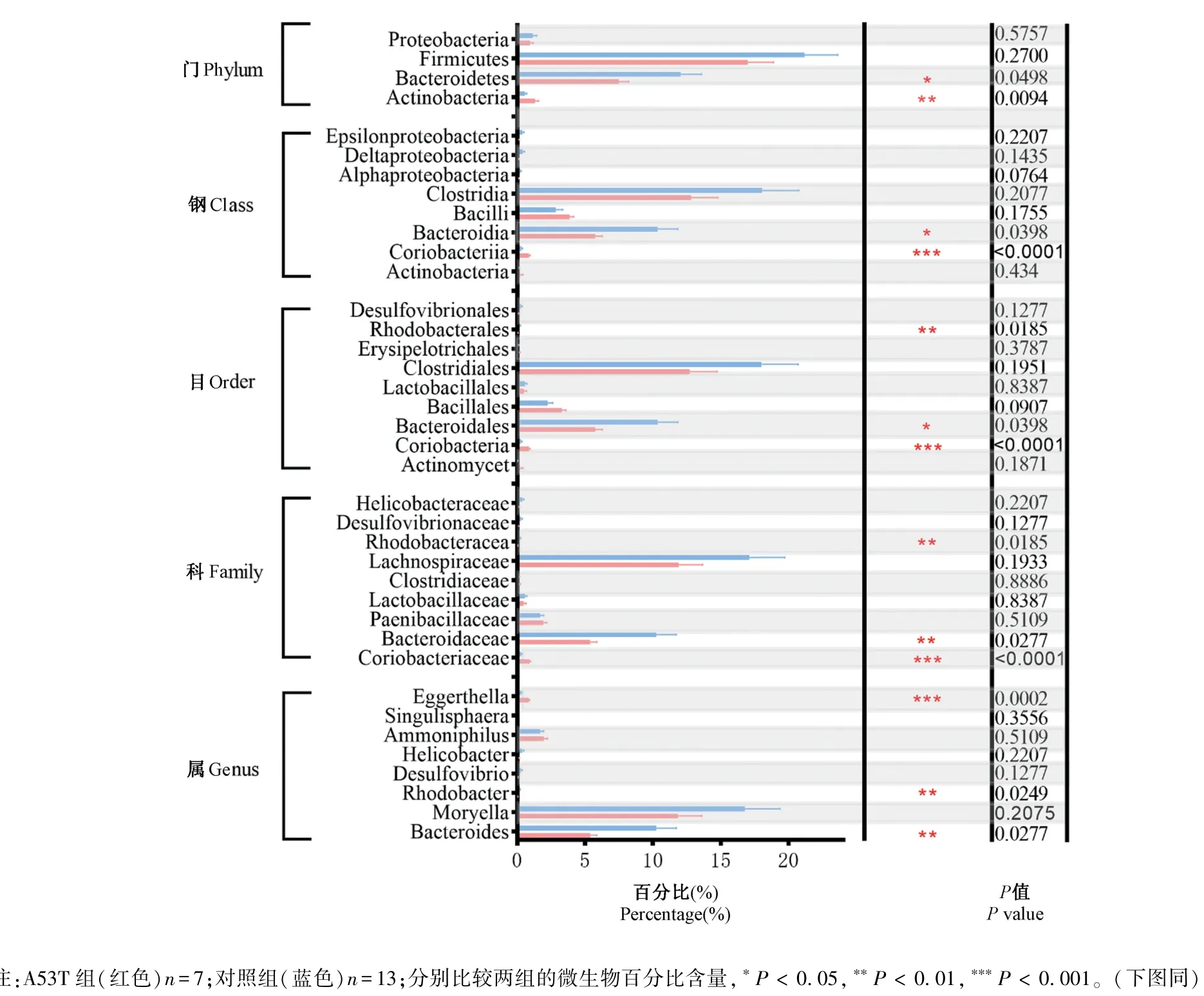
图4 A53T组与对照组肠道微生物物种差异分析Note.A53T group(red)n=7.Control group(blue)n=13.Compare the percentage of microbe in the two groups,*P<0.05,**P<0.01,***P<0.001.(The same in the following figures)Figure 4 Analysis of the difference of gut microbial between A53T and control group
2.5 PICRUSt肠道菌群功能预测分析
根据OTUs在每个样本中的表达丰度使用PICRUSt在线预测功能对各级KEGG通路及丰度值进行预测,共富集到328个功能通路,与对照组相比,A53T组有9条通路有显著性差异(P<0.05,图5),其中与环境信息处理相关的是G蛋白偶联受体(G protein-coupled receptors);与代谢相关的包括:类固醇激素合成(steroid hormone biosynthesis)、青霉素和头孢菌素生物合成(penicillin and cephalosporin biosynthesis)、泛醌和其他萜类醌的生物合成( ubiquinone and other terpenoid-quinone biosynthesis)、甲苯降解(toluene degradation)及聚糖的生物合成与代谢(glycan biosynthesis and metabolism);与细胞过程相关的包括:电子转移载体(electron transfer carriers)和减数分裂(meiosisyeast);与人类疾病相关的是非洲锥虫病(african trypanosomiasis)。说明A53T组与对照组之间的差异可能与这些功能通路相关。

图5 A53T组与对照组差异通路图Figure 5 Diagram of the differential pathway between A53T and control group
3 讨论
胃肠道被称为人的第二大脑[11-12],其内寄居大量的肠道微生物,正常的菌群结构保障人体代谢、免疫、内分泌功能处于较为稳定的水平,而肠道菌群紊乱与多种疾病的发生可能存在相关性[13-17]。国内外多项研究显示PD患者与健康对照组相比肠道微生物存在差异[4,18-23],并提出肠道菌群紊乱可能与PD发病相关联,但两者的因果关系尚不明确。目前多个研究者[6-7]选用MPTP等毒物模型研究肠道微生物与PD相关性及作用机制,但是相比于毒物模型,转基因模型可以更好地模拟帕金森病的病理学及行为学改变。因此,本研究从多样性及物种结构水平上分析Prnp-SNCA-A53T帕金森病转基因小鼠肠道菌群情况,并利用PICRUST预测其功能通路的变化。
本研究发现A53T组小鼠α多样性的ace指数及Shannon指数与对照组相比,虽然没有显著差异,但显示有上升趋势,该结果同MPTP小鼠模型的研究存在一致性[24]。β多样性及物种结构分析结果显示,两组的粪便微生物物种存在显著性差异,本研究分别在门、纲、目、科和属水平对差异菌群进行检测,发现转基因小鼠肠道微生物的放线菌门、红蝽菌纲及伊格尔兹氏菌属增高,而拟杆菌门及红细菌目降低,与在PD患者肠道微生物研究结果具有相似性[25-26]。
其中放线菌是厌氧或兼性厌氧菌,主要寄居在口腔、呼吸道、消化道和泌尿道的一种条件致病菌,当机体抵抗力下降时,可导致各种感染[27]。有研究认为帕金森病可能是放线菌潜伏感染所诱发的,当随着年龄的增长或者放线菌吞噬功能减退时引发PD[28]。伊格尔兹氏菌也属于放线菌门,被认为与炎症相关。同时,本研究在转基因小鼠中还发现红蝽菌丰度增高,有研究报道发现肥胖个体肠道菌群中红蝽菌科丰度增高,提示该物种可能具有导致代谢紊乱的作用[29]。
本研究还发现,相对于野生型小鼠,A53T转基因小鼠肠道拟杆菌门及红细菌目降低。有国外学者对拟杆菌的益生菌作用进行了研究,发现拟杆菌在帮助宿主分解多糖[30]、加快肠粘膜血管形成[31]、免疫系统发育[32]、维持肠道微生态平衡[33-34]等方面发挥着重要的作用。拟杆菌的减少,导致肠道粘膜屏障破坏及通透性增加,肠道细胞和细胞毒素接触增多,引起胃肠道局部及系统炎症反应及氧化应激反应,从而引发肠神经系统中α-syn积累,再通过肠-脑轴引发脑黑质神经炎症反应和损伤[35]。以上提示A53T小鼠存在机会致病菌增多而有益菌减少,这与在帕金森病患者的研究结果一致,即转基因小鼠也存在菌群失调。
信号通路预测发现,两组小鼠存在9个通路的功能差异,其中相对于野生型小鼠,A53T转基因小鼠G蛋白偶联受体表达下降。G蛋白偶联受体是细胞信号受体中最大的一个家族,参与多个细胞信号转导过程,能结合细胞周围环境中的化学物质并激活细胞内的一系列信号通路,最终引起细胞状态的改变。2020年Khakisahneh研究小组[36]证实细菌的代谢产物如短链脂肪酸(SCFA),可作为旁分泌或内分泌因子,通过作用于细胞膜上的G蛋白偶联受体,抑制上皮和肠免疫细胞中的组蛋白脱乙酰基酶,调节宿主的能量代谢、上皮屏障免疫等生理过程。SCFA包括乙酸、丙酸、戊酸和丁酸,均来自结肠中膳食纤维的微生物发酵,是结肠细胞的主要能源。在对PD患者肠道代谢产物研究中发现,PD患者与正常对照组间短链脂肪酸存在差异[37]。此外,本研究还发现转基因小鼠类固醇激素合成信号通路表达也下降,有研究表明类固醇激素对大脑发育、认知、记忆、决策及防止抑郁症起着重要作用[38]。而肠道菌群可以通过不同的降解和活化途径来影响某些激素的水平,例如雄激素和雌激素。研究表明雌激素对小胶质细胞具有抗炎作用,并且由于微生物群落改变而引起的雌激素水平降低似乎会增加认知障碍和慢性炎症[39]。
综上所述,本研究主要分析了帕金森病转基因小鼠与野生型小鼠肠道菌群结构的差异,结果发现转基因小鼠机会致病菌增多而有益菌减少,表明转基因小鼠存在菌群失调,在应用相关模型时应当予以考虑。同时转基因模型小鼠与野生型小鼠代谢通路存在差异,这将为后期侧重于研究这些代谢通路对帕金森病的影响提供理论依据。
