巨噬细胞炎症蛋白-1ɑ拮抗剂联合硼替佐米通过抑制Erk1/2/Bax促进骨髓瘤骨病成骨的作用
2021-07-16陈卫琼蒋芳王姗姗黄勃屈付君黄林王晓桃
陈卫琼 蒋芳 王姗姗 黄勃 屈付君 黄林 王晓桃
桂林医学院第二附属医院(广西桂林541100)
多发性骨髓瘤(multiple myeloma,MM)是一种B 细胞恶性肿瘤,溶骨性破坏是其主要表现之一[1]。骨髓瘤骨病(myeloma bone disease,MBD)的发生机制是破骨细胞(osteoclast,OC)活性增加,成骨细胞(osteoblast,OB)活性受抑制,导致骨吸收和骨形成平衡失调[2]。研究发现巨噬细胞炎症蛋白-1α(macrophage inflammatory protein 1-α,MIP-1α)、白介素(interleukin,IL)-6 和骨硬化蛋白(sclerostin,SOST)等在内的多种破骨细胞活化因子影响OC 分化[3-5]。本团队前期研究发现MIP-1α与MBD关系密切,目前MIP-1α在MBD 发生中的作用,主要集中在OC 的激活[3]。研究发现,MIP-1α也有抑制OB 的作用,但其抑制OB 的特点不明确[3,5]。有文献报道,骨髓瘤中瘤细胞分泌的MIP-1α可促使G 蛋白Ras 和Rho 异戊稀化,从而导致MM 患者骨髓中的Rho 亚家族蛋白A(Ras homologueA,RhoA)水平增高,RhoA 与其下游的效应蛋白Rho 相关卷曲螺旋形成蛋白激酶1(Rho-associated coild-protein kinas,ROCK1)相互作用参与细胞增殖和转录活性[6-8],且前期研究发现在MM 患者中RhoA/ROCK1 高表达[9]。活化的RhoA/ROCK1 可以激活细胞外调节蛋白激酶(extracellular regulated protein kinase,Erk),而Erkl/2 与其有同源结构域,Erkl/2 的作用底物是Bax,Erkl/2 活化后上调Bax,启动凋亡信号通路,最终引起OB 凋亡[3]。目前国内外针对MIP-1α是否通过Erk1/2/Bax 影响成骨作用未见相关报道。
硼替佐米(bortezomib,Bor)在临床上常用于MBD 患者[10]。有报道发现,Bor 可通过APRIL-NFkB 通路抑制MIP-1α[11]。基于此,本研究通过构建MBD 小鼠模型,在给予MIP-1α拮抗剂干预后,检测小鼠骨质破坏严重程度并评估OB 和OC 功能状态及相关蛋白表达,以此来探讨MIP-1α拮抗剂联合Bor 是否抑制Erk1/2/Bax 通路影响MBD 成骨作用及MIP-1α拮抗剂与Bor 联合治疗是否具有协同作用。
1 材料与方法
1.1 试剂与材料RPMI1640 培养(美国Gibco 公司);胎牛血清(美国Gemini 公司);裂解液(北京索来宝公司);PVDF 膜(Millipore 公司);ECL 发光试剂盒、山羊抗兔的二抗、山羊抗鼠的二抗、β-actin(北京中杉);一抗:ERK、BAX、Caspase-3、Caspase-9(ABCAM);ELISA 试剂盒:sRANKL、BALP、OPG、SOST、MIP-1α、IL-6(CUSABIO);CD138+抗体、免疫组化抗原修复缓冲液(福州迈新生物技术开发有限公司);硼替佐米、Bx471(美国MCE 公司)。
1.2 实验方法
1.2.1 细胞培养MM IM-9 细胞株培养于含青霉素与链霉素组成的RPMI-1640 培养基中,置于37 ℃、5%CO2的细胞培养箱,每3~4 天传代。
1.2.2 MBD 小鼠局部成瘤模型选择4 ~6 周龄的SCID 小鼠,在上肢接种绝对数1×106个(100 μL瘤细胞悬液)的IM-9 细胞,当皮下移植瘤生长到直径约15 ~30 mm 时,HE 染色和免疫组化鉴定恶性浆细胞建模成功后,将成瘤小鼠按腹腔给药分为四组:对照组(0.9%生理盐水)、Bor 组(Bor 0.5 mg/kg,1、4、8、11 d 共4 次)、Bx471 组(BX471 2 mg/kg,每周2 次,共4 次)、Bor 联合Bx471 组(Bor 及Bx471,剂量及用法同上)[12-13]。
1.2.3 X 线检测各组骨损情况给药结束后4 d,收集静脉血,处死各组小鼠,俯卧位将小鼠固定,用X 线(型号:FLAT-BYM)检测骨质破坏情况。
1.2.4 小鼠中RANKL、OPG、BALP、MIP-1α、SOST、IL-6 蛋白及因子含量的测定将上述静脉血15 000 rpm/15 min 低温离心,取上清液备用。分离各组上肢瘤组织,冲洗剪碎,将剪碎的组织与对应体积的PBS(按1∶9 的重量体积比)加入玻璃匀浆器中,在冰上充分研磨及混匀,最后将匀浆液12 000 rpm/10 min,取上清备用。具体按照ELISA试剂盒说明书步骤进行。
1.2.5 Western blot 检测信 号 通路Erkl/2、Bax、Caspase 3、Caspase 9 蛋白质的表达取上述瘤组织上清液,采用BCA 测蛋白浓度。在10%SDSPAGE凝胶上分离等量的蛋白质,然后转移到PVDF膜上。用5%脱脂牛奶封闭后,封闭后的膜直接放入相应一抗工作液中,孵育,洗膜,将洗涤后的一抗反应膜放入二抗工作液中,孵育,洗膜。曝光及洗片,以β-actin 表达量作为内参,用Image J 软件(版本号1.4.3.67,Tanon 公司)测定条带灰度值。
1.3 统计学方法采用SPSS 23 软件进行数据分析,计量资料服从正态分布,比较采用单因素方差分析,组间两两比较采用LSD-t检验,P<0.05 表示差异有统计学意义,GraphPad Prism 6.0 软件进行数据作图。
2 结果
2.1 MBD 小鼠病理学及各组骨质破坏影像学特征与正常小鼠(图1A)相比,成瘤小鼠右上肢出现局部肿大(图1C)。正常小鼠组织HE 染色切片未见异型细胞,CD138+免疫组化特异染色未见浆细胞(图1B)。成瘤小鼠皮下瘤组织HE 染色:显微镜下可见多处细胞质增大,细胞核偏位排列弥漫密集的异性细胞;CD138+免疫组化特异染色可见多处细胞棕染,鉴定为克隆性浆细胞(图1D)。X 线显示,成瘤小鼠(对照组)右上肢出现病理性骨折(图2B),骨质破坏程度高于正常小鼠(图2A),经Bor(图2C)、Bx471(图2D)及双药(图2E)联合治疗小鼠骨质破坏程度低于对照组。
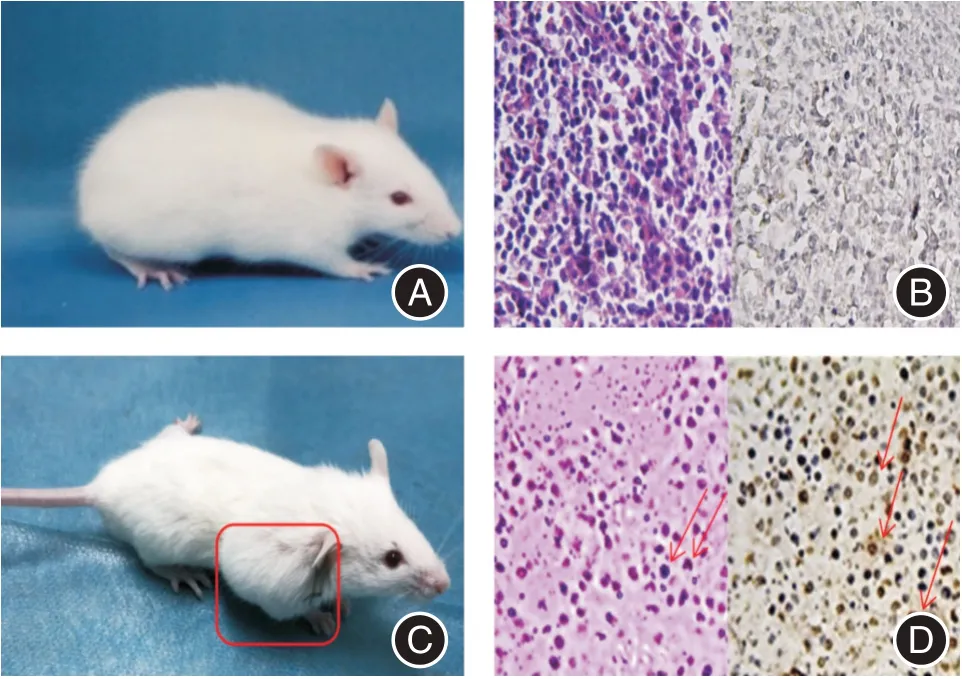
图1 MBD 小鼠病理学检测Fig.1 Pathological detection of MBD mice
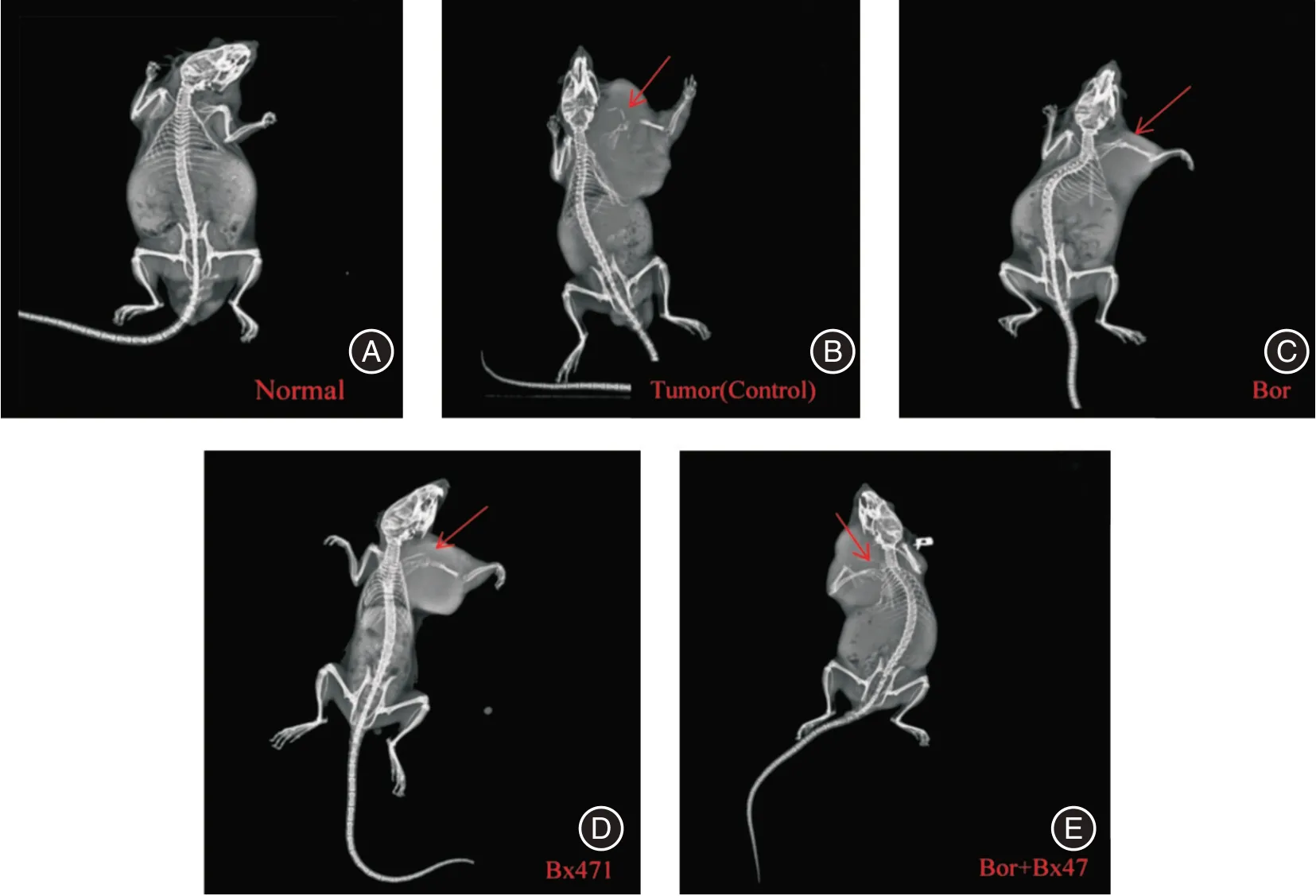
图2 MBD 小鼠骨质破坏影像学特征Fig.2 Imaging features of bone destruction in MBD mice
2.2 MIP-1α拮抗剂联合硼替佐米可抑制破骨作用而促进成骨作用结果显示,对照组的MIP-1α、SOST、RANKL、IL-6 水平高于Bor 及Bx471 组(P<0.05),且明显高于Bor+Bx471 组(P<0.000 5),而OPG、BALP 的表达明显低于Bor+Bx471 组(P<0.000 5)。见表1、图3。
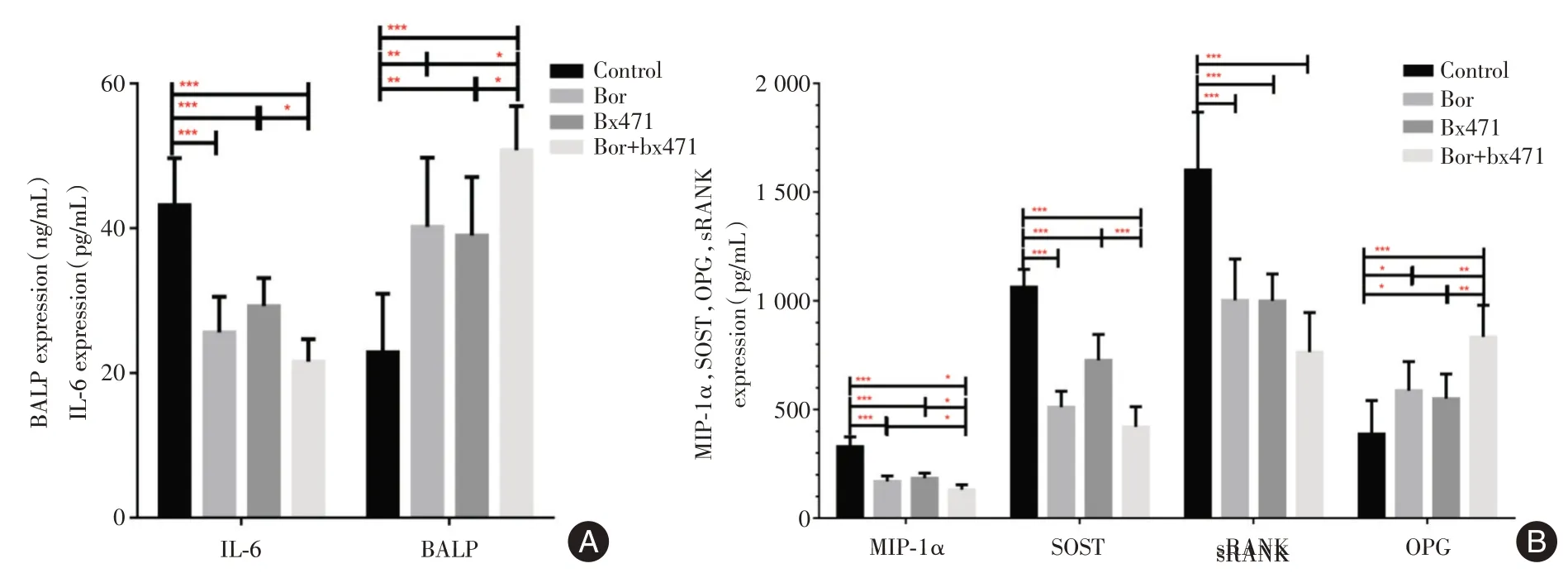
图3 各组小鼠中MIP-1α、SOST、IL-6、BALP、RANK、OPG 蛋白表达水平Fig.3 Relative expression levels of MIP-1α,SOST,IL-6,BALP,RANK and OPG in each group of mice
表1 不同组别中MIP-1α、SOST、IL-6、BALP、RANK、OPG 因子及蛋白表达水平Tab.1 Relative expression of factors and protein expression levels of MIP-1α,SOST,IL-6,BALP,RANK and OPG in different groups ±s

表1 不同组别中MIP-1α、SOST、IL-6、BALP、RANK、OPG 因子及蛋白表达水平Tab.1 Relative expression of factors and protein expression levels of MIP-1α,SOST,IL-6,BALP,RANK and OPG in different groups ±s
组别Control Bor Bx471 Bor+Bx471 MIP-1(ng/mL)239.9±44.2 169.9±24.7 184.1±23.7 131.2±22.4 IL-6(ng/mL)43.2±6.4 25.6±4.9 29.2±3.8 21.5±3.1 BALP(ng/mL)22.8±8.0 40.1±9.5 39.0±8.0 50.7±6.1 SOST(pg/mL)1 063.6±81.6 511.2±73.2 726.5±119.6 420.1±93.6 RANK(ng/mL)1 601.7±266.7 1 002.2±189.7 999.2±114.1 764.0±182.5 OPG(ng/mL)387.4±154.2 586.7±134.5 550.2±113.7 833.7±146.5
2.3 MIP-1α拮抗剂联合硼替佐米抑制Erkl/2、Bax、Caspase 3、Caspase 9 蛋白质的表达结果显示,对照组的Erkl/2、Bax、Caspase 3、Caspase 9 蛋白表达高于Bor 组及Bx471 组(P<0.001),且明显高于Bor+Bx471 组(P<0.001)。见图4。
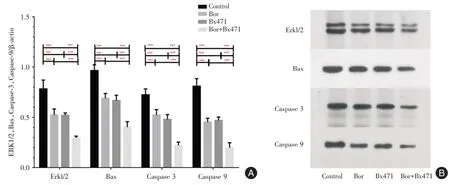
图4 各组小鼠中Erkl/2、Bax、Caspase 3、Caspase 9 蛋白表达水平Fig.4 Protein expression levels of Erkl/2,Bax,Caspase 3,Caspase 9 in each group of mice
3 讨论
了解骨髓微环境中细胞相互作用对于开发针对骨髓瘤细胞靶向治疗和调节MBD 骨稳态的新型药物至关重要[1]。本实验通过抑制MIP-1α产生后,上调OPG 表达,下调RANKL 表达,X 线显示骨密度增加,同时肿瘤负荷IL-6 表达减少。其机制可能是MIP-1α抑制剂通过抑制某种破骨细胞信号通路,下调的RANKL/OPG 比例,从而阻断破骨细胞活化及增殖,从而重建骨代谢平衡。在MM 患者的骨髓活检中发现OB 是受抑制的,并且与肿瘤负荷相关[5]。据报道,瘤细胞超过50%,可抑制OB活性[6]。因此,MIP-1α拮抗剂可能通过减少肿瘤负荷,增强OB 活性[14]。
持续抑制Erk 信号传导可促进OB 的发展[15-16]。本研究通过抑制MIP-1α产生,Erk1/2、Bax 表达下降,骨质破坏程度改善,可能MIP-1α拮抗剂抑制Erk1/2/Bax 通路促进OB 增殖。MIP-1α主要被认为是破骨细胞活化因子,在骨骼疾病的发病机理中促进分解代谢活性[17]。本实验结果确定了MIP-1α的新作用,它可能是OB 功能的抑制剂和MM 中OB/OC 解偶联的介质。同时,经Bor 治疗后的小鼠结果与MIP-1α拮抗剂(Bx471)组大致相同,且双药联合效果更为显著。其可能通过抑制NF-κB 信号通路,下调RANKL/OPG 比例,阻碍破骨细胞活化,重建骨质代谢平衡。有报道发现硼替佐米可通过APRIL-NF-KB 通路抑制MIP-1α表达[11]。因此,Bor 可能通过APRIL-NF-KB 信号通路抑制MIP-1ɑ,从而抑制Erk1/2/Bax 通路,促进OB 增殖。结论有待进一步验证。
在本实验中,通过抑制MIP-1α产生,SOST 表达下降。研究发现大部分MBD 患者骨髓的SOST水平与骨质破坏程度相关,同时SOST 与MIP-1α呈正相关[3]。此外,在新诊断MM 患者中发现由SOST 基因编码的骨硬化蛋白的高水平表达,且与晚期MM 具有相关性[18]。推测可能在晚期MBD 患者中,MIP-1α刺激瘤细胞高表达SOST,两者相互作用,促进OB凋亡[19-20]。除此之外,经Bor治疗后,SOST 下降,这可能是由于Bor 的抗骨髓瘤作用。Bor 下调SOST 的表达揭示了Bor 在逆转骨髓瘤OB功能中的另一种作用机制[21]。
综上,MIP-1α拮抗剂联合Bor 可能通过抑制Erkl/2/Bax/Caspase-3/Caspase-9 通路,从而促进OB增殖及抑制OC 分化,双药联合治疗对于MBD 成骨作用效果可能更为显著。本实验尚有不足之处,研究所采用的局部成瘤造模方式不能完全模拟MBD 的骨髓微环境和从MM 发展到MBD 的生理病理机制过程。然而,本次实验将MIP-1α从MBD 复杂的骨髓微环境中抽离出来单独分析其导致骨质破坏的原因,可以避免其他因子和通路对实验结果的干扰。但仍需在体外细胞进行下一步验证。
