不同基因型胶质母细胞瘤细胞系辐射抵抗性差异研究
2021-07-16简海锋梁惠平岑柏宏袁亚维
简海锋 梁惠平 岑柏宏 袁亚维
广州医科大学附属肿瘤医院放疗科(广州510095)
胶质母细胞瘤(glioblastoma,GBM)是最常见的中枢神经系统恶性肿瘤,约占胶质瘤的57%[1-2],GBM 增殖快、侵袭力强,且预后极差[3-4]。放射治疗是针对GBM常规且有效的治疗手段之一,它能有效杀灭肿瘤细胞,延长患者生存期[4]。放疗使GBM细胞发生DNA 双链断裂,最终杀灭肿瘤细胞[5]。然而,GBM 极易发生放疗抵抗,极大制约了放疗效果[6]。GBM异质性极高,存在EGFR过表达或EGFR VⅢ突变的肿瘤细胞亚群,它们主要经EGFR 通路产生原发性放疗抵抗,同时在反复多次照射过程中,发生辐射诱导EGFR 通路和NF-κB 通路激活,从而引起继发性放疗抵抗[7-8]。辐射后NF-κB 通路激活能够通过激活乳腺癌相关基因1(BRCA1)、乳腺癌相关基因2(BRCA2)、非同源末端结合重组蛋白Ku70 及共济失调毛细血管扩张突变基因(ATM)等基因,激活同源重组依赖的DNA 损伤修复过程[9-10],而辐射后EGFR 通路激活可以介导PI3K/AKT/DNA-PK 等通路,促进非同源末端连接依赖的DNA 损伤修复[11-12]。因此,EGFR 和NFκB 通路的激活共同促进了GBM 辐射后的DNA 损伤修复,从而增强了GBM 辐射抵抗性。
GBM 的发生发展与P53 基因突变或蛋白功能失活有关,它在GBM 中突变率为30.25%[13]。PTEN抑癌基因在GBM 中突变率为30.75%,它可通过抑制PI3K/AKT信号通路,从而抑制细胞过度增殖[14]。MGMT 是编码一类DNA 甲基转移酶的基因,通过将DNA 鸟嘌呤O6 位上的甲基转移到本身半胱氨酸残基上,从而修复DNA 损伤,降低烷化剂(如替莫唑胺)的细胞毒作用,促进肿瘤化疗抵抗[15-16]。当MGMT 启动子发生甲基化时,基因编码受阻,MGMT 表达下降,增强肿瘤化疗敏感性[17-19]。在GBM 中,MGMT 启动子甲基化率仅为44.7%[20]。
有研究指出,通过抑制胶质瘤细胞NF-κB 的活性,可以下调MGMT 的表达,进而增加其对替莫唑胺的化疗敏感性[21]。此外,p53 突变型和MGMT高表达的GBM 细胞系拥有更强的放化疗抵抗性,可能与其DNA 修复能力相关[22]。但关于EGFR、PTEN 与MGMT 之间的调控关系,目前仍未有明确报道。
目前国内外少有关于不同基因型GBM 辐射抵抗性比较的报道,以及不同基因型GBM 辐射后,DNA 断裂情况、NF-κB 通路与EGFR 通路的激活随时间的变化情况目前尚不明确。本研究选取三种不同基因型GBM 细胞系(U87MG、U251MG、U118MG)为研究对象,通过比较它们的辐射抵抗性,及其辐射后DNA 断裂情况、NF-κB 效应分子(RELA/p65)及EGFR 激活的时间依赖性变化,为临床使用放疗增敏剂(NF-κB 抑制剂、EGFR 抑制剂)的最佳使用时间提供理论依据。
1 材料与方法
1.1 细胞来源GBM 细胞系(U87MG、U251MG、U118MG)购买于中国科学院细胞库。
1.2 主要试剂DMEM 培养基、胎牛血清、PBS 缓冲液(美国GIBCO 公司),Annexin V-FITC/PI 凋亡试剂盒(贝博生物科技有限公司),4%多聚甲醛溶液(永津生物科技有限公司)、2.5%结晶紫甲醇溶液(北京雷根生物技术有限公司)、BCA 蛋白浓度检测试剂盒(上海碧云天生物技术研究所),MGMT抗体(中国proteintech公司),Phoso-p65抗体、p65抗体、Phoso-EGFR 抗体、EGFR 抗体、γH2AX 抗体(美国abcam公司)、山羊抗兔二抗(美国Bioworld 公司),P53、PTEN 基因全外显子引物由上海生工生物工程有限公司合成。
1.3 方法
1.3.1 细胞培养含10%胎牛血清的DMEM 培养基、5%CO2、37 ℃恒温培养箱中培养。
1.3.2 基因测序对U87MG、U251MG、U118MG 的P53、PTEN 基因进行全外显子测序,由上海生工生物工程有限公司完成。
1.3.3 细胞凋亡检测辐射后48 h,消化并制备细胞悬液,离心,PBS 洗涤,用1×Annexin V 结合液重悬细胞400 μL,加入5 μL Annexin V-FITC 染色液,4 ℃避光孵育15 min,再加入5 μL PI 染色液混匀,4 ℃避光孵育5 min,在流式细胞仪检测凋亡水平。
1.3.4 平板克隆形成辐射后24 h,接种1 000个/孔到六孔板中,加入4%多聚甲醛溶液固定,吸干后再加入2.5%结晶紫甲醇溶液避光固定,吸干后用自来水缓慢冲洗,晾干后拍照。
1.3.5 Western blot加入蛋白裂解液(含有1%蛋白酶抑制剂和1%磷酸化酶抑制剂)提取细胞总蛋白,以BCA 蛋白浓度检测试剂盒进行定量,用SDS-PAGE 分离蛋白,电转法把蛋白转膜至PVDF膜上,5%BSA封闭,加入一抗(MGMT 1∶1 000、Phoso-p65 1∶1 000、P65 1∶1 000、Phoso-EGFR 1∶1 000、EGFR 1∶1 000、γH2AX 1∶5 000、GAPDH 1∶10 000),4 ℃摇床过夜,TBST 洗膜,二抗(1∶3 000)常温孵育2 h,TBST 洗膜,于化学发光成像仪中拍照。
1.4 统计学方法实验数据采用SPSS 23.0软件分析,结果均以均数±标准差表示,两组均数比较采用t检验,多样本均数比较采用单因素方差分析,以P<0.05表示差异有统计学意义。
2 结果
2.1 胶质母细胞瘤细胞系的基因型
2.1.1 P53 基因突变情况U87MG、U251MG、U118MG 的P53 基因全外显子测序结果见图1。

图1 胶质母细胞瘤细胞系的P53 基因突变情况Fig.1 P53 gene mutations in different glioblastoma cell lines
2.1.2 PTEN 基因突变情况U87MG、U251MG、U118MG 的PTEN 基因全外显子测序结果见图2。

图2 不同胶质母细胞瘤细胞系的PTEN 基因突变情况Fig.2 PTEN gene mutations in different glioblastoma cell lines
2.1.3 MGMT 的表达情况U87MG 与U251MG 低表达MGMT,提示U87MG 与U251MG 的MGMT 的启动子发生甲基化。U118MG 高表达MGMT,提示U118MG 的MGMT 的启动子无甲基化,见图3。U87MG、U251MG、U118MG 的P53、PTEN、MGMT 突变或表达情况见表1。

表1 胶质母细胞瘤细胞系的基因突变情况Tab.1 Gene mutations in different glioblastoma cell lines

图3 胶质母细胞瘤细胞系MGMT 的表达情况Fig.3 Expression of MGMT in different glioblastoma cell lines
2.2 不同基因型胶质母细胞瘤细胞系辐射抵抗性的比较
2.2.1 细胞凋亡水平的比较U87MG、U251MG、U118MG 分别经过2、5、10 Gy 辐射后48 h,细胞凋亡水平的比较见图4A,细胞凋亡率变化值的比较见图4B。可见,各剂量下凋亡率变化值:U87MG >U118MG >U251MG,差异有统计学意义(P<0.05),见图4B。
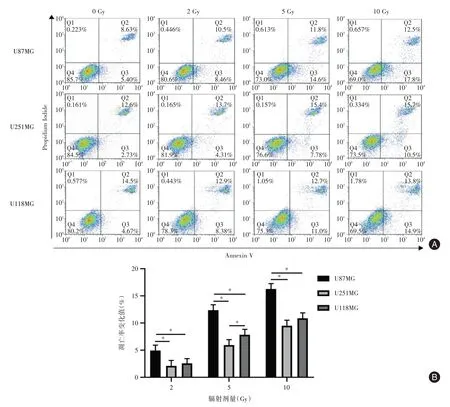
图4 不同基因型胶质母细胞瘤细胞系不同剂量辐射后48 h 细胞凋亡水平的比较Fig.4 Comparison of apoptosis levels of 48 h cells after different doses of radiation in different genotypes of glioblastoma cell lines
2.2.2 平板克隆形成的比较U87MG、U251MG、U118MG 经2 Gy 辐射后存活分数分别为0.437、0.625、0.515,5 Gy 辐射后为0.087、0.195、0.12,10 Gy辐射后为0.001、0.004、0.001,差异有统计学意义(P<0.05),见图5。因此,存活能力大小为U251MG >U118MG >U87MG。

图5 GBM 细胞系不同剂量辐射后平板克隆形成的情况Fig.5 Formation of GBM cell lines after different doses of radiation
2.3 不同胶质母细胞瘤细胞系辐射后DNA 断裂与NF-κB 效应分子(p65)及EGFR 激活的比较
2.3.1 DNA断裂情况的时间依赖性比较U87MG、U251MG、U118MG 分别经过2、5 Gy 辐射后,γH2AX在1 h 后达到峰值,但5 Gy 辐射后γH2AX 上升程度明显高于2 Gy 的γH2AX 上升程度,1 h 后逐渐下降,5 Gy 的γH2AX 下降速度明显低于2 Gy,提示在5 Gy 辐射引起的DNA 断裂情况比2 Gy 的严重。
U87MG、U251MG、U118MG 经过2 Gy 辐射后48 h γH2AX 基本下降恢复至辐射前水平,提示三种细胞在2 Gy辐射后48 h DNA断裂修复基本完成;而U87MG经过5 Gy辐射后48 h γH2AX仍高于正常水平,提示U87MG 在5 Gy 辐射后48 h 仍存在明显的DNA 断裂,DNA 修复未完成;U251MG、U118MG经过5 Gy 辐射后48 h γH2AX 下降至正常水平,提示U251MG、U118MG 经过5 Gy 辐射后48 h DNA 断裂基本修复完成,见图6。可见,经过2 Gy、5 Gy 辐射后,DNA 断裂严重程度:U87MG >U118MG >U251MG。
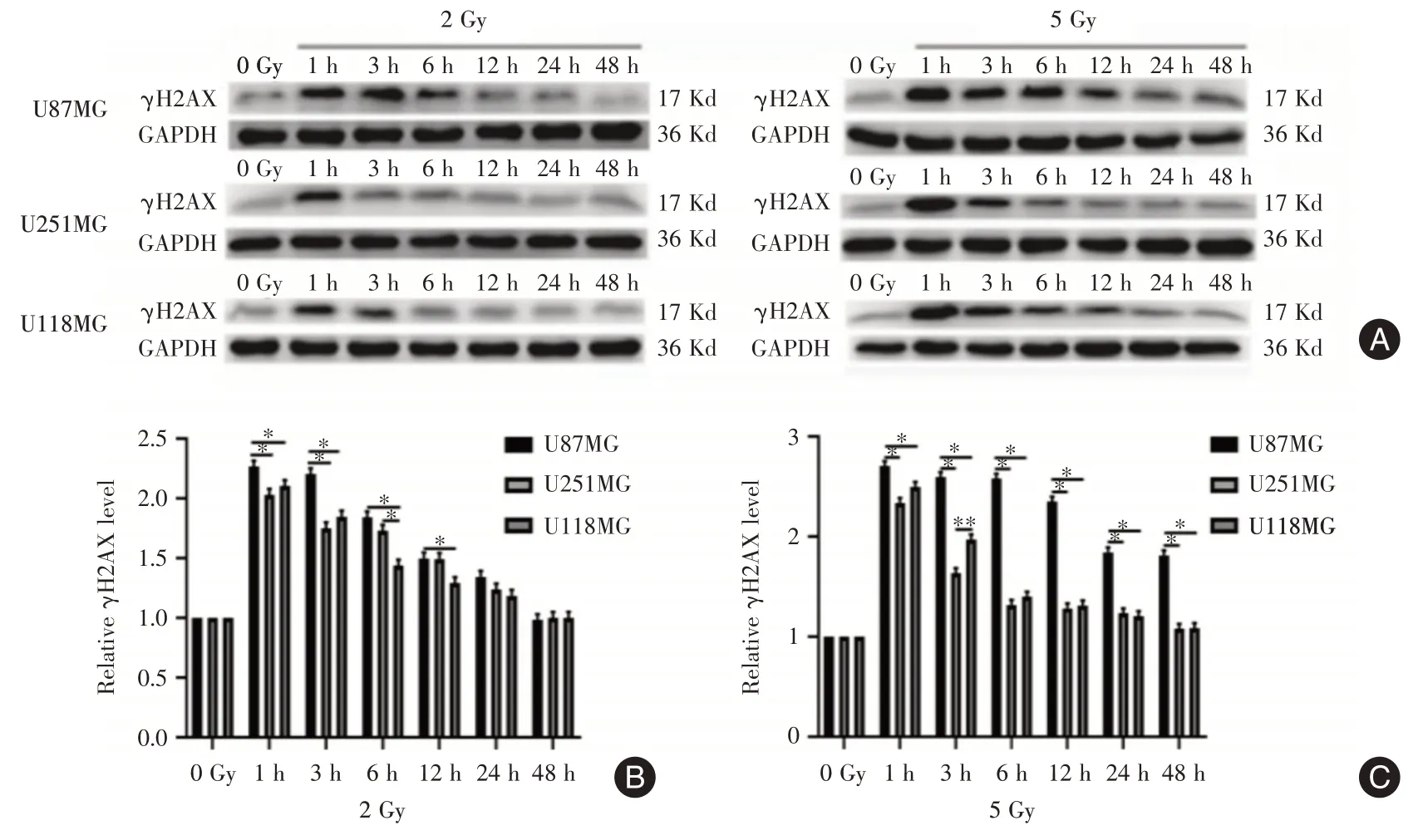
图6 DNA 损伤标记蛋白(γH2AX)的时间依赖性比较Fig.6 Time-dependent comparison of DNA damage marker proteins(γH2AX)
2.3.2 NF-κB 效应分子(p65)激活的时间依赖性比较U87MG、U251MG、U118MG 经过2 Gy 辐射后1 h p65开始激活,辐射后3 h p-P65表达上升到峰值,而后逐渐下降,辐射后48 h U87MG 的p-P65 表达仍未降至正常水平,而U251MG、U118MG 的p-P65 表达降至正常水平。提示2 Gy 辐射后48 h,U87MG 的NF-κB 效应分子(p65)仍处于激活状态,并介导DNA 损伤修复过程,而U251MG、U118MG中NF-κB 激活介导的同源重组修复(HRR)过程已经完成。
经过5 Gy 辐射后,U87MG 在辐射后6 h p-P65表达上升到峰值,而且持续至24 h 才出现回落,在48 h 恢复至基础水平;U251MG 在辐射后1 h 达到峰值,而3 h 则开始出现回落,6 h 基本恢复至基础水平;U118MG 在辐射后6 h 达到峰值,而在12 h后开始回落,48 h 基本恢复至基础水平。这些结果表明p-P65 介导的HRR 通路的DNA 损伤修复能力大小为:U251MG >U118MG >U87MG,见图7。

图7 NF-κB 效应分子(p65)激活的时间依赖性比较Fig.7 Time-dependent comparison of NF-κB effector molecule(p65)activation
2.3.3 EGFR 激活的时间依赖性比较U87MG、U251MG、U118MG 经过2 Gy 辐射后6 h p-EGFR 表达上升到峰值,而后逐渐下降,辐射后48 h U87MG的p-EGFR 表达仍未降至正常水平,而U251MG、U118MG 的p-EGFR 表达降至正常水平。提示2 Gy辐射后48 h,U87MG 的EGFR 仍处于激活状态,并介导DNA 损伤修复过程,而U251MG、U118MG 中EGFR 激活介导的非同源末端连接(NHEJ)通路的DNA 损伤修复过程已经完成。
经过5 Gy 辐射后,U87MG 在辐射后12 h p-EGFR 表达上升到峰值,而且持续至24 h 才出现回落,在48 h 时,仍未恢复至基础水平;U251MG 在辐射后3 h 达到峰值,而6 h 则开始出现回落,48 h 基本恢复至基础水平;U118MG 在辐射后6 h 达到峰值,而在24 h 后开始回落,48 h 基本恢复至基础水平。
以上结果表明EGFR 介导的NHEJ 通路的DNA 损伤修复能力大小为:U251MG >U118MG >U87MG,见图8。

图8 EGFR 激活的时间依赖性比较Fig.8 Comparison of time-dependent EGFR activation
3 讨论
本研究选取三种不同基因型GBM 细胞系(U87MG、U118MG、U251MG),均为p53 和PTEN 基因突变型,其中U118MG 高表达MGMT,U87MG 与U251MG 低表达MGMT。本研究发现辐射抵抗性:U251MG >U118MG >U87MG。说明GBM 细胞系辐射抵抗性与其基因型具有相关性,初步提示临床检测GBM 基因型对预测其辐射抵抗性具有重要意义。
p53 是参与DNA 损伤反应的重要蛋白之一。当肿瘤细胞发生轻微DNA 损伤时,早期p53 会促进MDM2、p21 等基因的转录,引起细胞周期停滞,而晚期p53 会促进RAD51、RAD52 等基因的转录,促进DNA 损伤修复。当肿瘤细胞发生严重DNA 损伤时,p53 会促进凋亡相关基因的转录,同时抑制DNA 损伤修复,最终引起细胞凋亡[23]。因此,GBM接受放疗剂量的辐射而发生严重DNA 损伤时,p53蛋白因突变而失去其介导凋亡和抑制DNA 损伤修复的作用,从而使得p53 基因突变型的GBM 的辐射抵抗性增强。此外,p53 突变型和MGMT 高表达的GBM 细胞系拥有更强的放化疗抵抗性,可能与其DNA 较强修复能力相关[22]。在P53 突变的肿瘤细胞中,NF-κB 的激活增强[24]。而在细胞衰老过程中,p53-MDM2 途径会下调EGFR 的表达来诱导细胞衰老[25]。
PTEN 也是参与DNA 损伤反应的重要蛋白之一。PTEN 突变的肿瘤细胞对DNA 损伤修复的能力更强,因此其辐射抵抗性更强[26]。此外,NF-κB的激活可以下调PTEN的表达,促进肿瘤的发生[27]。PTEN 可以抑制PI3K/AKT/mTOR 途径,从而抑制细胞过度增殖,而EGFR 激活可以介导PI3K/AKT/mTOR 通路激活,促进细胞过度增殖,引起肿瘤进展[28]。关于PTEN 与MGMT 之间的联系,目前未有明确报道。
此外,本研究通过比较不同基因型GBM 细胞系在不同剂量(2、5 Gy)辐射后各时间点的DNA 断裂情况、NF-κB 效应分子(p65)以及EGFR 的激活,结果发现:辐射后DNA 断裂严重程度:U87MG >U118MG >U251MG。NF-κB以及EGFR信号通路激活持续时间长短均为:U251MG >U118MG >U87MG,表明NF-κB 介导的HRR 通路及EGFR 介导的NHEJ通路的DNA 损伤修复能力大小为:U251MG >U118MG >U87MG。
辐射后NF-κB 及EGFR 信号通路激活,促进了GBM 辐射后的DNA损伤修复,增强辐射抵抗性[7-8]。目前,蛋白酶体抑制剂(如马利佐米、硼替佐米等)为代表的NF-κB抑制剂已经进入GBM的Ⅱ期临床试验,它们可抑制NF-κB 抑制蛋白α(NF-κB inhibitor α,NFKBIA)的降解,从而抑制NF-κB 信号通路激活。GBM 存在EGFR 过表达或EGFR VⅢ突变的肿瘤细胞亚群[8]。此外,已有针对EGFR 突变的药物上市应用于治疗GBM,主要有酪氨酸激酶抑制剂(TKI,如奥希替尼、达克替尼等)与单克隆抗体(如帕尼单抗、西妥昔单抗等)[8,12,29-30]。结合本研究结果,辐射后NF-κB 与EGFR 信号通路激活具有的时间依赖性,使用NF-κB 抑制剂、EGFR 抑制剂联合放射治疗GBM 时,当辐射后NF-κB 与EGFR信号通路达到激活峰值时,同时药物在患者体内达到最大肿瘤累积浓度时,可以更加有效抑制辐射后NF-κB 与EGFR 信号通路的激活,从而抑制DNA 损伤修复过程,增强放疗对GBM 的杀伤。
本研究可为进一步研究GBM 的辐射抵抗性与其基因型的关系提供了实验基础,同时也为临床使用NF-κB 抑制剂与EGFR 抑制剂的最佳时间提供初步的理论依据,但辐射后NF-κB 与EGFR 信号通路的下游分子机制的剂量与时间依赖性仍需进一步研究。
