夯实基础 适度拓展——高三一轮复习中的碳、硅和硼
2021-07-15广西金敖然
广西 金敖然
碳、硅和硼是高中化学非金属及其化合物知识结构中重要的组成部分,也是高考的高频知识点,碳、硅及其化合物与人类日常生活及工业生产有着密切联系,尤其在工艺流程题中出现的频率很高。硼及其化合物往往以新材料、新科技为背景,以工艺流程或者化学实验为载体进行考查。然而硼和硼酸、草酸等物质都不是教材上的内容。因此在高三一轮复习时注重夯实基础知识的同时有必要进行适度知识拓展,从而将一轮复习做得扎实有效。
一、2017—2020年全国卷的考查情况

表1 2017—2020年全国卷考情统计
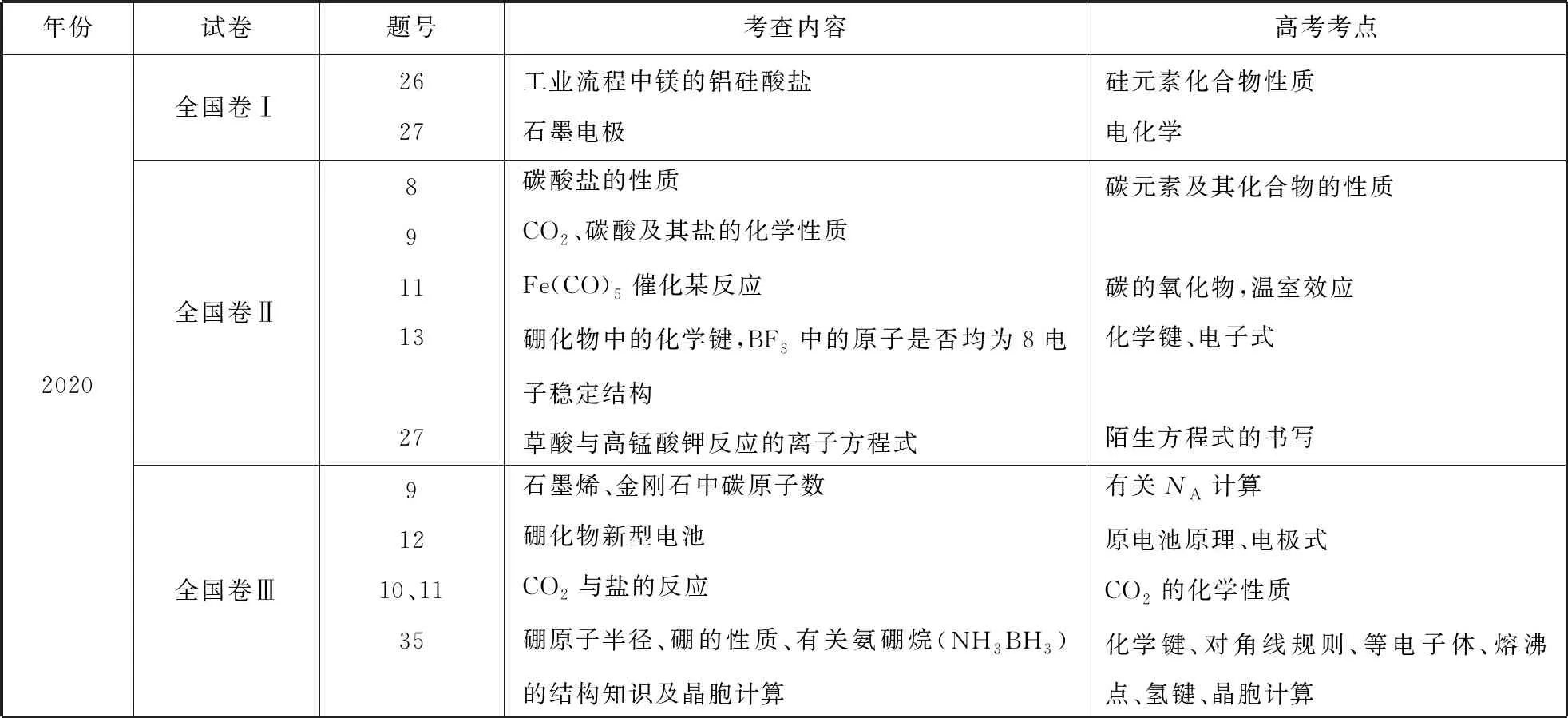
续表
二、知识梳理
1.碳单质及其化合物
(1)碳的同素异形体包括金刚石、石墨、石墨烯以及碳原子簇C60、C70等。
金刚石属于原子晶体,熔点高,硬度大。金刚石晶体中每个碳原子采用sp3杂化,四个价电子全部参与成键,故金刚石不导电,金刚石的结构如图1所示。

图1 金刚石结构
石墨是片层状晶体,属于混合晶型,晶体内部有共价键、金属键、分子间作用力等,石墨熔点高,硬度低。石墨结构如图2所示,晶体层内每个碳原子采用sp2杂化,未参与成键的电子自由移动,具有导电性,通常用作电极材料。石墨内部层与层之间以分子间作用力结合,结合作用力很弱,外力作用在层与层之间可以发生相对的滑动,因此石墨质软,可以做润滑剂。

图2 石墨结构
碳原子簇可以表示为Cn,n一般小于200。其中研究最为深入的是C60,C60分子中60个碳原子构成类似足球形称为足球烯,结构如图3所示,球面为32面体,其中有12个正五边形和20个正六边形的面,每个碳原子近似于sp2杂化与相邻的3个碳原子相连,未参与杂化的p轨道在C60的球面形成大π键。
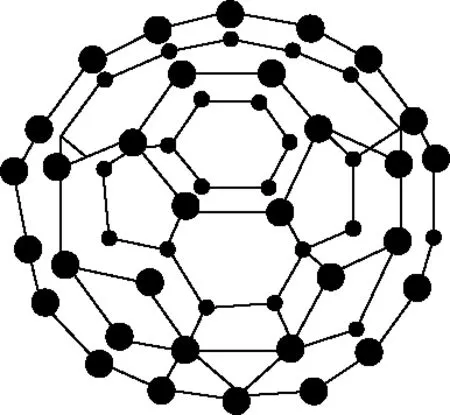
图3 C60结构
(2)碳酸钠与碳酸氢钠
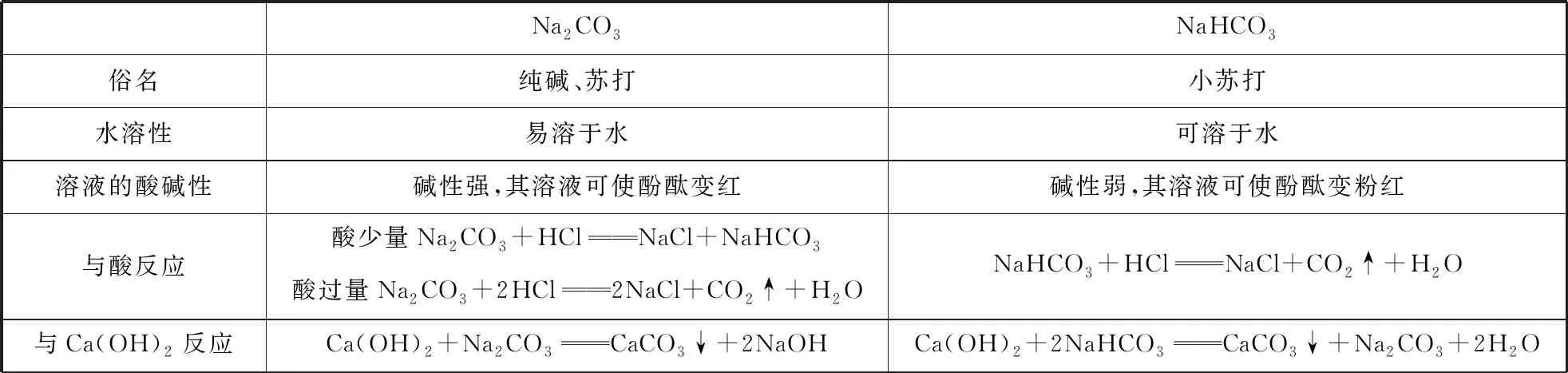
表2 Na2CO3与NaHCO3性质对比

续表
2.硅及其化合物
(1)硅有两种同素异形体,分别是晶体硅和无定型硅。本文重点讲晶体硅,晶体硅微观结构类似于金刚石的原子排列,晶体硅呈灰黑色,高熔点,高硬度,硅是良好的半导体材料,可以做芯片和太阳能电池。
a.化学性质

b.硅单质的生产与纯化
(2)二氧化硅(SiO2)
二氧化硅是原子晶体,高熔点、高硬度。自然界中水晶、石英的主要成分就是SiO2。

表3 二氧化硅的性质及用途
注意:①SiO2是酸性氧化物,与绝大多数酸不反应,氢氟酸是一个特例
②氢氟酸能与SiO2反应,故氢氟酸不能盛放在玻璃瓶中,而应存放在塑料瓶中。
(3)硅酸、硅酸盐、硅酸盐材料
①硅酸(H2SiO3)是一种比碳酸还弱的二元弱酸,不溶于水的白色胶状沉淀。SiO2是硅酸的酸酐,但是它不溶于水。所以通常实验室制取硅酸,是利用酸化可溶性硅酸盐的原理。


硅酸盐是由硅、氧、金属元素组成的化合物的总称。通常不溶于水,常见的可溶性硅酸盐为硅酸钠(Na2SiO3),俗称泡花碱。硅酸钠的水溶液是一种黏稠状液体,俗称水玻璃。水玻璃在工业上常用作黏合剂,是木材的防火防腐剂。自然界中的硅酸盐种类繁多,硅酸盐矿物组成复杂,通常可以写成氧化物的形式。如:硅酸钠(Na2SiO3)写成Na2O·SiO2,正长石(KAlSi3O8)写成K2O·Al2O3·6SiO2。
②硅酸盐材料
硅酸盐材料又称传统无机非金属材料,它包括玻璃、水泥、陶瓷三个工业。
③新型无机非金属材料
新型无机非金属材料包括:光导纤维、特种陶瓷(高温结构陶瓷、半导体陶瓷、生物陶瓷、碳化硅陶瓷、压电陶瓷等)以及复合材料(碳纤维、玻璃钢等)。
三、适度拓展
1.草酸(H2C2O4)又名乙二酸,结构简式为HOOC—COOH。草酸晶体(H2C2O4·H2O)是无色固体,熔点101℃,易溶于水,受热易脱水升华。
a.草酸的化学性质

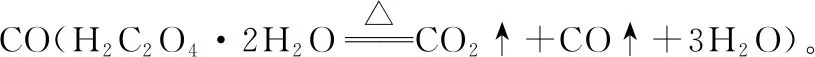

2.硼及其化合物
(1)硼单质的同素异形体包括晶体硼和无定形两大类。这里重点讲晶体硼,晶体硼呈黑灰色,硬度极高,是典型的原子晶体。晶体硼的基本结构单元为正二十面体(B12)如图4所示,每个B12结构单元包含20个正三角形,30个B—B键。
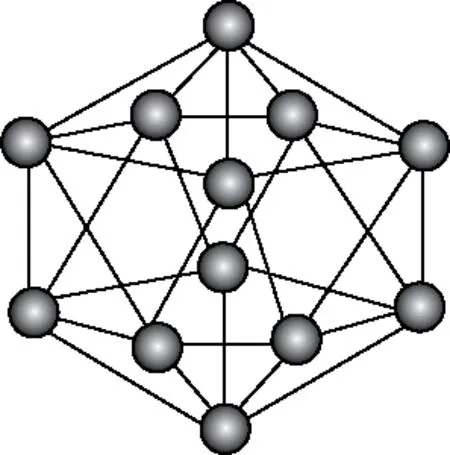
图4 晶体硼(B12)结构
(2)硼酸(H3BO3)具有片层结构,层间通过分子间作用力结合在一起。层内硼原子以sp2杂化与三个OH基团结合形成平面B(OH)3单元,单元之间再通过氢键联合成层状结构。如图5所示。

图5 H3BO3的层状结构

【例1】(2018·全国卷Ⅱ·28节选)(3)测定三草酸合铁酸钾(K3[Fe(C2O4)3]·3H2O)中铁的含量。
①称量mg样品于锥形瓶中,溶解后加稀H2SO4酸化,用cmol·L-1KMnO4溶液滴定至终点。滴定终点的现象是____________________。
②向上述溶液中加入过量锌粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中。加稀H2SO4酸化,用cmol·L-1KMnO4溶液滴定至终点,消耗KMnO4溶液VmL。该晶体中铁的质量分数的表达式为____________________。

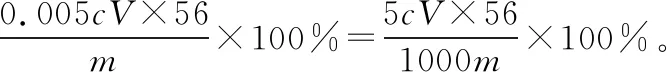
【备考策略】有关铁的质量分数计算中,涉及草酸与酸性高锰酸钾反应的方程式书写,虽然草酸的相关知识不是教材上的,但是在高三的教学实践中,经常会遇到有关草酸的试题,如果能在高三一轮复习备考过程中,适度拓展学习草酸的知识,那么学生在答题实战中,无疑准确率和速度会大为提升。
【例2】(2019·全国卷Ⅰ·26节选)硼酸(H3BO3)是一种重要的化工原料,广泛应用于玻璃、医药、肥料等工业。一种以硼镁矿(含Mg2B2O5·H2O、SiO2及少量Fe2O3、Al2O3)为原料生产硼酸及轻质氧化镁的工艺流程如下:
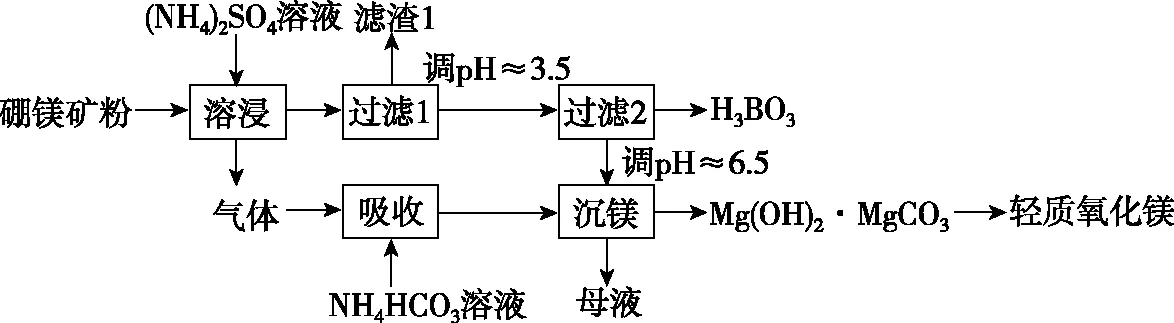
图6
回答下列问题:

【答案】(3)一元弱 转化为H3BO3,促进析出
【解析】(3)由硼酸的解离方程式知,硼酸在水溶液中通过与水分子的配位作用产生氢离子,而三价硼离子最多只能再形成一个配位键,且硼酸不能完全解离,所以硼酸为一元弱酸;在“过滤2”前,将溶液pH调节至3.5,目的是将B(OH)-4转化为H3BO3,并促进H3BO3析出。
【备考策略】本题涉及H3BO3性质的相关知识考查,试题中给了H3BO3的相关信息,但是仍旧有一部分学生根据H3BO3书写结构认为它是三元酸。同样硼元素及其化合物在平时的训练中出现得也较为频繁。如果各位教师在备考中将这部分知识适度拓展给学生,那么为学生后面的学习和做题无疑铺平了道路。

