基于催化原理解决高考中的催化剂试题
2021-07-15广东余晓梅
广东 张 超 余晓梅
催化剂在生命现象和现代工业中发挥着重要作用,催化化学已经成为当代化学学科发展的前沿和趋势。《普通高中化学课程标准(2017年版2020年修订)》(以下简称《课程标准》指出:“知道化学反应是有历程的,认识基元反应活化能对化学反应速率的影响。知道催化剂可以改变反应历程,对调控化学反应速率具有重要意义。”《课程标准》中与催化剂有关的描述颇多,体现了课程教学要与生产实际相结合,高考中对催化剂的关注和考查也越来越深刻,需要师生对催化剂的原理有更加深刻的认识,然而中学化学教材中关于催化剂的内容鲜有更新而且对原理的讲解较为简单和模糊,本文结合大学教材中催化剂的理论基础,从催化剂的反应历程、催化剂的种类和催化剂的选择性出发,对历年与催化剂相关的高考试题,进行较深入的分析和解读,论述高考命题的价值导向和科学导向,以期对化学高考的有效复习提供一定的指向。
一、催化剂及催化反应历程图
中学教材中催化剂的概念是“能改变化学反应速率而在反应前后本身的质量和化学性质不变的物质”,其中“改变”包括“加快”和“减慢”两层含义;而2014年国际纯粹与应用化学联合会(简称“IUPAC”)已将“催化剂(Catalyst)”定义为“催化剂是增加反应速率但不改变总反应的标准吉布斯自由能的物质,催化剂既是反应的反应物,也是该反应的生成物”,而且其中具有减慢反应速率作用的物质被称为“抑制剂(Inhibitor)”。另外,其实催化剂是有“寿命”的,杂质、高温等因素会导致催化剂失活,高中阶段这些不完备的认识是由于学生对催化剂的反应历程认知不完备。
反应历程是指化学反应所经历的途径或过程,又称反应机理。化工生产中通过研究反应的反应历程,从而找出决定反应速率的关键,进而控制和利用反应,达到生产中多快好省的目的。
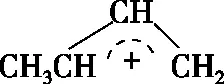
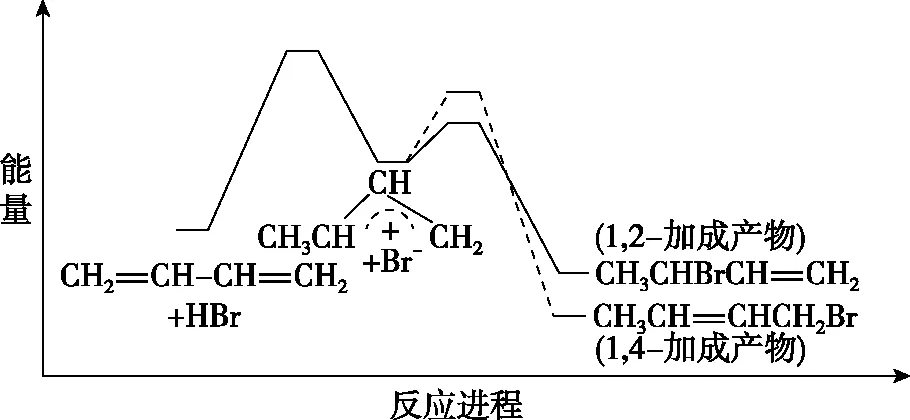
图1
( )
A.1,4-加成产物比1,2-加成产物稳定
B.与0℃相比,40℃时1,3-丁二烯的转化率增大
C.从0℃升至40℃,1,2-加成正反应速率增大,1,4-加成正反应速率减小
D.从0℃升至40℃,1,2-加成正反应速率的增大程度小于其逆反应速率的增大程度
【答案】AD
【解析】本题考查化学反应和能量的关系。物质的能量越低越稳定,由图1可以看出1,4-加成产物的能量更低,因此更稳定,A正确;由图1可以看出该反应为放热反应,升高温度平衡向逆反应方向进行,反应物的转化率降低,即40℃的转化率更低,B错误;温度升高反应速率加快,两个反应的速率都加快,C错误;由于温度升高平衡逆向移动,所以正反应速率增大的程度小于逆反应速率增大的程度,D正确。
【练习1】(2018·海南卷·12)炭黑是雾霾中的重要颗粒物,研究发现它可以活化氧分子,生成活化氧。活化过程的能量变化模拟计算结果如图2所示。活化氧可以快速氧化二氧化硫。下列说法正确的是
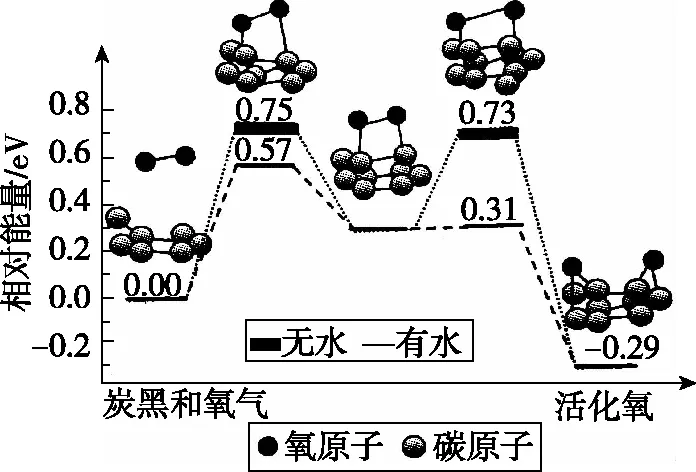
图2
( )
A.每活化一个氧分子吸收0.29 eV的能量
B.水可使氧分子活化反应的活化能降低0.42 eV
C.氧分子的活化是O—O的断裂与C—O键的生成过程
D.炭黑颗粒是大气中二氧化硫转化为三氧化硫的催化剂
【答案】CD
【启示】大部分催化剂都会参与反应历程,改变反应的路径,形成中间产物,减小反应的活化能,根据过渡态理论,先找到过渡态,算出该反应历程中最大能垒(活化能),活化能越大,反应速度越慢;催化剂在某个历程中被消耗,在另外的历程中又重新生成,根据这种循环的机制确定催化剂:先与最初反应物分子参与反应,又在生成最后产物的同时生成的物质为催化剂,其他物质通常是中间产物。
二、催化反应的类型
有催化剂参加的反应称为催化反应。根据催化剂和反应物存在的状态来划分,催化反应通常可以分为均相催化反应和多相催化反应,前者催化剂和反应物质处在同一相,如均为气态或液态,后者则不是同一相,这时反应在两相界面上进行。工业上的许多重要的催化反应大多是多相催化反应,而且催化剂以固体物质,反应物为气态或者液态居多。
1.均相催化


即反应物先与催化剂生成不稳定的中间产物,然后中间产物再分解成产物,而催化剂得以再生。由于生成中间产物的反应①和中间产物分解反应②的活化能都小于原反应的活化能,所以先生成中间产物,再分解成生成物就成了反应的一条捷径,降低了反应的活化能。在配位催化过程中,催化剂大多数是配合物,或者是反应历程中催化剂与反应物生成了配合物,在研究该反应需要充分考虑到配合物的结构特点。
在均相催化反应中也存在不需另加催化剂而能自动发生催化作用的情况,即是自催化反应。例如,加热分解高锰酸钾制取氧气的反应,随着反应的进行,反应速率逐渐加快,这是由于反应生成的二价锰离子对该反应具有催化作用。均相催化剂一般具有高活性、高选择性和反应条件温和等优点,但最大的问题是催化剂的分离回收。
【例2】(2020·全国卷Ⅱ·11)据文献报道:Fe(CO)5催化某反应的一种反应机理如图3所示。下列叙述错误的是
图3
( )
A.OH-参与了该催化循环
B.该反应可产生清洁燃料H2
C.该反应可消耗温室气体CO2
D.该催化循环中Fe的成键数目发生变化
【答案】C

【练习2】(2020·全国卷Ⅰ·10)铑的配合物离子[Rh(CO)2I2]-可催化甲醇羰基化,反应过程如图4所示。
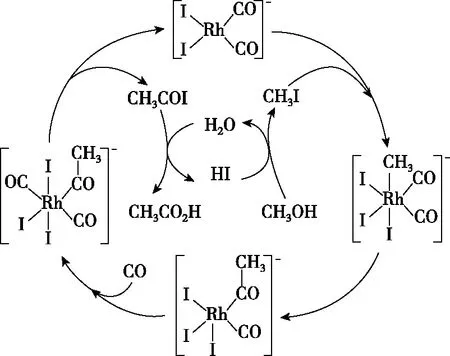
图4
下列叙述错误的是
( )
A.CH3COI是反应中间体

C.反应过程中Rh的成键数目保持不变

【答案】C
2.多相催化
多相催化在化工生产和科学实验中大量应用,最常见的催化剂是固体,反应物为气体或者液体。由于多相催化与表面吸附有关,所以比表面积越大,催化效率越高。在工业上,催化剂通常附着在一些不活泼的多孔性物质上,这种物质称为催化剂的载体。载体的作用是使催化剂分散在载体上,产生较大的表面积,同时可以节省催化剂的用量。常用的载体有硅藻土,高岭土、硅胶和分子筛等。有时在反应体系中含有少量的某些物质,就会严重降低甚至完全破坏催化剂的活性。这种物质称为催化毒物,这种现象称为催化剂中毒。因此,应用多相催化于工业生产中,保持原料的纯净是十分重要的。
【例3】(2020·浙江七月选考·29节选)(2)①CO2和C2H6按物质的量1∶1投料,在923 K和保持总压恒定的条件下,研究催化剂X对“CO2氧化C2H6制C2H4”的影响,所得实验数据如表1:

表1
结合具体反应分析,在催化剂X作用下,CO2氧化C2H6的主要产物是________,判断依据是________。
②采用选择性膜技术(可选择性地让某气体通过而离开体系)可提高C2H4的选择性(生成C2H4的物质的量与消耗C2H6的物质的量之比)。在773 K,乙烷平衡转化率为9.1%,保持温度和其他实验条件不变,采用选择性膜技术,乙烷转化率可提高到11.0%。结合具体反应说明乙烷转化率增大的原因是________________。
【答案】①CO,C2H4的产率低,说明催化剂X有利于提高反应Ⅲ速率
②选择性膜吸附C2H4,促进反应Ⅱ平衡正向移动
【解析】①由数据可知,CO2的转化率约为乙烷的两倍,且生成乙烯的量远小于乙烷的转化量,说明该过程中是以反应Ⅲ为主,催化剂主要加快了反应Ⅲ的速率。②选择性膜使生成的乙烯通过并离开反应体系,降低了乙烯浓度,则有利于反应Ⅱ平衡正向移动,从而提高乙烯的产率。
【练习3】(2018·北京卷·8)我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。该历程示意图如图5所示。
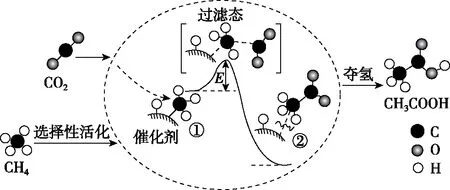
图5
下列说法不正确的是
( )
A.生成CH3COOH总反应的原子利用率为100%


D.该催化剂可有效提高反应物的平衡转化率
【答案】D
【启示】该题是多相催化反应,由于多相催化与表面吸附有关,所以一般比表面积越大,催化效率越高。因此过多的杂质气体吸附在催化剂表面,会造成催化剂表面对反应物的吸附下降,从而导致催化剂的部分失活。
三、催化的选择性
催化反应一般是多步骤的,催化剂的化学选择性一般是可同时进行几种并行的反应或进行经过生成中间产物的串行反应,从而使反应出现主要反应和副反应之分,相应地反应产物也有主产物和副产物之分,由此就产生了催化剂的选择性问题。所谓催化剂选择性是指催化剂加速主要反应的程度,即反应物消耗于生成主产物的百分数。




其中可近似认为第二步反应不影响第一步的平衡。下列表述正确的是________(填标号)。
A.v(第一步的逆反应)>v(第二步反应)
B.反应的中间产物只有NO3
C.第二步中NO2与NO3的碰撞仅部分有效
D.第三步反应活化能较高
【答案】AC
【解析】此反应由若干个基元反应组成,第一步基元反应快速平衡,第二步是慢反应,由于慢反应是整个反应的决速步骤,故相较第一步快速平衡而言,其速率更小,A正确;而对比各步基元反应发现,中间产物有NO3和NO,B错误;根据有效碰撞理论,分子发生反应的条件是成为活化分子和合理的取向,不论快慢反应亦是如此,且第二步的反应速率慢更加说明NO2与NO3的碰撞仅部分有效,C正确;活化能越高,则普通分子变成活化分子越困难,发生有效碰撞几率越小,反应速率越慢,第三步却是快反应,故D错误。
【启示】该题是串行反应,总反应速率由慢反应决定,催化剂通过催化其中的慢反应而发挥作用,加入催化剂降低慢反应的活化能,从而提高反应速率。对于并行反应,选用不同的催化剂可增大工业上所需要的某个反应的速率,同时对其他不需要的反应加以抑制,从而表现出催化剂是具有选择性的。另外,对某一反应来说,起催化作用的物质往往有多种,不同的催化剂催化效果也不同,同时注意温度对催化剂的活性有显著影响,在复习备考中,要注重知识之间的逻辑关系,使知识结构化和系统化。

相关数据如表2:
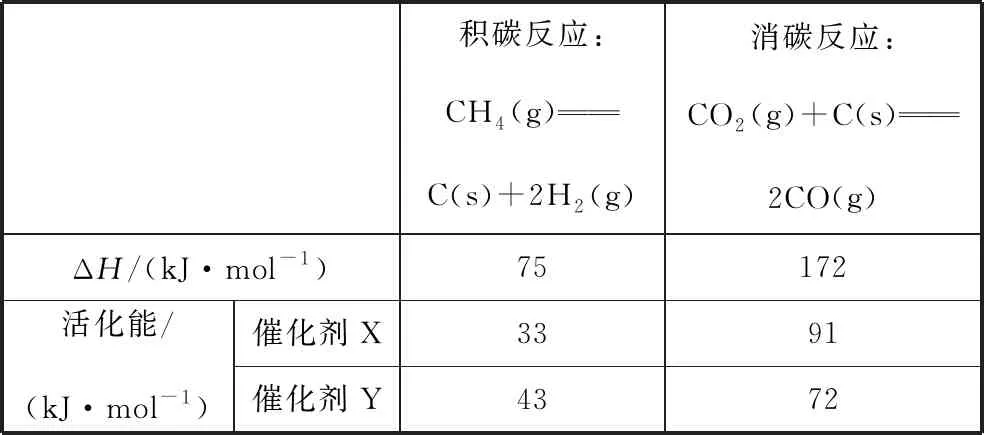
表2
由表2判断,催化剂X________(填“优于”或“劣于”)Y,理由是________________。
【答案】劣于 相对于催化剂X,催化剂Y积碳反应的活化能大,积碳反应的速率小,而消碳反应活化能相对小,消碳反应速率大。
催化剂的选择性还包括区域选择性和对映选择性。当反应物分子中有几个部分可以发生反应时,催化剂的加入使反应主要在某一部分发生,生成需要的目标产物,则催化剂的区域选择性高。当具有潜手性中心的反应物分子进行不对称催化反应时,催化剂主要促进产物中某一种对映异构体生成,则此催化剂的对映选择性高。

