肝细胞癌癌组织CBX7和PERK表达及其对手术治疗后患者预后的影响*
2021-07-14王婷婷王娜娜
王婷婷,辛 洋,王娜娜
肝细胞癌(hepatocellular carcinoma,HCC)的一些生物学特征与相关信号通路有关,其中RAF/MEK/ERK信号通路是调节肝癌细胞恶性生物学特征的重要通路之一[1-4]。磷酸化胞外信号调节激酶(phosphorylated extracellular signal-regulated kinase,PERK)是调节RAF/MEK/ERK信号通路的下游激酶,是一种关键的活性蛋白,最终进入细胞核,激活多种转录因子,调节基因的表达[5]。研究表明,PERK在肝癌组织中明显高表达[6]。除了PERK外,色素框同源蛋白7(chromobox protein homolog 7,CBX7)也是可调控癌细胞的重要蛋白之一[7]。CBX7是在人正常细胞中发现的一种参与调控细胞衰老的转录抑制因子,在结肠癌、胃癌和肝癌组织表达下调[8]。同时,CBX7表达也与结肠癌患者预后有着密切的关系。现阶段,已确定肝细胞癌癌组织CBX7和PERK表达会出现异常,但有关CBX7和PERK表达对患者治疗后预后的影响尚不确定。本研究观察了肝细胞癌癌组织CBX7和PERK表达及其临床意义,现将结果报道如下。
1 资料与方法
1.1 研究对象 2016年1月~2017年1月我院诊治的肝细胞癌患者68例,男44例,女24例;年龄34~71岁,平均年龄为(56.33±9.14)岁。符合2015年中国抗癌协会肝癌专业委员会发布的《原发性肝癌规范化病理诊断指南》[9]的标准诊断,肿瘤直径≤3cm者30例,肿瘤直径>3 cm者38例;美国癌症联合委员会(AJCC)分期:Ⅰ/Ⅱ期,40例,Ⅲ/Ⅳ期28例。排除标准:(1)肿瘤破裂;(2)存在感染;(3)既往或同时伴有其他原发癌灶;(4)近期有辅助放化疗或TACE治疗者;(5)非肝癌因素导致死亡者。本研究通过医院医学伦理委员批准实施。患者给出知情同意书。
1.2 肝癌分期 应用AJCC[10]临床分期标准,Ⅰ期:孤立的肿瘤无血管浸润;Ⅱ期:孤立的肿瘤浸润血管,或多发肿瘤都不大于5 cm;Ⅲ期:多发肿瘤大于 5 cm,单个或多发肿瘤,不论大小,侵及门静脉的主要属支或肝静脉;Ⅳ期:直接侵及除胆囊外的邻近器官,或穿透腹膜。
1.3 肝组织CBX7和PERK mRNA检测 所有患者均接受肝癌切除术治疗。术后,取癌组织和癌旁肝组织,用剪刀剪碎,加胰蛋白酶消化,提取总 RNA,用BCA 定量试剂盒(货号:20200103,购自凯基生物)测定 RNA 浓度和纯度(Trail购自英国Pepro Tech 公司),反转录合成 cDNA,行PCR扩增,采用2-ΔΔCt法计算RNA相对水平。本实验以GADPH为内参。GADPH:上游引物:5’-CTCAGACACCATGGGGAGGTGA -3’,下游引物:5’-ATGATCTTGAGGCTGTTGTCATA-3’;CBX7:上游引物:5’-CGTCATGGCC TACGAGGA-3’,下游引物为:5’-TGGGTTTCGGACCTCTCTT-3’;PERK:上游引物:5’-GCATCTGCCTGGTTACTTAAG-3’,下游引物:5’-GCATCTGCCTGGTTACTTAAG-3’。
1.4 肝组织CBX7和PERK 蛋白表达检测 采用免疫组化染色法检测CBX7和PERK 蛋白表达(抗CBX7抗体,货号:sc-376274;抗PERK抗体,货号:sc-377400,均购自美国Santa Cruz Biotechnology公司)。在每张切片,选择癌细胞数较多的5个视野,每个视野计数100个细胞,判定蛋白表达阳性率。CBX7表达阳性物为棕黄色,PERK阳性物为棕黄色或深褐色。阴性为浅蓝色或白色。参考杜洪岩等[11]报道的评分标准,染色强度得分:无染色或淡黄色为0分;棕黄色为1分;棕褐色或黑色为2分。阳性细胞百分比得分:无阳性细胞记0分,阳性细胞小于25 %记为1分,阳性细胞数在25%~50% 记为2分,阳性细胞数大于50%记为 3 分。总分为染色强度得分×阳性细胞百分比得分。总分≤2分者,划为低表达组,总分>2分者,划为高表达组。
1.5 随访 在治疗后,采用电话或门诊复诊随访,记录36个月的生存情况。

2 结果
2.1 癌组织和癌旁组织CBX7 mRNA和PERK mRNA水平比较 癌组织CBX7 mRNA水平为(0.51±0.10),显著低于癌旁组织【(4.11±0.91),P<0.05】,而癌组织PERK mRNA水平为(4.87±0.99),显著高于癌旁组织【(0.58±0.15),P<0.05,图1】。
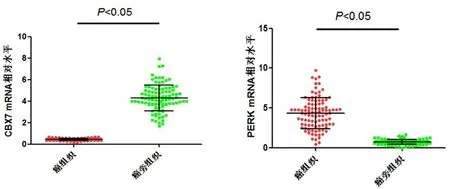
图1 HCC患者癌组织和癌旁组织CBX7 mRNA和PERK mRNA水平比较
2.2 癌组织CBX7和PERK表达情况 经免疫组化检测,在本组68例HCC患者癌组织中,CBX7高表达36例(52.9%),CBX7低表达或阴性32(47.1%)例; 癌组织PERK免疫组化评分>2分者30例(44.1%,高表达),≤2分者38例(55.9%,低表达,图2)。

图2 HCC患者癌组织和癌旁肝组织CBX7和PERK蛋白表达情况 (sABC,400×)1癌组织CBX7蛋白表达阴性;②癌旁组织CBX7蛋白表达阳性;③癌组织PERK蛋白表达阳性;④癌旁组织PERK蛋白表达阴性
2.3 不同临床和病理学特征患者癌组织CBX7和PERK表达比较 不同肿瘤直径和AJCC临床分期患者癌组织CBX7和PERK蛋白表达阳性率存在显著性差异(P<0.05,表1)。

表1 不同临床和病理学特征患者癌组织CBX7和PERK表达阳性率(%)比较
2.4 癌组织CBX7和PERK高表达与低表达患者生存率比较 见表2。

表2 癌组织蛋白高表达与低表达患者累积生存率(n,%)比较
3 讨论
近年来,随着对肝癌研究的深入,发现肝癌细胞与众多蛋白表达和信号通路的表达关系密切,目前研究较多的主要包括:CBX7和PERK等[12,13]。
CBX7是参与调控细胞衰老的转录抑制因子,属于多梳蛋白复合体1中Pc家族的成员。CBX7在不同的癌组织细胞的表达不完全相同[14]。部分学者研究表明在前列腺癌和淋巴瘤组织中CBX7表达增强[15],而另一部分人则研究发现CBX7在甲状腺癌、胰腺癌、结肠癌和胃癌组织中表达降低[16],并将CBX7 定义为一种抑癌基因。本研究检测了肝癌组织和癌旁组织CBX7基因及其蛋白表达情况,发现癌组织CBX7 mRNA水平显著低于癌旁组织。有人也发现肝癌细胞CBX7 表达较癌旁组织低[17]。有研究报道CBX7在肝癌组织表达升高[18],与本研究得出的结论相反,这可能是因为不同肝癌患者体内的肝癌细胞特性不尽相同。不同的肝癌细胞CBX7表达可能存在一定的差异。本研究进一步分析了肝癌组织CBX7表达与术后预后的关系。肝硬化是肝细胞癌发生的原因,也是肝细胞癌患者预后不利的因素[19]。肿瘤数目和肿瘤最大直径与患者预后关系较为密切。同时,本研究也分析了各组患者的预后情况发现,CBX7低表达组患者预后明显较差,这可能是因为CBX7低表达组患者肝癌细胞分化和增殖能力较强,更易于转移和恶性增殖,使得患者生存率降低。
ERK是80年代末期发现的一类丝/苏氨酸蛋白激酶。ERK蛋白具有调控肿瘤增殖和分化的能力。ERK是RAF/MEK/ERK信号通路的上游分子,其活化后为PERK。研究表明,PERK蛋白的表达与肝癌的进展关系较为密切。ERK活化后形成PERK会影响下游的信号通路,调控肿瘤侵袭和转移[20]。研究表明,在肝癌组织中PERK表达要高于正常组织。本研究采用了RT-PCR法检测癌组织和癌旁组织PERK水平情况发现,癌组织PERK mRNA水平显著高于癌旁组织,免疫组织化学染色法检测发现,癌组织中大部分被染色为棕黄色,而癌旁组织基本为淡蓝色,说明癌组织PERK蛋白表达水平显著高于癌旁组织。RAF/MEK/ERK信号通路与肝细胞癌的运动能力相关,而PERK是调节RAF/MEK/ERK信号通路的下游激酶。检测其磷酸化可以有效反映RAF/MEK/ERK信号通路的活化情况。激活的PERK蛋白可调节肝癌细胞的增殖能力和运动能力。本研究发现不同PERK蛋白表达水平患者预后有差异,PERK高表达组预后较差,可能是高表达的PERK蛋白可以激活RAF/MEK/ERK信号通路,使得肝癌细胞的运动能力增强,导致肝癌细胞更易于转移。
