中空纤维液相微萃取-高效液相色谱法测定荆芥及其复方制剂中胡薄荷酮的含量
2021-07-12李萍胡爽白小红毕小平
李萍 胡爽 白小红 毕小平
摘 要 目的:建立荊芥饮片及其复方制剂中胡薄荷酮的含量测定方法。方法:采用中空纤维液相微萃取-高效液相色谱法(HF-LPME-HPLC)。在单因素实验基础上,以胡薄荷酮富集倍数为考察指标,样品相溶液盐(NaCl)浓度、萃取时间、搅拌速度为考察因素,采用中心组合设计-响应面法优化荆芥饮片及其复方制剂(以复方荆芥颗粒为例)的HF-LPME条件,并进行验证。采用HPLC法测定胡薄荷酮的含量,色谱柱为Hypersil C18,流动相为甲醇-0.3%磷酸溶液(梯度洗脱),流速为1.0 mL/min,检测波长为252 nm,柱温为25 ℃,进样量为20 μL。以2020年版《中国药典》(一部)荆芥饮片项下HPLC法为参照,验证本研究所建HF-LPME-HPLC法的可行性。结果:HF-LPME最优条件为以正壬醇为萃取溶剂,在pH为7、NaCl浓度为11%的样品相溶液中,以800 r/min搅拌萃取36 min。HPLC方法学考察结果显示,胡薄荷酮检测质量浓度的线性范围为0.05~5 μg/mL(r=0.999 0);检测限和定量限分别为0.4、1.3 ng/mL;日内、日间精密度的RSD分别为1.8%~4.0%、1.5%~4.1%(n=3);重复性、稳定性(24 h)试验的RSD均小于8%(n=6);荆芥饮片和复方荆芥颗粒中胡薄荷酮的平均回收率分别为102.6%~105.1%、97.2%~102.3%,RSD分别不高于4.1%和6.2%(n=3)。采用药典方法和本研究建立方法测得荆芥饮片中胡薄荷酮的平均含量分别为0.84 mg/g(RSD=4.3%,n=3)和0.87 mg/g(RSD=5.5%,n=3),差异无统计学意义(P>0.05)。结论:建立的HF-LPME-HPLC法实现了对胡薄荷酮的富集与浓缩,具有较强的纯化能力与较高的灵敏度,可用于荆芥饮片及其复方制剂中胡薄荷酮的含量测定。
关键词 中空纤维液相微萃取;高效液相色谱法;中心组合设计-响应面法;胡薄荷酮;荆芥饮片;复方制剂
ABSTRACT OBJECTIVE: To establish the method for the content determination of pulegone in Schizonepetae tenuifolia decoction pieces and its compound preparation. METHODS: Hollow fiber liquid-phase microextraction coupled with HPLC (HF-LPME-HPLC) was adopted. Based on single factor tests, HF-LPME condition of S. tenuifolia decoction pieces and its compound preparation (taking Compound S. tenuifolia granule as an expample) was optimized by central composite design-response surface methodology using pulegone enrichment multiple as index, with the concentration of sample phase solution (NaCl), extraction time and stirring speed as factors. Validation test was conducted. HPLC method was adopted to determine the content of pulegone. The determination was performed on Hypersil C18 column with mobile phase consisted of methanol-0.3% phosphoric acid (gradient elution) at the flow rate of 1.0 mL/min. The detection wavelength was set at 252 nm, the column temperature was 25 ℃. The sample size was 20 μL. The feasibility of HF-LPME-HPLC method established in this study was validated by using HPLC method stated in the item of S. tenuifolia decoction pieces in 2020 edition of Chinese Pharmacopoeia (part Ⅰ) as reference. RESULTS: The optimum HF-LPME conditions included n-nonanol as the extraction solvent, sample phase solution with 11% NaCl and pH value of 7, stirring speed of 800 r/min, extraction time of 36 min. Results of HPLC methodology investigation showed that linear range of pulegone were 0.05-5 μg/mL (r=0.999 0). The limits of detection and quantitation were 0.4 and 1.3 ng/mL, respectively. RSDs of intra-day and inter-day precision were 1.8%-4.0% and 1.5%-4.1% (n=3), respectively. RSDs of reproducibility and stability tests (24 h) were all lower than 8%(n=6). Average recoveries of S. tenuifolia decoction pieces and Compound S. tenuifolia granule were 102.6%-105.1% and 97.2%-102.3%, respectively; RSDs were not higher than 4.1% and 6.2% (n=3). The average contents of pulegone in S. tenuifolia decoction pieces determined by pharmacopoeia method and established method were 0.84 mg/g (RSD=4.3%, n=3) and 0.87 mg/g (RSD=5.5%, n=3), respectively, with no significant difference (P>0.05). CONCLUSIONS: The established HF-LPME-HPLC method can enrich and concentrate pulegone, shows strong purification ability and high sensitivity, and can be used to determine the contents of pulegone in S. tenuifolia decoction pieces and its compound preparation.
KEYWORDS Hollow fiber liquid-phase microextraction; HPLC; Central composite design-response surface methodology; Pulegone; Schizonepetae tenuifolia decoction piece; Compound pregaration
荆芥为唇形科植物荆芥Schizonepeta tenuifolia Briq.的干燥地上部分,性微温、味辛[1]。现代药理研究表明,荆芥主要具有抗病毒、抗炎、镇痛、抗肿瘤、调节免疫、抗菌、止血等作用,且常被加入到具有清热解毒功效的中药复方制剂中[2]。荆芥的主要有效成分为胡薄荷酮,其可降低白细胞介素1β(IL-1β)、肿瘤坏死因子α(TNF-α)、γ干扰素(IFN-γ)等炎性细胞因子水平,具有较强的抗炎作用[3-4]。目前,胡薄荷酮常用的定量分析方法为高效液相色谱法(HPLC)和气相色谱法[5-6]。对于荆芥饮片及成分更为复杂的复方制剂而言,测定其中胡薄荷酮的含量时,需先进行样品的前处理,而采用传统的液液萃取法进行前处理存在有机溶剂用量大、提取耗时长、操作繁琐、对仪器灵敏度要求相对较高等不足[6-7]。因此,建立一种操作简便、纯化与富集能力强的样品前处理方法是很有必要的。
近年来,中空纤维液相微萃取(HF-LPME)技术因适用于复杂样品的萃取、浓缩、纯化而得以广泛应用[8-9]。中空纤维是一种中空、多孔的高分子材料,无毒且具有很好的生物相容性,其微米级壁孔可使小分子化合物自由通过。中空纤维不仅可以作为保护萃取相的载体和纯化样品的过滤器,克服单滴液相微萃取液滴不稳定、分散液相微萃取纯化效果差和重现性差等缺点,而且还有助于分析物的富集[10-13]。目前,尚未有研究采用HF-LPME技术结合HPLC法对荆芥饮片及其复方制剂中胡薄荷酮进行分离、富集和定量分析。鉴于此,本研究以荆芥饮片和本实验室自制的复方荆芥颗粒为检测样品,在单因素实验的基础上,结合中心组合设计-响应面法优化胡薄荷酮的HF-LPME条件,并建立含量测定的HPLC方法,以期为荆芥饮片及其复方制剂的分析提供一种纯化能力强、操作简便的样品前处理方法和灵敏度高的含量测定方法。
1 材料
1.1 主要仪器
1200 Series型HPLC仪购自美国Agilent公司;SHB-Ⅲ型循环水式多用真空泵购自郑州长城科工贸有限公司;KQ-50DE型超声波清洗机购自宁波新芝生物科技股份有限公司;XS205DU型電子天平购自瑞士Mettler Toledo公司;HJ-6B型数显多头磁力恒温搅拌器购自金坛市白塔金昌实验仪器厂。
1.2 主要药品与试剂
荆芥饮片(批号分别为20170524、20180721、20190521)购自运城市神农中药材有限公司,经山西医科大学白云娥教授鉴定为唇形科植物荆芥S. tenuifolia Briq.的干燥地上部分;胡薄荷酮对照品(批号Z05J9H63054,纯度≥95%)购自上海源叶生物科技有限公司;复方荆芥颗粒(批号分别为20200908、20200909、20200910,规格为每袋10 g)由山西医科大学药学院实验室自制;聚偏氟乙烯中空纤维(内径0.5 mm,孔径0.2 μm)购自天津膜天膜科技股份有限公司;甲醇为色谱纯,其余试剂均为分析纯或实验室常用规格,水为蒸馏水。
2 方法与结果
2.1 溶液的制备
2.1.1 对照品溶液 称取胡薄荷酮对照品适量,置于10 mL量瓶中,用甲醇溶解并稀释至刻度,制得质量浓度为1.12 mg/mL的对照品贮备液,4 ℃下保存,备用。临用时,按照实验所需用甲醇稀释成相应质量浓度的对照品溶液。
2.1.2 供试品溶液 取荆芥饮片粉末(过二号筛)约0.5 g,精密称定,置于具塞锥形瓶中,加甲醇10 mL,超声(功率为400 W)处理20 min,然后以8 000 r/min离心10 min,取上清液。沉淀物再加甲醇10 mL,同法超声处理并离心1次。合并2次上清液并转移至25 mL量瓶中,加甲醇定容,摇匀,即得供试品溶液①。精密称定复方荆芥颗粒5.0 g,研磨后,置于具塞锥形瓶中,其余与荆芥饮片同法操作,即得供试品溶液②。
2.1.3 基质溶液 按处方比例称取复方荆芥颗粒的辅料(糊精和糖粉),同“2.1.2”项下“供试品溶液②”方法操作,即得基质溶液。
2.2 色谱条件
色谱柱为Hypersil C18(250 mm×4.6 mm,5 μm);流动相为甲醇(A)-0.3%磷酸溶液(B),梯度洗脱(0~8 min,60%A→65%A,8~18 min,65%A→70%A,18~19 min,70%A→60%A);流速为1.0 mL/min;检测波长为252 nm;柱温为25 ℃;进样量为20 μL。
2.3 HF-LPME样品前处理方法
先将中空纤维剪成长约7 cm的小段,依次用丙酮、甲醇、水超声(功率为400 W)清洗10 min,去除纤维表面及管腔内的杂质后,于室温下自然晾干,备用。
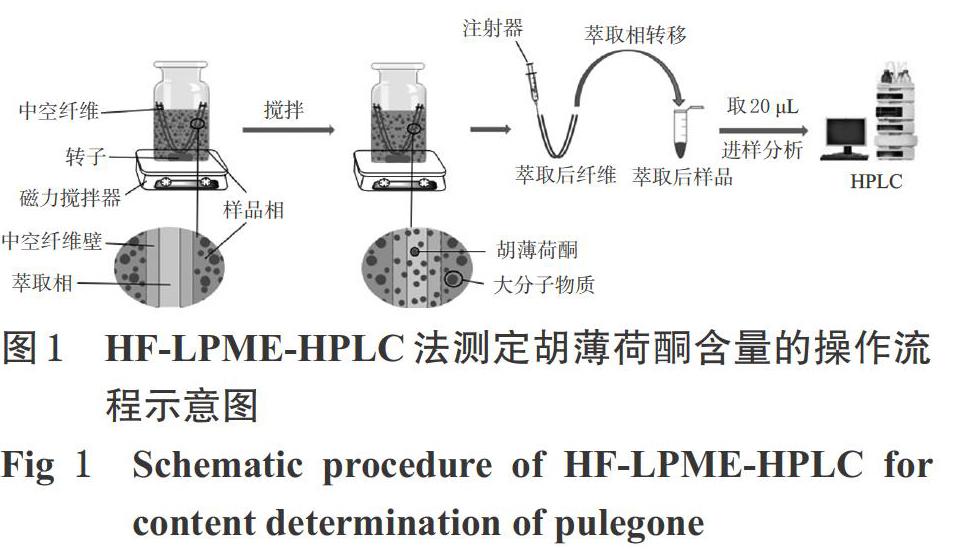
按照各项实验要求取规定质量浓度的对照品溶液或供试品溶液70 μL,以一定浓度的盐溶液稀释至7 mL,得到一定pH的样品相溶液。把处理好的中空纤维浸泡于萃取剂中,至纤维壁孔充满萃取剂后,取出,擦去纤维外表面多余的萃取剂,并用萃取剂将管腔注满,两端封口,弯成“U”型,然后浸入上述样品相溶液中,于室温下以一定转速搅拌萃取一定时间。萃取结束后,将纤维管内的萃取剂转移到EP管中,用甲醇40 μL冲洗纤维内壁,将冲洗液与EP管中的萃取剂合并,涡旋30 s,混匀后,按“2.2”项下色谱条件进样分析。HF-LPME-HPLC法测定胡薄荷酮含量的操作流程示意图见图1。
2.4 单因素实验优化HF-LPME萃取条件
本研究以胡薄荷酮的富集倍数(EF,评价萃取方法对分析物富集能力的参数)为评价指标,对影响HF-LPME的各条件(萃取剂、样品相溶液pH、盐种类及浓度、萃取时间、搅拌速度)进行单因素考察[14]。EF计算公式为:EF=C1/C0。式中,C1指当萃取达到平衡时萃取剂中胡薄荷酮的质量浓度,C0指胡薄荷酮在样品相溶液中的初始质量浓度[15];胡薄荷酮质量浓度根据“2.6.2”项下建立的回归方程计算。
2.4.1 萃取剂的筛选 固定胡薄荷酮初始质量浓度为0.5 ?g/mL、NaCl溶液浓度为10%、样品相溶液pH为7、转速为800 r/min、萃取时间为30 min,其余按“2.3”项下方法操作,分别考察不同萃取剂(正己醇、正庚醇、正辛醇、正壬醇、正癸醇)对胡薄荷酮EF的影响。结果显示,以正壬醇为萃取剂时所得EF较大,故本研究选择正壬醇作为萃取剂,详见图2。
2.4.2 盐种类和盐浓度的考察 固定胡薄荷酮初始质量浓度为0.5 ?g/mL、盐浓度为10%、样品相溶液pH为7、萃取剂为正壬醇、转速为800 r/min、萃取时间为30 min,其余按“2.3”项下方法操作,分别考察不同盐种类(NaCl、KCl、CaCl2、BaCl2、Na2SO4)对胡薄荷酮EF的影响。结果显示,当样品相溶液中加入NaCl溶液时,盐析效应较强,EF最大。在此基础上,固定其他条件不变,进一步考察NaCl不同浓度(0、5%、10%、15%、20%)对EF的影响。结果显示,随着NaCl浓度的增加,EF呈现出先升高后降低的趋势;当NaCl浓度为10%时,EF最大,故本研究选择NaCl浓度10%為中间值进行进一步优化,详见图3。
2.4.3 样品相pH的考察 固定胡薄荷酮初始质量浓度为0.5 ?g/mL、NaCl浓度为10%、萃取剂为正壬醇、转速为800 r/min、萃取时间为30 min,其余按“2.3”项下方法操作,分别考察不同pH(5、6、7、8、9)样品相溶液对胡薄荷酮EF的影响。结果显示,随着样品相溶液pH的升高,EF呈现出先升高后降低的趋势;当pH为7时,EF最大,故本研究确定样品相溶液的pH为7,详见图4。
2.4.4 萃取时间的考察 固定胡薄荷酮初始质量浓度为0.5 ?g/mL、NaCl浓度为10%、样品相溶液pH为7、萃取剂为正壬醇、转速为800 r/min,其余按“2.3”项下方法操作,分别考察不同萃取时间(10、20、30、40、50、60 min)对胡薄荷酮EF的影响。结果显示,随着萃取时间的延长,EF呈现出先升高后降低的趋势;当萃取时间为30 min时,EF最大,故本研究选择萃取时间30 min为中间值进行进一步优化,详见图5。
2.4.5 搅拌速度的考察 固定胡薄荷酮初始质量浓度为0.5 ?g/mL、NaCl浓度为10%、样品相溶液pH为7、萃取剂为正壬醇、萃取时间为30 min,其余按“2.3”项下方法操作,分别考察不同搅拌速度(500、700、850、1 000、1 300、1 600 r/min)对胡薄荷酮EF的影响。结果显示,随着搅拌速度的增大,EF呈现出先升高后降低的趋势;当搅拌速度为850 r/min时,EF最大,故本研究选择搅拌速度850 r/min为中间值进行进一步优化,详见图6。
2.5 中心组合设计-响应面法优化HF-LPME萃取条件
2.5.1 实验设计 在单因素实验基础上,以EF为响应指标,选择对EF影响较大的连续性因素[盐(NaCl)浓度(A)、萃取时间(B)、搅拌速度(C)]进行中心组合设计-响应面优化实验,每组实验均重复3次。具体的因素与水平表见表1,实验安排及结果见表2。
2.5.2 模型建立与方程拟合 采用Design-Expert V 8.0.6软件对表2中数据进行多元拟合分析,得到二次多元回归模型的方程式为EF=89.45+1.63A+6.15B+0.31C+0.20AB-0.56AC-4.00BC-4.89A2-7.32B2-2.85C2(R 2=0.996 9,P<0.000 1)。计算得模型EF失拟项的平方和为0.93(P=0.822 3>0.05),说明模型失拟项不显著,拟合度良好,可用于分析和预测胡薄荷酮的含量变化。具体的方差分析结果见表3。
由表3可知,此模型的F为612.48(P<0.000 1),表明模型具有显著性。同时,一次项A、B,二次项A 2、B 2、C 2以及交互项BC对实验结果有极显著影响(P<0.000 1),交互项AC对实验结果有显著影响(P<0.05),表明所选取的3个因素对胡薄荷酮EF的影响较大。
2.5.3 响应面分析 采用Design-Expert V 8.0.6软件绘制各因素两两交互的响应面图和等高线图,通过响应面曲线的变化情况和等高线的稀疏程度以直观反映出各因素对EF的影响,结果见图7。
由图7可知,EF与盐浓度(A)、萃取时间(B)、搅拌速度(C)的关系密切。各响应面图均为开口向下的凸形曲面,所以随着盐浓度、萃取时间、搅拌速度的增加,EF均呈现出先升高后降低的趋势,因此在较优的盐浓度、萃取时间与搅拌速度下,EF有极大值,且应位于响应曲面的顶部。
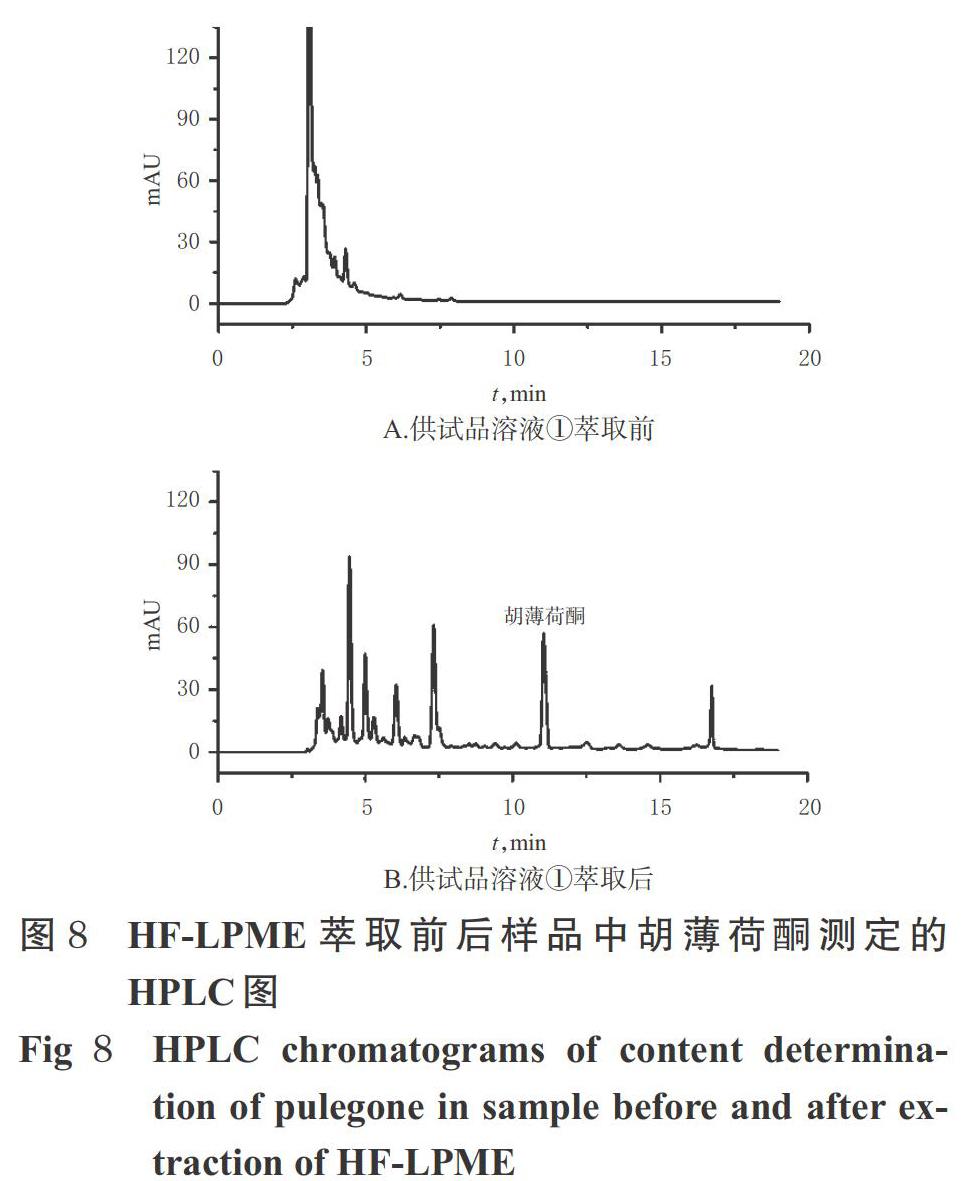
2.5.4 响应面优化及验证实验 通过Design-Expert V 8.0.6软件拟合分析,得到最优实验条件为萃取时间35.9 min、盐浓度11.13%、搅拌速度793.86 r/min。考虑到实际操作的可控性,最终确定最优条件为萃取时间36 min、盐浓度11%、搅拌速度800 r/min,并在此条件下平行进行6次验证实验。结果显示,6次平行验证实验的EF分别为88.5、93.0、88.4、92.2、90.6、91.1(RSD=2.1%,n=6),与模型预测值(91.1)比较,偏差的绝对值低于2.9%,说明该模型拟合结果准确、可靠。同时,分别取萃取前后的供试品溶液①(批号20170524),分别按“2.2”项下色谱条件进样分析,记录色谱图。结果显示,经HF-LPME处理后的样品再经HPLC分析可表现出明显的浓集和纯化效果,而仅采用HPLC法则无此优势。HF-LPME萃取前后样品中胡薄荷酮测定的HPLC图见图8。
2.6 胡薄荷酮含量测定方法的建立及应用
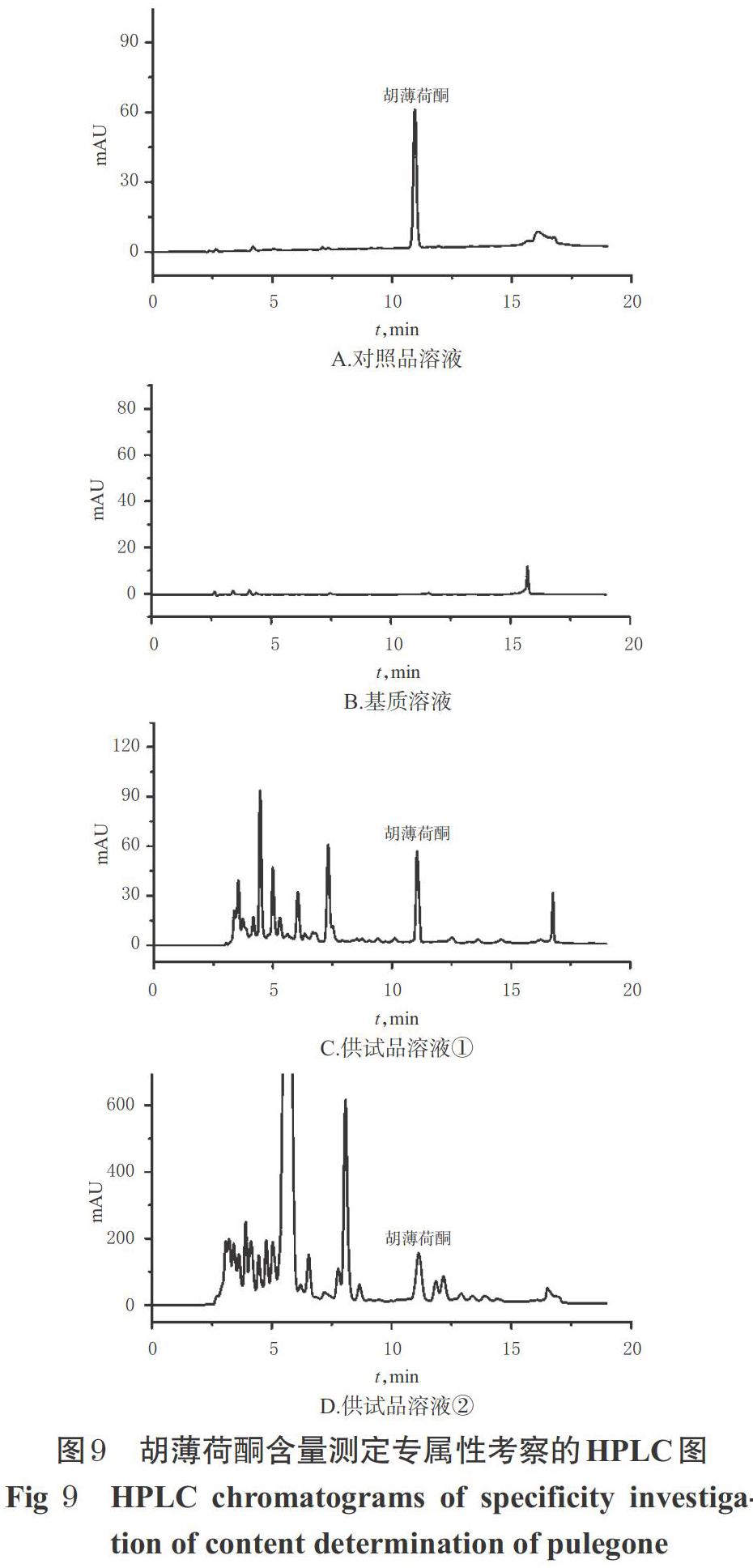
2.6.1 专属性试验 分别取对照品溶液(30 μg/mL)、基质溶液、供试品溶液①(批号20170524)、供试品溶液②(批号20200908)适量,根据“2.5.4”项下最优萃取条件,按“2.3”项下步骤操作并进样分析,记录色谱图。结果显示,在胡薄荷酮的保留时间处,基质对其测定无干扰;且供试品溶液①与供试品溶液②中胡薄荷酮的色谱峰与相邻色谱峰间的分离度均大于1.5,表明该方法的专属性较好,详见图9。
2.6.2 线性关系考察 精密量取“2.1.1”项下的胡薄荷酮对照品贮备液适量,用甲醇稀释成质量浓度分别为5、9、30、50、70、90、300、500 μg/mL的系列对照品溶液,根据“2.5.4”项下最优萃取条件,分别按 “2.3”项下步骤操作并进样分析,记录峰面积。以样品相溶液中胡薄荷酮质量浓度为横坐标(x,μg/mL)、峰面积为纵坐标(y)进行线性回归,得回归方程为y=2 034.3x+32.3(r=0.999 0)。结果表明,胡薄荷酮在质量浓度0.05~5 μg/mL范围内与其峰面积呈良好的线性关系。
2.6.3 检测限和定量限考察 精密量取“2.6.2”项下对照品溶液(5 μg/mL)适量,用甲醇进行倍比稀释,根据“2.5.4”项下最优萃取条件,按 “2.3”项下步骤操作并进样分析,记录峰面积。结果显示,以信噪比为3 ∶ 1得到的检测限为0.4 ng/mL,以信噪比为10 ∶ 1得到的定量限为1.3 ng/mL。
2.6.4 精密度试验 精密量取“2.6.2”项下质量浓度为9、50、300 μg/mL的对照品溶液各70 ?L,根据“2.5.4”项下最优萃取条件,分别按“2.3”项下步骤操作并进样分析,记录峰面积。通过每天检测3次、连续检测3天,分别得到日内、日间精密度的RSD分別为1.8%~4.0%、1.5%~4.1%(n=3)。结果表明,该方法精密度良好。
2.6.5 稳定性试验 分别按“2.1.2”项下方法制备一批供试品溶液①(批号20170524)和供试品溶液②(批号20200908),于室温下放置0、2、4、8、12、24 h时,根据“2.5.4”项下最优萃取条件,分别按“2.3”项下步骤操作并分析测定,记录色谱图。结果显示,供试品溶液①和供试品溶液②中胡薄荷酮峰面积的RSD分别为4.6%、7.2%(n=6),表明两种供试品溶液在室温下放置24 h内稳定性良好。
2.6.6 重复性试验 称取荆芥饮片(批号20170524)和复方荆芥颗粒(批号20200908)适量,按“2.1.2”项下方法制备供试品溶液①和供试品溶液②,每个样品均制备6份,根据“2.5.4”项下最优萃取条件,分别按“2.3”项下步骤操作并进样分析,记录峰面积并代入回归方程计算胡薄荷酮含量。结果显示,供试品溶液①和供试品溶液②中胡薄荷酮含量的RSD分别为3.7%、5.8%(n=6),表明该方法的重复性较好。
2.6.7 加样回收率试验 分别精密量取已知含量的供试品溶液①(批号20170524)和供试品溶液②(批号20200908)各35 ?L,按已知成分含量的50%、100%、150%加入相应质量浓度的胡薄荷酮对照品溶液,每个质量浓度平行3份。根据“2.5.4”项下最优萃取条件,分别按“2.3”项下步骤操作并进样分析,记录峰面积,并计算加样回收率。结果显示,荆芥饮片低、中、高质量浓度供试品溶液中胡薄荷酮的平均加样回收率分别为105.1%、102.6%、102.7%,RSD≤4.1%(n=3);复方荆芥颗粒低、中、高质量浓度供试品溶液中胡薄荷酮的平均加样回收率分别为97.2%、98.6%、102.3%,RSD≤6.2%(n=3),说明该方法准确度较好,详见表4。
2.6.8 样品含量测定 精密称取3批荆芥饮片和复方荆芥颗粒适量,分别按 “2.1.2”项下方法制备3批供试品溶液①和供试品溶液②,根据“2.5.4”项下最优萃取条件,按“2.3”项下步骤操作并进样分析,记录峰面积并代入回归方程计算出各样品中胡薄荷酮含量。结果显示,3批荆芥饮片和复方荆芥颗粒中胡薄荷酮的平均含量分别为0.87、0.063 mg/g,RSD分别为5.5%、8.0%(n=3)。
2.7 方法可行性评价
为进一步验证方法的可行性,笔者分别采用2020年版《中国药典》(一部)(后文简称“药典”)荆芥项下的HPLC法和本研究建立的HF-LPME-HPLC法对荆芥饮片(批号20170524)中胡薄荷酮的含量进行测定[1]。结果显示,采用药典方法和本研究建立方法测得荆芥饮片中胡薄荷酮的平均含量分别为0.84 mg/g(RSD=4.3%,n=3)和0.87 mg/g(RSD=5.5%,n=3)。采用SPSS 20.0软件经t检验分析可知,两种方法测定结果在95%置信区间内差异无统计学意义(P=0.374>0.05),表明本研究建立的方法可行,测定结果可靠。
3 讨论
本研究建立了基于HF-LPME-HPLC的胡薄荷酮含量测定方法,实现了对荆芥饮片及其复方制剂中胡薄荷酮的浓集与纯化。HF-LPME的作用机制为:聚偏氟乙烯中空纤维结构中的多个氟原子具有强电负性,易于形成偶极大分子;胡薄荷酮结构中因羰基氧的电负性较强,故而羰基碳带有部分正电性,易形成偶极分子。因此,两个分子可通过偶极-偶极静电作用形成过渡状态的复合物;抑或通过氟原子的富电子性,与胡薄荷酮结构中的羰基和双键共轭结构缺电子的部分形成电荷转移超分子,从而使样品相中的胡薄荷酮富集于中空纤维表面,最终实现浓集[16]。此外,中空纤维的壁孔(0.2 μm)起到了良好的滤过与纯化作用,使得经该方法萃取后的溶液可直接进行HPLC分析,无需再进行滤过操作。
HF-LPME方法浓缩与富集的过程是将目标分析物从样品相溶液迁移到纤维壁孔内的萃取剂中,然后再转移到纤维腔内的接受相中[15]。萃取剂是影响萃取结果的关键因素,本研究发现胡薄荷酮可较好地溶解于正壬醇中,且正壬醇与纤维有良好的亲和力且不溶于水,加之黏度适当,从而避免了萃取过程中试剂的扩散和挥发[17]。同时,在单因素实验基础上,本研究采用中心组合设计-响应面法对萃取条件进行了进一步优化。结果显示,萃取时间是影响萃取的重要因素,当萃取时间为36 min时,样品相溶液与萃取相达到分配平衡;适当的盐种类和盐浓度(NaCl浓度为11%)可以降低胡薄荷酮在水相中的溶解度,促进其进入有机相,进而被较好地萃取;在萃取过程中采用800 r/min的速度进行搅拌,可缩短分配平衡时间、提高萃取效率[18]。笔者将本研究建立的HF-LPME-HPLC法与药典荆芥项下HPLC法进行对比发现,该方法测得结果与药典方法测定结果无显著差异,表明本研究建立方法的可信性较好。此外,经相关文献对比,本研究建立方法的定量限仅为其他文献报道的1/100~1/10[5-6,19-20],具有较高的灵敏度。
综上所述,本研究建立的HF-LPME-HPLC法实现了荆芥饮片及其复方制剂中胡薄荷酮的纯化、浓集与含量测定,具有纯化能力强、灵敏度高等优势,可为建立更为便捷、高效的胡薄荷酮样品前处理及含量测定方法以及后续体内代谢研究奠定基础。然而,该方法目前仅用于两种样品中胡薄荷酮的分析与测定,而关于该法在其他复杂样品中的广泛适用性还有待进一步研究。
参考文献
[ 1 ] 国家药典委员会.中华人民共和国药典:一部[S]. 2020年版.北京:中国医药科技出版社,2020:243-244.
[ 2 ] 刘英男,牛凤菊,辛义周,等.荆芥的化学成分、药理作用及临床应用研究进展[J].中国药房,2020,31(11):1397- 1402.
[ 3 ] CHOI Y Y,KIM M H,LEE H,et al. (R)-(+)-pulegone suppresses allergic and inflammation responses on 2,4-dinitrochlorobenzene-induced atopic dermatitis in mice model[J]. J Derma Tol Sci,2018,91(6):292-300.
[ 4 ] YANG Q X,LUO J,LV H J,et al. Pulegone inhibits inflammation via suppression of NLRP3 inflammasome and reducing cytokine production in mice[J]. Immunopharmacol Immunotoxicol,2019,41(3):420-427.
[ 5 ] 杨明慧,黄晓巍,辛国,等.荆芥汤中荆芥最佳煎煮时间的实验研究[J].中国医院药学杂志,2019,39(4):344-347,352.
[ 6 ] 霍丽霞,鲁寅生,郭青,等. GC法测定银翘解毒系列制剂中薄荷脑、薄荷酮和胡薄荷酮[J].药物评价研究,2015,38(1):66-70.
[ 7 ] 梁欣雨,周晓钢,何兵,等.一测多评法同时测定小儿金翘颗粒中7种成分的含量[J].中国药房,2020,31(10):1179-1184.
[ 8 ] 宝贵荣,孟和,李优鑫,等.中空纤维膜液相微萃取-超高效液相色谱测定蒙药毛勒日-达布斯-4汤中两种生物碱[J].色谱,2019,37(6):644-648.
[ 9 ] 钟佳胜,蒙碧珍,陈振阳,等.中空纤维膜液相微萃取/高效液相色谱法测定水样中4种头孢菌素的含量[J].分析测试学报,2019,38(12):1493-1497.
[10] HU S,CHEN X,WANG R Q,et al. Natural product applications of liquid-phase microextraction[J]. Trend Anal Chem,2019,113(11):340-350.
[11] YADOLLAH Y,MARYAM R,SHAHRAM S. Liquid- phase microextraction-the different principles and configurations[J]. Trend Anal Chem,2019,112(6):264-272.
[12] MENG L,ZHANG W W,MENG P J,et al. Comparison of hollow fiber liquid-phase microextraction and ultrasound-assisted low-density solvent dispersive liquid-li- quid microextraction for the determination of drugs of abuse in biological samples by gas chromatography-mass spectrometry[J]. J Chromatogr B,2015,989(2):46-53.
[13] XIONG J,HU B. Comparison of hollow fiber liquid phase microextraction and dispersive liquid-liquid microextraction for the determination of organosulfur pesticides in environmental and beverage samples by gas chromatography with flame photometric detection[J]. J Chromatogr A,2008,1193(3):7-18.
[14] 胡明珠,連显会,刘晗,等.中空纤维液相微萃取-超高效液相色谱-串联质谱法测定儿童玩具中6种致敏香豆素类化合物[J].色谱,2017,35(11):1145-1151.
[15] HU S,ZHANG S M,WANG C L,et al. Reverse micelle hollow fiber liquid-phase microextraction coupled with HPLC for the determination of Q-markers of anthraquinones in Rhubarb and their plasma protein binding rates[J]. Chromatographia,2020,83(6):757-766.
[16] 王晓园,陈璇,白小红.液相微萃取/后萃取技术在中药苯丙酸类化合物分析中的应用[J].分析化学,2009,37(1):35-40.
[17] GHAMBARIAN M,YAMINI Y,ESRAFILI A.Three- phase hollow fiber liquid-phase microextraction based on two immiscible organic solvents for determination of tra- madol in urine and plasma samples[J]. J Pharmaceut Biomed,2011,56(5):1041-1045.
[18] ZHOU J,ZENG P,CHENG Z H,et al. Application of hollow fiber liquid phase microextraction coupled with high-performance liquid chromatography for the study of the osthole pharmacokinetics in cerebral ischemia hypoperfusion rat plasma[J]. J Chromatogr B,2011,879(23):2304-2310.
[19] 徐放,李明珠,孫阳,等.齿痛消炎灵颗粒HPLC特征指纹图谱研究及多成分定量测定[J].中草药,2017,48(18):3748-3753.
[20] ALSHISHANI A A,SAAD B,SEMAIL N F,et al. Sal- ting-out assisted liquid-liquid extraction method coupled to gas chromatography for the simultaneous determination of thujones and pulegone in beverages[J]. Int J Food Prop,2018,20(S3):S2776-S2785.
(收稿日期:2021-01-24 修回日期:2021-05-18)
(编辑:林 静)
