蒙药扫日劳-4味汤对特发性肺纤维化模型大鼠的改善作用及机制初探
2021-07-12白万富刘玉键李想王朋常虹郝海梅白迎春刘全礼石松利
白万富 刘玉键 李想 王朋 常虹 郝海梅 白迎春 刘全礼 石松利


摘 要 目的:初步探討蒙药扫日劳-4味汤对特发性肺纤维化模型大鼠的改善作用及机制。方法:将雄性SD大鼠随机分为正常对照组、模型组、阳性对照组(吡非尼酮,0.163 g/kg)和扫日劳-4味汤低、中、高剂量组(0.899、1.798、3.596 g/kg),每组8只。除正常对照组外,其余各组大鼠均按5 mg/kg于气管内缓慢注射6 mg/mL博来霉素1次以复制特发性肺纤维化模型。从建模后的第1天起,正常对照组和模型组大鼠灌胃生理盐水,其余各组大鼠灌胃相应药液,每天1次,给药体积均为10 mL/kg,连续给药4周。实验期间,观察各组大鼠的一般情况并称定其体质量。末次给药24 h后,观察各组大鼠肺的外观形态,采用苏木精-伊红和Masson染色观察肺组织形态学特征,采用酶联免疫吸附法测定其血清中超氧化物歧化酶(SOD)活性和丙二醛(MDA)含量,肺组织中羟脯氨酸(HYP)、白细胞介素1β(IL-1β)、IL-6、透明质酸酶(HA)、层粘连蛋白(LN)、Ⅲ型前胶原(PC-Ⅲ)、Ⅳ型胶原(Col-Ⅳ)含量,采用实时荧光定量聚合酶链式反应技术测定其肺组织中转化生成因子β1(TGF-β1)、Smad3、Smad7 mRNA的表达水平。结果:与模型组比较,扫日劳-4味汤各剂量组和阳性对照组大鼠活动、毛发、饮食等均有明显改善,末次给药后的体质量均显著升高,肺组织病理改变和肺纤维化特征均明显改善,血清中SOD活性显著升高,血清中MDA含量(扫日劳-4味汤中剂量组除外)和肺组织中HYP(扫日劳-4味汤高剂量组除外)、IL-1β、IL-6、HA、LN、PC-Ⅲ、Col-Ⅳ(扫日劳-4味汤高剂量组除外)含量以及TGF-β1、Smad3 mRNA的表达水平均显著降低,Smad7 mRNA的表达水平均显著升高(P<0.05或P<0.01)。结论:扫日劳-4味汤可以显著改善特发性肺纤维化模型大鼠肺部病理改变,延缓并逆转肺纤维化进展,其机制可能与抑制炎症反应,改善脂质过氧化,下调TGF-β1、Smad3 mRNA表达,上调Smad7 mRNA表达有关。
关键词 特发性肺纤维化;蒙药;扫日劳-4味汤;炎症因子;氧化应激;转化生长因子β1/Smad信号通路;大鼠
ABSTRACT OBJECTIVE: To preliminarily investigate the improvement effects and mechanism of Mongolian medicine Saorilao-4 decoction on specific pulmonary fibrosis model rats. METHODS: Male SD rats were randomly divided into normal control group, model group, positive control group (pirfenidone, 0.163 g/kg) and Saorilao-4 decoction low, medium and high dose groups (0.899, 1.798, 3.596 g/kg), 8 rats in each group. Except for normal control group, other groups were given 6 mg/mL bleomycin intratracheally at 5 mg/kg once to induce the specific pulmonary fibrosis model. From the first day after modeling, normal control group and model group were given normal saline intragastrically, other groups were given corresponding drugs intragastrically, once a day, 10 mL/kg, for 4 weeks. During the experimental period, the general condition of the rats in each group was observed and the body mass was weighed. Twenty-four h after last medication, the appearance morphology of rat lung in each group were observed. The morphological characteristics of lung tissues were observed by HE and Masson staining. ELISA was adopted to determine the activity of SOD and the content of MDA in serum, the contents of hydroxyproline (HYP), IL-1β, IL-6, hyaluronidase (HA), laminin (LN), precollagen type Ⅲ (PC-Ⅲ) and collagen type Ⅳ (Col-Ⅳ) in lung tissue. RT-PCR was used to determine the mRNA expression of TGF-β1, Smad3 and Smad7 in lung tissue. RESULTS: Compared with model group, the activity, hair and diet of the rats in each dose group of Saorilao-4 decoction and positive control group were significantly improved, and the body mass after the last administration was significantly increased; the pathological change of lung and pulmonary fibrosis were significantly improved, and the activity of SOD in serum was increased significantly. Serum content of MDA (except for Saorilao-4 decoction medium dose group), the contents of HYP (except for Saorilao-4 decoction high dose group), IL-1β, IL-6, HA, LN, PC-Ⅲ, Col-Ⅳ (except for Saorilao-4 decoction high dose group) as well as mRNA expression of TGF-β1 and Smad3 in lung tissue were significantly decreased; mRNA expression of Smad7 was significantly increased (P<0.05 or P<0.01). CONCLUSIONS: Saorilao-4 decoction can significantly improve the lung pathological changes, delay and reverse the progression of pulmonary fibrosis in specific pulmonary fibrosis model rats, the mechanism of which may be related to the inhibition of inflammatory response, improvement of lipid peroxidation, down-regulation of TGF-β1 and Smad3 mRNA expression, and up-regulation of Smad7 mRNA expression.
KEYWORDS Specific pulmonary fibrosis; Mongolian medicine; Saorilao-4 decoction; Inflammatory factors; Oxidative stress;TGF-β1/Smad signaling pathway; Rats
特发性肺纤维化是一组病因不明且以肺间质弥散性渗出、浸润和纤维化为主要病变的疾病,医学上将其归属为肺间质疾病,主要症状为进行性呼吸困难、气短、干咳、喘憋,最终可导致患者呼吸衰竭,甚至造成死亡,病死率达50%~70%,是许多肺部疾病发展、演变、疤痕化的最终结局[1-2]。已有研究表明,肺纤维化患者预后很差,大部分被确诊的特发性肺纤维化患者的平均生存期仅有3~5年,5年生存率仅为20%[3-4]。但目前,临床治疗肺纤维化的方法和药物十分有限,故研究与开发治疗肺纤维化的有效药物就显得尤为重要。
蒙药扫日劳-4味汤出自《医法海鉴》,别名有四味沙参汤、查干扫日老-4汤等,是由北沙参(别名查干-扫日劳、查干苏如老)、甘草、拳参、紫草茸等药材经混合、研磨制成的汤剂[5]。该方具有清热、止咳作用,主治肺热、气喘、咳嗽、痰成黄色或带血、血热引起的肺部作痛、感冒等症[6]。扫日劳-4味汤方中,以味甘苦、性凉柔而有清肺热、止咳作用的北沙参为主,以清血热及肺热的紫草茸为辅,佐以甘草以止咳祛痰,拳参以清肺热、解毒,故本方为治疗肺热病及各种热型咳嗽的常用方[7]。
据文献报道,转化生长因子β1(TGF-β1)/Smad信号通路参与了特发性肺纤维化的发生发展。TGF-β1在纤维化的肺组织中表达增加,并能影响细胞外基质沉积[8]。Smad蛋白家族是TGF-β1的下游底物分子[9]。在纤维化发展过程中,胶原蛋白沉积需依赖于Smad3,故Smad3被认为是各种促纤维化信号的最终整合因子[9]。Smad7可调节肺损伤修复过程中TGF-β1的异常表达,从而抑制肺纤维化进程[10]。本课题组前期对多种治疗呼吸系统疾病的蒙药现用方剂进行筛选后发现,扫日劳-4味汤具有抑制肺纤维化的作用。在此基础上,本文拟利用特发性肺纤维化大鼠模型,探讨扫日劳-4味汤对模型大鼠肺纤维化、炎症因子、抗氧化相关指标的影响,并结合肺组织形态学特征和分子生物学方法,研究该方抗特发性肺纤维化的药效学特征及对相关基因表达的影响,以期为深入研究扫日劳-4味汤对特发性肺纤维化的改善作用及其具体机制提供参考。
1 材料
1.1 主要仪器
本文所用主要仪器包括7500型荧光定量聚合酶链式反应(PCR)仪(美国AB公司)、Vlultifuge X1R型台式高速冷冻离心机和Nanodrop2000型微量分光光度仪(美国Thermo Fisher Scientific公司)、CX31型光学显微镜和AU640型全自动生化分析仪(日本Olympus公司)、BSA124S-CW型电子天平(德国Sartorius公司)、K4896-B型快速混匀器(姜堰市新康医疗器械有限公司)、DZW-型水浴锅(北京市永光明医疗仪器厂)、TGL-16M型冷冻离心机(湖南湘仪实验室仪器开发有限公司)、Multiskan GO型酶标仪[赛默飞世尔科技(中国)有限责任公司]、TDZ4-WS型低速自动平衡离心机(长沙湘仪离心机仪器有限公司)、MS-700型研磨机(宁波美善美心电器有限公司)等。
1.2 主要药品与试剂
扫日劳-4味汤(批号20200414,规格每袋3 g,北沙参-甘草-拳参-紫草茸的质量比5 ∶ 3 ∶ 3 ∶ 3)购自内蒙古国际蒙医医院国家蒙药制剂中心;吡非尼酮胶囊(阳性药物,批号20200711,规格100 mg)购自北京康蒂尼药业有限公司;注射用博来霉素(批号SL30191404,规格100 mg/mL)购自北京酷来搏科技有限公司;苏木精-伊红(HE)染色试剂盒(批号20191231)购自北京百奥莱博科技有限公司;Masson染液(批号20191025)、超氧化物歧化酶(SOD)试剂盒(批号20201104)、丙二醛(MDA)试剂盒(批号20201105)、羟脯氨酸(HYP)试剂盒(批号20201029)、总蛋白定量测定试剂盒(批号20201029)、白细胞介素1β(IL-1β)试剂盒(批号CK-E30206)、IL-6试剂盒(批号CK-E30219)、透明质酸酶(HA)试剂盒(批号CK-E30811)、层粘连蛋白(LN)试剂盒(批号CK-E30254)、Ⅲ型前胶原(PC-Ⅲ)试剂盒(批号CK-E31310)、Ⅳ型胶原(Col-Ⅳ)试剂盒(批号CK-E34380)均购自南京建成生物工程研究所;Trizol试剂盒(批号U8926)购自天根生化科技(北京)有限公司;荧光定量PCR试剂盒(批号30537)购自康为世纪生物科技有限公司;氯化钠注射液(批号2012056G,规格200 mL,1.8 g,作生理盐水用)购自山东华鲁制药有限公司;其余试剂均为分析純,水为蒸馏水。
1.3 动物
健康成年雄性SPF级SD大鼠48只,体质量180~250 g,由中国食品药品检定研究院提供,动物生产许可证号为SCXK(京)2017-0005。饲养环境通风状况良好,室温为22~27 ℃,相对湿度为(50±5)%。所有大鼠均自由摄食、饮水。
2 方法
2.1 分组与造模
将大鼠随机分为正常对照组、模型组、阳性对照组(吡非尼酮,0.163 g/kg,根据说明书规定剂量并按体表面积[11]换算所得)和扫日劳-4味汤低、中、高剂量组(0.899、1.798、3.596 g/kg,根据说明书规定剂量并按体表面积[11]换算得中剂量,低、高剂量分别为中剂量的0.5和2倍),每组8只。除正常对照组外,其余各组大鼠均按5 mg/kg于气管内缓慢注射6 mg/mL博来霉素1次以复制特发性肺纤维化模型[12-14]。若大鼠肺组织受损面积大于50%则表示特发性肺纤维化模型成功[15]。
2.2 给药
从建模后的第1天开始,正常对照组和模型组大鼠分别灌胃等体积生理盐水,各药物组大鼠分别灌胃相应剂量的药液(均以生理盐水为溶剂),每天1次,给药体积均为10 mL/kg,连续给药4周。
2.3 大鼠一般情况观察
观察实验过程中各组大鼠的活动、毛发、饮食、体质量等一般情况。
2.4 大鼠肺的外观形态观察与样品采集
于末次给药24 h后处死各组大鼠,立即观察其双肺的颜色、质地、形态、体积等外观变化;然后于腹主动脉取血5 mL,分离血清或血浆并于-80 ℃下冷藏,备用;取左肺下叶组织适量,用4%多聚甲醛溶液固定,备用;取右肺组织适量,经液氮速冻后于-80 ℃下冷藏,备用。
2.5 大鼠肺组织形态学变化观察
取各组大鼠经固定的左肺下叶组织,制成病理切片并进行HE、Masson染色[16-17]。将染色后的切片置于光学显微镜下观察肺组织形态学变化,记录结果并进行病理评分。根据病变程度分别赋分:0分,HE染色结果显示(下同)受損面积为0;1分,受损面积小于25%;2分,受损面积为26%~50%;3分,受损面积为51%~75%;4分,受损面积大于75%[15]。
2.6 大鼠氧化和纤维化相关指标测定
取各组大鼠血清和右肺组织适量,采用酶联免疫吸附测定法(ELISA)以酶标仪测定血清中SOD活性、MDA含量和肺组织中HYP含量,根据相应试剂盒说明书进行操作。
2.7 大鼠肺组织中炎症因子和纤维化相关指标测定
取各组大鼠右肺组织适量,采用ELISA法以酶标仪测定肺组织中炎症因子IL-1β、IL-6和纤维化相关指标HA、LN、PC-Ⅲ、Col-Ⅳ含量,根据相应试剂盒说明书进行操作。
2.8 大鼠肺组织中TGF-β1/Smad信号通路关键基因表达测定
采用实时荧光定量PCR法进行测定。取各组大鼠右肺组织适量,采用Trizol法提取总RNA,以微量分光光度仪测定RNA的浓度后,将其反转录合成cDNA。按荧光定量PCR试剂盒说明书方法配制反应体系,PCR反应体系(50 μL)包含2×Real SYBR Mixture 25 μL,10 ?mol/L上、下游引物各1 μL,cDNA模板 2 μL,ddH2O加至50 μL。按如下反应条件进行PCR扩增:95 ℃预变性10 min;95 ℃变性15 s,58 ℃退火40 s,72 ℃延伸20 s,72 ℃再延伸2 min,共35个循环。根据GenBank数据库(http://ncbi.nlm.nih.gov/genbank/)报道的TGF-β1、Smad3和Smad7的引物序列,应用DNASTAR 12.1软件设计并由生工生物工程(上海)股份有限公司合成,引物序列与产物长度详见表1。以β-actin为内参,采用2-ΔΔCt法计算TGF-β1、Smad3和Smad7 mRNA的表达水平。
2.9 统计学方法
采用SPSS 19.0软件对数据进行统计分析。实验数据以x±s表示,多组间比较采用单因素方差分析,组间两两比较采用LSD检验。P<0.05表示差异有统计学意义。
3 结果
3.1 大鼠的一般情况
正常对照组大鼠摄食饮水正常,能够正常行动,双眼有神,皮毛柔顺。模型组大鼠摄食饮水日渐减少,行动迟缓,目光呆滞,皮毛粗糙、脱落严重,行为懒散,身体机能有明显下降,主要表现为肢体协调性差、动作不灵敏。与模型组比较,扫日劳-4味汤各剂量组和阳性对照组大鼠的上述症状和表现均明显好转。
与正常对照组比较,模型组大鼠末次给药后的体质量显著降低(P<0.01)。与模型组比较,扫日劳-4味汤各剂量组和阳性对照组大鼠末次给药后的体质量均显著升高(P<0.01),详见表2。
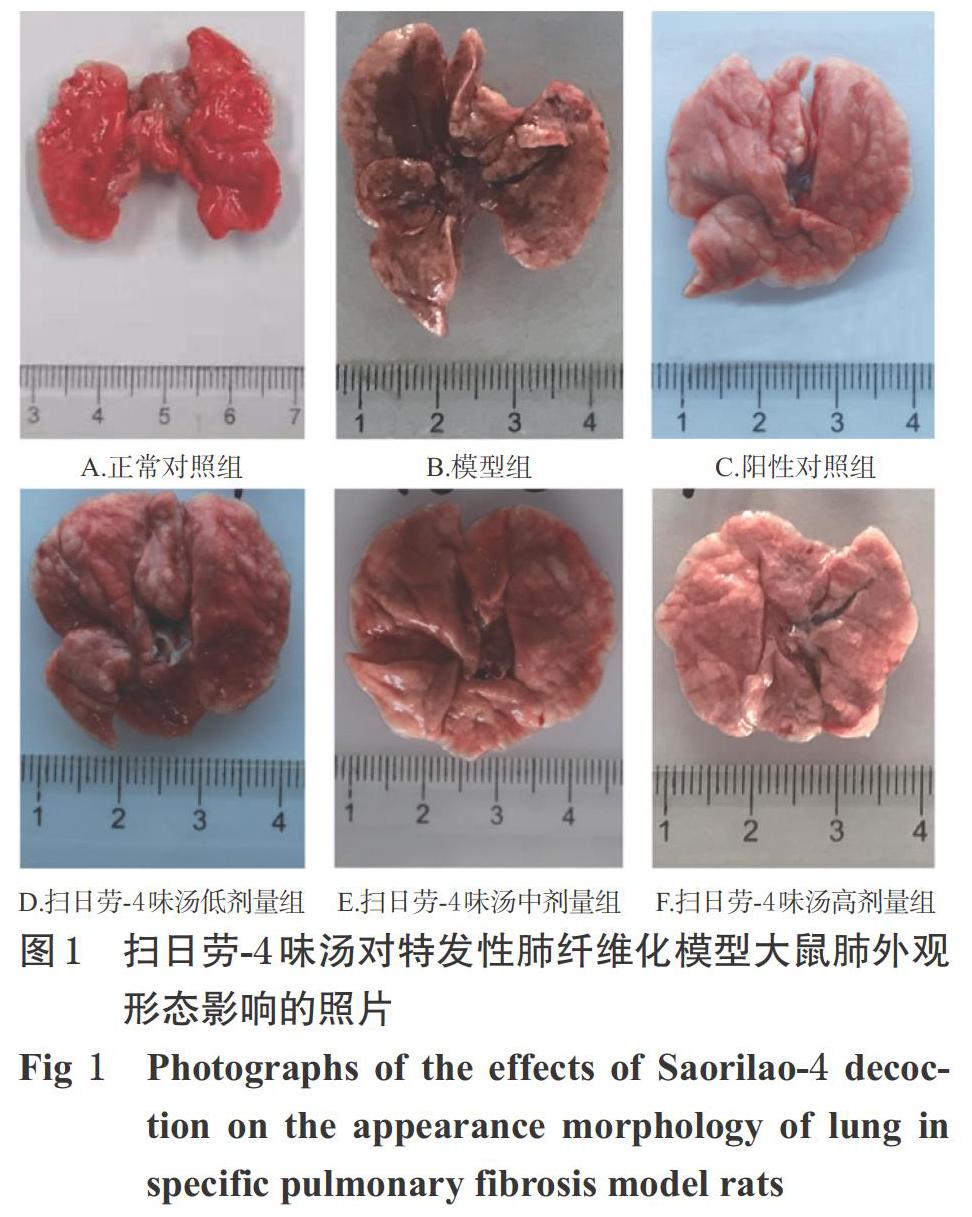
3.2 大鼠肺的外观形态变化
正常对照组大鼠肺鲜红,质地均一柔软。模型组大鼠肺成棕褐色且肿胀,纤维化严重,质地偏硬,有斑点,色泽不均匀。扫日劳-4味汤各剂量组和阳性对照组大鼠肺颜色和质地均有明显改善,其中阳性对照组和扫日劳-4味汤低剂量组改善较明显,详见图1。
3.3 大鼠肺组织的形态学变化
HE染色结果显示,正常对照组大鼠肺泡结构正常,肺泡壁上皮细胞形态及数量正常,肺泡间隔正常未见增厚,肺间质无明显炎症细胞浸润。与正常对照组比较,模型组大鼠肺泡结构破坏,部分肺泡壁塌陷、融合,肺泡壁上皮细胞形态破坏、不规则、数量明显减少,肺泡间隔明显增厚,肺间质可见增生及大量炎症细胞浸润,其病理评分显著升高(P<0.01)。与模型组比较,扫日劳-4味汤各剂量组和阳性对照组大鼠肺泡结构、肺泡壁上皮细胞形态、数量及肺间质炎症程度均明显改善,其病理评分均显著降低(P<0.01),其中扫日劳-4味汤低剂量组大鼠的病理评分显著低于扫日劳-4味汤中、高剂量组(P<0.05),详见图2、表3。
Masson染色结果显示,正常对照组大鼠肺泡结构正常,肺泡间隔未见增厚,肺间质无明显蓝紫色胶原纤维沉积。与正常对照组比较,模型组大鼠肺泡结构破坏,肺泡间隔明显增厚,肺间质可见大量片状蓝紫色胶原纤维沉积。与模型组比较,扫日劳-4味汤各剂量组和阳性对照组大鼠肺泡结构、肺泡间隔、肺间质炎症程度及胶原纤维沉积程度均明显改善,其中扫日劳-4味汤低剂量组和阳性对照组大鼠肺间质胶原沉积改善较明显,详见图3。
3.4 大鼠氧化和纤维化相关指标活性/含量变化
与正常对照组比较,模型组大鼠血清中SOD活性显著降低,血清中MDA含量和肺组织中HYP含量均显著升高(P<0.05或P<0.01)。与模型组比较,扫日劳-4味汤各剂量组和阳性对照组大鼠血清中SOD活性显著升高,血清中MDA含量(扫日劳-4味汤中剂量组除外)和肺组织中HYP含量(扫日劳-4味汤高剂量组除外)均显著降低(P<0.05或P<0.01),详见表4。
3.5 大鼠肺组织中炎症因子和纤维化相关指标含量变化
与正常对照组比较,模型组大鼠肺组织中IL-1β、IL-6、HA、LN、PC-Ⅲ、Col-Ⅳ含量均显著升高(P<0.01)。与模型组比较,扫日劳-4味汤各剂量组和阳性对照组大鼠肺组织中IL-1β、IL-6、HA、LN、PC-Ⅲ、Col-Ⅳ(扫日劳-4味汤高剂量组除外)含量均显著降低(P<0.01),详见表5。
3.6 大鼠肺组织中TGF-β1/Smad信号通路相关基因表达水平变化
与正常对照组比较,模型组大鼠肺组织中TGF-β1、Smad3 mRNA的表达水平均显著升高,Smad7 mRNA的表达水平显著降低(P<0.01)。与模型组比较,扫日劳-4味汤各剂量组和阳性对照组大鼠肺组织中TGF-β1、Smad3 mRNA的表达水平均显著降低,Smad7 mRNA的表达水平均显著升高(P<0.01),详见表6。
4 讨论
本研究制备特发性肺纤维化模型采用的是目前经典的博来霉素诱导法。该法利用抗腫瘤药博来霉素来引发肺纤维化,具有给药剂量小、模型死亡率低等特点[12-14]。
目前,肺纤维化的治疗方法和药物十分有限,寻找和开发治疗肺纤维化的有效方法和药物已成为医学科研界的研究热点之一。蒙药扫日劳-4味汤主要由北沙参、拳参、甘草和紫草茸组成,临床主要用于治疗肺热咳嗽等症[18-19]。吡非尼酮是一种新的具有广谱抗纤维化作用的吡啶酮类药物,能够防止和逆转纤维化和瘢痕的形成[20],故本研究选用该药作为阳性对照药。肺组织的形态学变化结果显示,扫日劳-4味汤和吡非尼酮均可逆转模型大鼠的肺纤维化进展。
本研究测定了与肺纤维化发生发展相关的多项生化指标,其中SOD作为生物体抗氧化系统中很重要的一种酶,其可抑制自由基启动的脂质过氧化[21];MDA的含量可以反映机体脂质过氧化的程度[22];HYP的含量可间接反映肺组织中胶原纤维含量的变化[23]。本研究结果显示,模型组大鼠血清中SOD活性显著低于正常对照组,血清中MDA和肺组织中HYP含量均显著高于正常对照组,同时模型组大鼠肺组织中炎症细胞浸润、胶原纤维沉积明显,说明博来霉素诱导的特发性肺纤维化模型建立成功。与模型组比较,扫日劳-4味汤各剂量组和阳性对照组大鼠血清中SOD活性显著升高,血清中MDA含量(扫日劳-4味汤中剂量组除外)和肺组织中HYP含量(扫日劳-4味汤高剂量组除外)均显著降低,说明扫日劳-4味汤和吡非尼酮均可抑制和清除模型大鼠肺组织中的自由基,改善脂质过氧化,从而减轻肺组织损伤。
已有研究表明,IL-1β、IL-6可以聚集炎症因子,降低基质金属蛋白酶抑制剂1的活性并抑制其合成[24]。HA是纤维化中变化最快、振幅较大的指标,其含量若持续升高则提示纤维化未得到控制[25]。LN为基底膜中特有的非胶原性结构蛋白,与纤维化活动程度成正相关[26]。PC-Ⅲ和Col-Ⅳ在细胞内合成后直接以前胶原的形式参与细胞外间质的合成,与纤维化程度成正相关[27]。本研究结果显示,与正常对照组比较,模型组大鼠肺组织中IL-1β、IL-6、HA、LN、PC-Ⅲ、Col-Ⅳ含量均显著升高。与模型组比较,扫日劳-4味汤各剂量组和阳性对照组大鼠肺组织中IL-1β、IL-6、HA、LN、PC-Ⅲ、Col-Ⅳ(扫日劳-4味汤高剂量组除外)含量均显著降低,说明扫日劳-4味汤和吡非尼酮均可减轻模型大鼠的炎症反应,改善其肺纤维化程度。
在肺纤维化形成过程中,除氧化应激、炎症反应外,TGF-β1/Smad信号通路已被证实具有重要作用[8-10,28-29]。TGF-β1可通过激活Smad蛋白促使成纤维细胞向肌成纤维细胞转化;Smad7可负调控TGF-β1,具有抑制TGF-β1/Smad信号转导的作用;细胞内磷酸化Smad2/3(p-Smad2/3)的表达量与Smad通路的激活程度成正相关[30-32]。本研究结果显示,与正常对照组比较,模型组大鼠肺组织中TGF-β1、Smad3 mRNA的表达水平均显著升高,Smad7 mRNA的表达水平显著降低。与模型组比较,扫日劳-4味汤各剂量组和阳性对照组大鼠肺组织中TGF-β1、Smad3 mRNA的表达水平均显著降低,Smad7 mRNA的表达水平均显著升高,说明扫日劳-4味汤和吡非尼酮均可下调模型大鼠肺组织中TGF-β1、Smad3 mRNA的表达水平,上调Smad7 mRNA的表达水平。
综上所述,扫日劳-4味汤可以显著改善特发性肺纤维化模型大鼠肺部病理改变,延缓并逆转肺纤维化进展,其机制可能与抑制炎症反应,改善脂质过氧化,下调TGF-β1、Smad3 mRNA表达,上调Smad7 mRNA表达有关。本研究结果显示,扫日劳-4味汤低剂量的改善效果最好,其具体原因有待进一步研究。本研究为进一步开展扫日劳-4味汤抗肺纤维化的机制研究奠定了基础,也为肺纤维化的民族药开发提供了新的参考依据。
参考文献
[ 1 ] VANCHERI C,DU BOIS R M. A progression-free end- point for idiopathic pulmonary fibrosis trials:lessons from cancer[J]. Eur Respir J,2013,41(2):262-269.
[ 2 ] KING T E Jr,ALBERA C,BRADFORD W Z,et al. Effect of interferon gam-ma-1b on survival in patients with idiopathic pulmonary fibrosis(INSPIRE):a multicentre,randomized,placebo-controlled trial[J]. Lancet,2009,374(9685):222-228.
[ 3 ] SUZUKI A,KONDOH Y. The clinical impact of major comorbidities on idiopathic pulmonary fibrosis[J]. Respir Investig,2017,55(2):94-103.
[ 4 ] YAMAGUCHI K,IWAMOTO H,SAKAMOTO S,et al. Serum high-mobility group box 1 is associated with the onset and severity of acute exacerbation of idiopathic pulmonary fibrosis[J]. Respirology,2020,25(3):275-280.
[ 5 ] 衛生部药典委员会.中华人民共和国卫生部药品标准:蒙药分册[S].呼和浩特:内蒙古人民出版社,1998:113.
[ 6 ] 内蒙古自治区卫生厅.内蒙古蒙成药标准[M].赤峰:内蒙古科学技术出版社,1984:47.
[ 7 ] 白清云.中国百科全书:蒙医学[M].上海:上海科技出版社,1992:274.
[ 8 ] CHAMBERS R C,MERCER P F. Mechanisms of alveolar epithelial injury,repair,and fibrosis[J]. Ann Am Thorac Soc,2015,12(Suppl 1):S16-S20.
[ 9 ] MACIAS M J,MARTIN-MALPARTIDA P,MASSAGU? J. Structural determinants of Smad function in TGF-β signaling[J]. Trends Biochem Sci,2015,40(6):296-308.
[10] RAO S S,ZHANG X Y,SHI M J,et al. Suberoylanilide hydroxamic acid attenuates paraquat-induced pulmonary fibrosis by preventing Smad7 from deacetylation in rats[J].J Thorac Dis,2016,8(9):2485-2494.
[11] 赵伟,孙国志.不同种实验动物间用药量换算[J].畜牧兽医科技信息,2010(5):52-53.
[12] 卢锦辉,张丽,刘子豪,等.博来霉素诱导小鼠肺纤维化模型的建立及评价[J].兰州大学学报(医学版),2019,45(6):37-42.
[13] PARLAR A L I,OKTAY A S,ONDER Y,et al. Effects of cannabinoid receptor 2 synthetic agonist,AM1241,on bleomycin induced pulmonary fibrosis[J]. Biotech Histochem,2021,96(1):48-59.
[14] ZHANG V,ELIZABETA N,KIM A. Lung iron overload does not exacerbate the fibrotic response to bleomycin in a mouse model of pulmonary fibrosis[J]. Am J Respir Cell Mol Biol,2020,63(5):713-716.
[15] ASHCROFT T,SIMPSON J M,TIMBRELL V. Simple method of estimating severity of pulmonary fibrosis on a numerical scale[J]. J Clin Pathol,1988,41(4):467-470.
[16] PRABHU A,SHAIKH S B,BHANDARY Y P. Curcumin suppresses epithelial growth factor receptor(EGFR)and proliferative protein(Ki 67)in acute lung injury and lung fibrosis in vitro and in vivo[J]. Endocr Metab Immune Disord Drug Targets,2020,20(4):558-563.
[17] LIU Y,WANG Y,LU F,et al. BTB and CNC homology 1 inhibition ameliorates fibrosis and inflammation via blo- cking ERK pathway in pulmonary fibrosis[J]. Exp Lung Res,47(3):1-11.
[18] ZHONG Y,TEZUKA Y,FAN W,et al. Constituents of the underground parts of glehnia littoralis[J].Chem Pharm Bull,2002,50(1):73-77.
[19] 张明发,沈雅琴.甘草及甘草酸类成分抗病毒性肺炎的药理作用研究进展[J].药物评价研究,2020,43(7):1452- 1468.
[20] SPAGNOLO P,KROPSKI J,JONES M G,et al. Idiopa- thic pulmonary fibrosis:disease mechanisms and drug development[J]. Pharmacol Ther,2020,222(53):107798.
[21] ANOUAR A,NADHEM A,HICHEM S,et al. Protective effect of pistacia lentiscus oil against bleomycin-induced lung fibrosis and oxidative stress in rat[J]. Nutr Cancer,2017,69(3):490-497.
[22] 柴文戍,李永春.博來霉素致鼠肺纤维化过程中丙二醛及透明质酸的检测[J].中国临床医学,2003,10(3):285- 287.
[23] LI L,LI Q,WEI L,et al. Dexamethasone combined with berberine is an effective therapy for bleomycin-induced pulmonary fibrosis in rats[J]. Exp Ther Med,2019,18(4):2385-2392.
[24] SHOCHET G E,BROOK E,BARDENSTEIN-WALD B,et al. TGF-β pathway activation by idiopathic pulmonary fibrosis(IPF)fibroblast derived soluble factors is media- ted by IL-6 trans-signaling[J]. Resp Res,2020,21(1):56.
[25] PANDOLFI L,FRANGIPANE V,BOCCA C,et al. Hya- luronic acid-decorated liposomes as innovative targeted delivery system for lung fibrotic cells[J]. Molecules,2019,24(18):3291.
[26] LEE C,JUNG C S,WON-KYUNG C,et al. Laminin α1 is a genetic modifier of TGF-β1-stimulated pulmonary fibrosis[J]. JCI Insight,2018,3(18):e99574.
[27] 顾红艳,葛娟,何鲜,等.联合检测Ⅲ型前胶原、层粘连蛋白、Ⅳ型胶原及透明质酸在间质性肺疾病诊断中的临床意义[J].东南大学学报(医学版),2017,36(6):938-941.
[28] ZHANG P,LIU J,ZONG R. Triptolide protects against TGF-β1-induced pulmonary fibrosis by regulating FAK/calpain signaling[J]. Exp Ther Med,2019,18(6):4781- 4789.
[29] ZHOU Z,KANDHARE A D,KANDHARE A A,et al. Hesperidin ameliorates bleomycin-induced experimental pulmonary fibrosis via inhibition of TGF-beta1/Smad3/AMPK and Ⅰ kappaB alpha/NF-kappaB pathways[J]. Excli J,2019,18:723-745.
[30] LI J,ZHU H,HUANG X,et al. Smad7 inhibits fibrotic effect of TGF-Beta on renal tubular epithelial cells by blo- cking Smad2 activation[J]. JASN,2002,13(6):1464-1472.
[31] LI L,HUANG W T,LI K L,et al. Metformin attenuates gefitinib-induced exacerbation of pulmonary fibrosis by inhibition of TGF-β signaling pathway[J]. Oncotarget,2015,6(41):43605-43619.
[32] ASCHNER Y,KHALIFAH A P,BRIONES N,et al. Protein tyrosine phosphatase a mediates profibrotic signaling in lung fibroblasts through TGF-β responsiveness[J]. Amer J Pathol,2014,184(5):1498-1502.
(收稿日期:2021-02-18 修回日期:2021-05-21)
(编辑:邹丽娟)
