中耳黏膜的扫描电镜样品制备方法的改进
2021-07-12首都医科大学中心实验室100069姬曼赵君朋
首都医科大学中心实验室(100069)姬曼 赵君朋
扫描电子显微镜(Scanning Electron Microscope,SEM)具有分辨率高、视野大、景深长和立体感强等优势,SEM既可以在低放大倍数下观察样品整体的三维结构,也可以通过高倍放大研究样品表面超微形貌特点,因此SEM是研究组织细胞表面微细结构研究的一种必不可少的工具[1]。中耳(听泡)解剖位置深邃,位于颞骨岩部,中耳黏膜上皮起源于内胚层,附于周围骨或软骨组织表面,腔内的立体结构错综复杂[2][3]。由于黏膜层薄而骨组织较厚且细胞的含水量不同,样品制备过程中组织收缩性不同,骨组织脱水变脆,极易发生形变损毁,从而导致附着黏膜层断裂和细胞表面的变形失真[3]。因此,对中耳黏膜组织进行大视野、立体结构观察时,保持组织完整性是困扰SEM工作者的棘手问题。本研究尝试在样品制备环节引入脱钙处理,取得了比较理想的效果,现介绍如下。
1 材料与方法
1.1 标本取材 3只健康SD大鼠(体重250~300g),称重后腹腔内注射6%水合氯醛(30mg/kg)麻醉,经鼓膜注入2.5%戊二醛1~2ml后断头处死动物,取出听泡。
1.2 扫描电镜标本的制备 分别用两种方法处理组织块:①正常对照组:样品用缓冲液冲洗黏液和血迹后,2.5%戊二醛固定6h,在解剖镜下分离得到咽鼓管和鼓室部位组织,入1%四氧化锇固定1h,然后依次经50%、70%、80%、90%、95%和100%乙醇梯度脱水,每次5min;最后放入临界点干燥仪中,处理1.5h;干燥后的样品粘于样品台上,经离子溅射仪镀膜,于扫描电子显微镜下观察并记录。②脱钙处理组:样品用缓冲液冲洗黏液和血迹后,首先2.5%戊二醛固定6h,在解剖镜下分离得到咽鼓管和鼓室部位组织,置10%EDTA溶液中(4℃)脱钙处理12h,后续处理同对照组。
2 结果
扫描电镜下观察显示:中耳黏膜中主要有纤毛细胞、无纤毛细胞、杯状细胞及扁平细胞组成。纤毛细胞表面分布丰富的纤毛;无纤毛细胞表面具有短的微绒毛;杯状细胞表面附有分泌黏液滴。扁平细胞呈现多角形,表面分布有短微绒毛。在中耳腔的不同部位,各种细胞的比例有显著不同。纤毛细胞主要分布在咽鼓管下壁,而鼓呷部和后鼓室相对较少。鼓室口下壁分布丛状纤毛细胞,纤毛上皮间可见无纤毛细胞,无纤毛细胞表面可见大量微绒毛,但几乎看不到扁平细胞(附图1)。咽鼓管峡部,纤毛分布致密,纤毛密而长,形成纤毛毯,纤毛细胞间有一些分泌黏液的杯状细胞分布。扁平细胞多为六边形,表面平坦有微绒毛,细胞边界清晰,呈镶嵌排列(附图2),多分布于后鼓室、鼓岬后部及鼓膜松弛部。此外,镜下可见常规处理样品,黏膜表面可见明显龟裂纹(附图1B,附图2B);EDTA脱钙处理组样品,随着脱钙时间的延长,黏膜表面龟裂纹明显减少,黏膜中纤毛细胞、无纤毛细胞表面形貌特征与对照组无明显差异(附图1A,附图2A)。
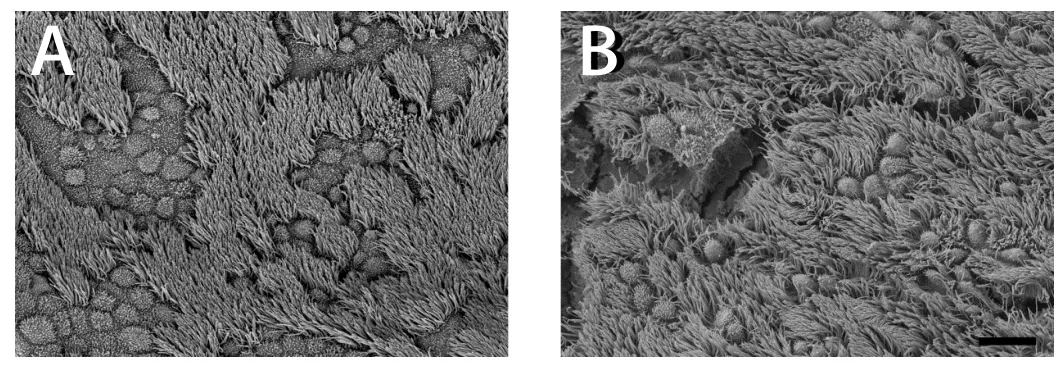
附图1 中耳咽鼓管鼓室口处黏膜扫描电镜观察。A脱钙处理组;B正常对照组。bar=10um

附图2 乳突气房黏膜扫描电镜观察。A脱钙处理组;B正常对照组。bar=10um
3 讨论
中耳黏膜结构复杂精巧,且深埋于颞骨岩部,听泡周围骨质精细脆弱,在制备过程中极易损毁变形,因此中耳黏膜扫描电镜样品制备不易成功[2][3]。本研究借鉴骨组织切片中脱钙处理原理,利用脱钙液使骨组织充分脱钙,以保证样品结构的完整性。骨组织一种坚硬且有韧性的结缔组织,它由钙化的细胞外基质即骨基质和骨细胞构成。传统的骨组织脱钙处理采用强酸溶液脱钙,虽然脱钙速度快,但造成组织细胞肿胀或碎裂等问题,影响观察结果的准确性和真实性[4][5]。以乙二胺四乙酸二钠(ethylenediaminetetraacetic acid,EDTA)为代表的螯合剂类脱钙液可以通过与骨组织中钙离子的结合达到脱钙目的,虽对细胞结构及抗原免疫活性影响最小,但其脱钙时间明显长于酸类脱钙液[4][5]。
本研究首先用2.5%戊二醛前固定,再入EDTA脱钙液中脱钙处理。固定是整个组织处理过程的关键,电镜样品制备一般多用戊二醛固定。戊二醛一方面可对组织完全彻底的固定,可以使样品在脱钙过程中组织结构免受破坏。另一方面,有研究表明戊二醛可以加大脱钙液的穿透力而加快脱钙速度[5]。所以,在前固定后立即进行EDTA脱钙处理,既有保护组织的结构又能缩短脱钙时间,从而使样品制备既快又好,节约时间和成本。扫描电镜下观察,EDTA脱钙处理后黏膜细胞超微形貌特征无变化,且样品碎裂现象有明显改善。此方法也对其他骨性组织样品制备均有一定的借鉴意义。
