FAM60A在细胞功能调控作用中的研究进展
2021-07-09孙永红孙晓伟陈永林
孙永红,孙晓伟,杨 琳,程 博,陈永林
兰州大学 1第一临床医学院 2生命科学学院 3第一医院病理科,兰州 730000
FAM60A是一种从果蝇体内发现的小型核蛋白,位于人的染色体12p11.21,具有保守的GATA样锌指结构[1]。FAM60A与人类蛋白质组中的其他蛋白质缺乏同源性,该蛋白的中心区域没有明显的二级结构,其结构是通过与SIN3转录调控蛋白家族成员A(SIN3 transcription regulator family member A,Sin3A)/组蛋白去乙酰化酶(histone deacetylase,HDAC)复合体的其他组分相互作用而稳定的[2]。一般认为FAM60A是Sin3A/HDAC复合体的一个亚基,通常与Sin3A/HDAC复合体结合而发挥作用,在细胞增殖、分化、转移,细胞周期调控、植入前胚胎发育以及组织器官发育过程中具有重要的作用[1-4]。此外,FAM60A还在肿瘤的发生发展、重组CHO细胞株的生产稳定性及缺氧反应中发挥一定作用[1-2,5-8]。本文总结了FAM60A在调节各项细胞功能中的作用,为发掘FAM60A新的研究方向提供依据。
Sin3A/HDAC复合体
Sin3A/HDAC复合体是一类由多种蛋白质组成的转录共阻遏复合体(图1),对小鼠早期胚胎发育至关重要,可以维持胚胎干细胞(embryonic stem cells,ESCs)的多能性,并促进诱导多能干细胞(induced pluripotent stem cells,iPSCs)的产生[9-11]。Sin3A为大分子蛋白质,虽自身不与DNA结合,但含有多个蛋白质相互作用的结构域,可为具有特定DNA结合活性的几个转录因子提供一个支架,通过促进HDACs的募集来调节组蛋白的去乙酰化,调控特定的靶基因[12-13]。Sin3A与特定转录因子的相互作用可将Sin3A/HDAC复合体招募到不同的基因亚群中,促进或抑制功能基因的转录[14]。Sin3A是一个全基因组的转录调控因子,与HDACs是哺乳动物转录共阻遏复合体的核心组分,对催化活性很重要,缺乏Sin3A的小鼠在植入前后的胚胎发育过程中死亡。虽然这种复合体最初被认为只会通过组蛋白去乙酰化抑制基因表达,但它也能以一种依赖于细胞环境的方式刺激转录[15]。在生物学进程中,Sin3A复合体通过结合不同的亚基介导不同的效应,最终直接或间接调节多种细胞功能和维持细胞稳态,如维持蛋白质稳定性,参与调节细胞周期,调控细胞生长、增殖和凋亡,参与肿瘤发生发展等[16-17]。FAM60A是Sin3A/HDAC复合体的一个核心亚基,可以调节多种细胞功能,通过STRING数据库,我们得到了可能与FAM60A相互作用的其他蛋白质的关系图(图2)。
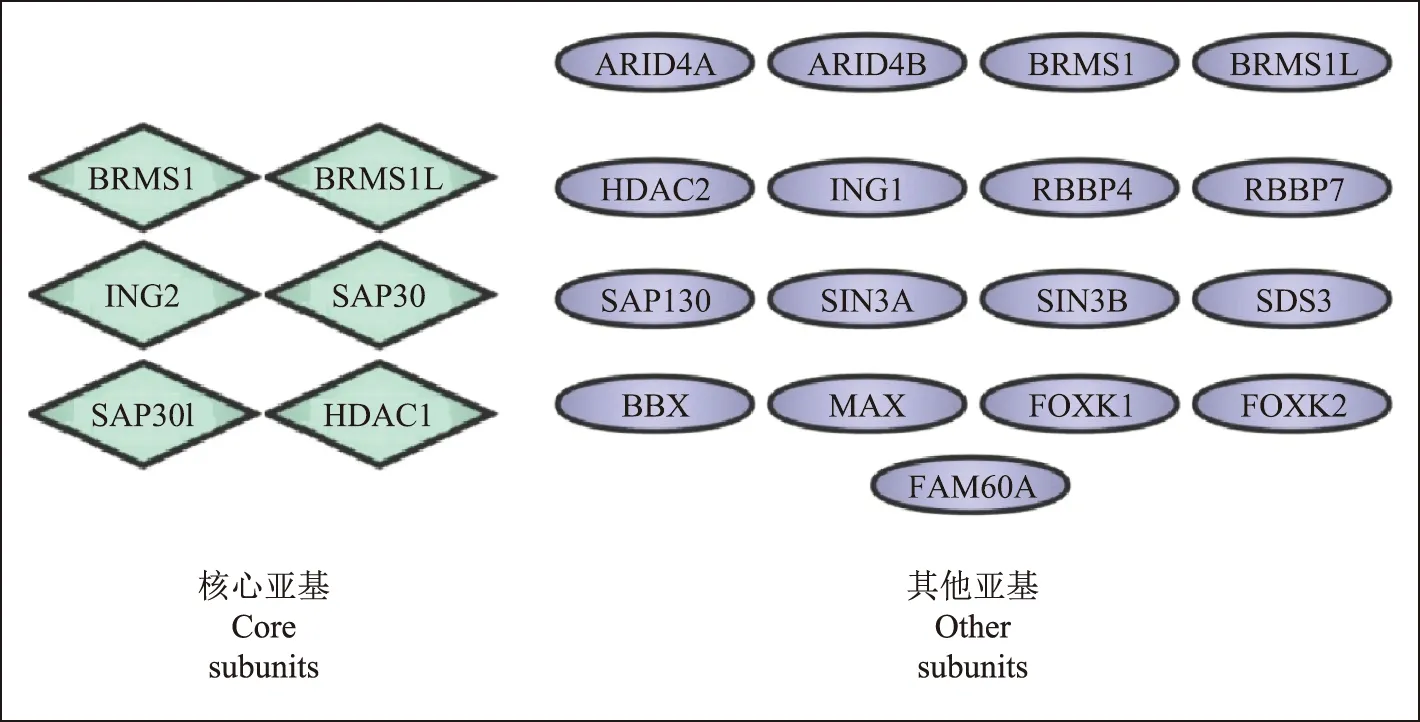
图1 SIN3转录调控蛋白家族成员A/组蛋白去乙酰化酶复合体Fig 1 SIN3 transcription regulator family member A/histone deacetylase complexes
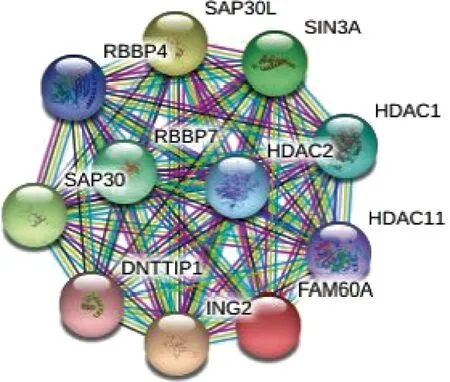
图2 STRING数据库中与FAM60A相互作用的蛋白质Fig 2 Proteins interacting with FAM60A in the STRING database
FAM60A参与调控胚胎发育
Pantier等[18]研究表明,在一个特定的细胞类型中,所有Sin3A复合体中都可能存在非必需成分。尽管FAM60A是分化细胞中一个非必需的Sin3A复合体亚基,但在小鼠ESCs中,Sin3A复合体的功能完整性仍然需要FAM60A,它是ESCs中Sin3A复合体的一个重要组成部分,敲除FAM60A会导致Sin3A复合体失稳,Sin3A蛋白水平的降低。FAM60A敲除对Sin3A的破坏作用似乎是一种细胞特异性效应,因为在人骨肉瘤细胞(U2OS细胞)或293 T细胞中,FAM60A基因敲除都没有破坏Sin3A的稳定性[1],因此Sin3A复合体的非FAM60A组分负责在非ESCs中实现Sin3A的稳定。
FAM60A是Sin3A复合体特有的亚基,不存在于其他染色质复合体中。有研究证实,FAM60A在多能ESCs中呈高表达,与Ogt、Tet1和Sin3A构成复合体,该复合体与ESCs中组蛋白第3亚基四号赖氨酸的三甲基化(hrimethylated histone 3 lysine 4,H3K4me3)的启动子结合,对维持染色质上复合体的稳定具有重要作用[4]。H3K4me3是一种组蛋白翻译后修饰因子,与活跃基因和稳定基因相关[19]。FAM60A mRNA水平在快速增殖的ESCs中较高,其基因位点与E2F转录因子1(E2F transcription factor 1,E2F1)、同源盒转录因子Nanog和八聚体结合蛋白4(octamer-binding protein 4,Oct4)结合,而在分化过程中FAM60A表达水平下调,导致细胞增殖率降低[4]。另一研究发现,大多数Fam60A-/-的胚胎表现为内脏器官发育不良,并在子宫内死亡,这种结果至少部分是由于其在特定基因启动子上的异常甲基化调控所致[3]。在胚胎早期发育过程中,Tet蛋白对进化保守的基因增强子起着去甲基化作用,FAM60A负调控Tet1的活性,但不影响Tet1招募到启动子区域。铁依赖乙醇脱氢酶1(alcohol dehydrogenase,iron containing protein 1,Adhfe1)是FAM60A靶基因,由于其启动子甲基化,Adhfe1的表达通常受到抑制。在FAM60A-/-的胚胎中由于缺乏FAM60A,启动子低甲基化导致Adhfe1表达上调,这是由FAM60A介导的Tet活性抑制导致的,Adhfe1可能是一个受FAM60A和Tet活性调控的典型基因。这些结果表明,FAM60A与Sin3A-HDAC转录共阻遏复合体的其他组分相互作用,是促进小鼠ESCs快速增殖和器官形成,维持ESCs未分化状态所必需的。
FAM60A在肿瘤发生发展中的作用
FAM60A蛋白水平在不同细胞系中不同,在人类胚胎肾、肺癌、胰腺癌细胞系中含量最高[2]。近年研究发现,FAM60A在肿瘤发生发展中发挥重要作用,对肿瘤的治疗及预后有一定的指导意义。
促癌作用
调控细胞生长、增殖和凋亡:FAM60A早期被认为是一个细胞周期调控蛋白,对细胞周期有着重要的调控作用。Streubel等[4]研究发现,ESCs中FAM60A拟表型的缺失会造成Sin3A缺失,从而导致细胞增殖率降低、G1期延长和谱系基因失调。FAM60A-Sin3A复合体可能与细胞的快速增殖有着内在联系,FAM60A的mRNA水平可能由于E2f1转录激活而在肿瘤细胞中上调,因此它可能在包括人类肿瘤细胞在内的其他快速增殖细胞中被解除管制。Tanaka等[5]研究表明,FAM60A在食管癌中表达上调,与肿瘤大小、淋巴结转移、TNM分期呈正相关。下调FAM60A的表达可降低G1期细胞比例,使细胞阻滞在G2/M期,抑制细胞增殖,促进细胞凋亡,同时也抑制了细胞在体外的转移和侵袭能力。Yao等[6]研究发现,胃癌组织中FAM60A表达水平升高,尤其是在胃肠型腺癌中,与胃癌患者预后不良有关。同时,幽门螺杆菌(Helicobacter pylori,Hp)感染可通过靶向磷脂酰肌醇3激酶(phosphatidylinositol 3 kinase,PI3K)/丝氨酸/苏氨酸激酶(serine/threonine-protein kinase,AKT)信号通路上调FAM60A的表达水平,促进癌细胞增殖,诱发胃癌。下调FAM60A可抑制胃癌细胞的增殖,促进细胞凋亡。细胞周期分析显示,Hp感染使S期细胞比例增加,G1/G0期细胞比例下降。敲除FAM60A可显著增加G1/G0细胞比例,并产生G1/G0期阻滞,提示Hp诱导FAM60A上调可能部分通过调节细胞周期促进胃癌细胞增殖。
调控细胞分化程度:Tanaka等[5]研究发现,FAM60A在正常食管组织中表达为阴性,而在食管癌低分化组织中表达高于高分化组织,表明FAM60A可能调控癌细胞的分化程度,与癌症的恶性表型有关。Streubel等[4]研究表明,FAM60A是ESCs中变异型Sin3复合体的一个核心亚基,能促进细胞快速增殖,维持细胞未分化状态,抑制其过早分化。FAM60A在小鼠ESCs中高度表达,在ESCs分化过程中,FAM60A的蛋白质和mRNA水平下降,而Sin3A的蛋白质和mRNA水平没有下降,表明FAM60A在转录水平上受到调控[3-4],进一步说明FAM60A可能在细胞分化过程中起着重要作用。
抑癌作用
并不是Sin3A复合物的所有亚基都只能促进癌症的发生,如乳腺癌转移抑制基因1(breast cancer metastasis suppressor 1,BRMS1)在小鼠模型中可以抑制肿瘤转移。此外,生长抑制因子(inhibitor of growth,ING)1和视网膜母细胞瘤结合蛋白1(retinoblastoma binding protein 1,RBP1)具有抑制肿瘤的特性,一些Sin3复合物亚基可能同时显示肿瘤抑制和致癌特性,如ING2[2,20]。FAM60A除了其致癌特性,在一些肿瘤中也具有抑癌作用。
参与调节细胞周期:FAM60A具有N端保守的GATA样锌指基序,提示其在DNA结合或转录调控中发挥作用。Munoz等[1]研究发现,FAM60A是Sin3A-HDAC复合体的一个细胞周期调节亚基,影响基因表达,在U2OS细胞周期的G1期和S期表达达到峰值。FAM60A与Sin3A/HDAC复合体结合作用于G1期调控因子细胞周期素D1(CyclinD1)的启动子上,促进组蛋白去乙酰化,从而抑制CyclinD1的表达水平。当FAM60A 敲除时,与它协同调节CyclinD1蛋白的Sin3A-HDAC复合体的作用也随之减弱,使细胞中CyclinD1的启动子乙酰化程度增高,其mRNA和蛋白质水平也相应增加,导致细胞提前进入S期。Cyclin D1是一种致癌基因,因染色体易位被激活,在多种人类癌症中过表达[21]。Munoz等[1]研究表明,FAM60A参与调节细胞周期,在人骨肉瘤中起抑癌基因的作用。这些结果与之前在ESCs、食管癌细胞及胃癌细胞中FAM60A对细胞周期的调节作用不太一致。由此我们认为,FAM60A可能有多种机制影响细胞周期,需要对其做进一步研究。
抑制细胞转移:Smith等[2]研究发现,FAM60A能抑制转化生长因子β(transforming growth factor,TGF-β)信号通路中的基因,这些基因表达的变化与FAM60A在Sin3A-HDAC复合体的作用有关。FAM60A通常结合在TGF-β受体1(TGF-β receptor 1,TGFβR1)和SMAD同源物2(SMAD family member 2,SMAD2)启动子上,在肺癌和肝癌细胞中发挥重要的转录抑制作用,其缺失可导致细胞形态学的改变,增加细胞转移。有实验表明,FAM60A可以在多种细胞类型中直接调控TGF-β信号通路中的基因,而细胞形态和其他下游事件的改变依赖于功能性的TGFβR1和TGFβR2。这表明在肺癌和肝癌细胞中,FAM60A和Sin3A复合体对调节TGF-β信号通路的基因转录是必需的,进而抑制细胞转移。在小鼠模型中,Sin3复合物的BRMS1亚基也可以抑制转移[22],提示Sin3复合物中的特定亚基可能共同抑制转移。而过表达ING2亚基可诱导结肠癌细胞侵袭,表明ING2可促进侵袭和转移[2,23]。因此,只有当Sin3复合物的特定亚基被抑制时,细胞形态的变化和细胞迁移的诱导才会被诱导。
促进肺癌细胞顺铂耐药:在癌症的治疗过程中,化疗是非常重要的治疗方法之一。一些化疗药物如顺铂,虽然在肺癌前期治疗中效果显著,但后期容易产生化疗耐药,这极大地限制了其在癌症治疗中的应用[24]。Hou等[25]研究发现,FAM60A mRNA水平在肺腺癌细胞A549/DDP及化疗后复发和化疗后的肺鳞癌组织中显著上调。FAM60A过表达可抑制凋亡相关蛋白(caspase 3和caspase 8)表达而抑制肺癌细胞A549/DDP凋亡,并诱导多药耐药基因1(multidrug resistance gene 1,MDR1)的表达,促进顺铂耐药。FAM60A敲除后S期激酶相关蛋白2(S-phase kinase associated protein 2,SKP2)表达显著下调,SKP2 mRNA表达随顺铂浓度增加而增加,提示在A549/DDP细胞中SKP2的表达与FAM60A表达相关。反向验证发现下调SKP2可诱导A549/DDP细胞凋亡,抑制顺铂耐药,逆转FAM60A所促进的功能。SKP2是SKP1-CUL1-F-box蛋白泛素连接酶复合物的底物特异性因子[26],有研究显示SKP2可能参与耐药,例如SKP2过表达增加了人肺癌细胞对喜树碱和顺铂的化疗耐药性[27]。顺铂是治疗肺癌的一线化疗药物,出现顺铂耐药是治疗失败的首要原因,该研究表明FAM60A通过促进SKP2在A549/DDP细胞中的表达,抑制细胞凋亡并促进顺铂耐药,可能是克服肺癌化疗耐药的潜在靶点,对肺癌的治疗有一定的指导意义。
缺氧反应:Sin3A-HDAC复合体对于缺氧的完全转录应答是必需的,干扰Sin3A不仅影响单个基因,还改变了典型的缺氧调控过程,如抑制氧化磷酸化和脂肪酸氧化[28]。Biddlestone等[8]研究表明,FAM60A通过与转录因子SP1的相互作用将HDAC1募集到缺氧诱导因子2α(hypoxia-inducible factor-2α,HIF-2α)启动子上,特异性抑制HIF-2α蛋白质和mRNA的表达。而FAM60A对HIF-2α基因表达的表观遗传沉默作用是通过招募Sin3A-HDAC转录共阻遏复合体因子,该复合物通过与转录因子SP1相互作用调节HIF-2α表达。FAM60A将Sin3A-HDAC转录共阻遏复合体的功能与缺氧反应联系起来,在肿瘤治疗中,选择性抑制特定的同型HIF-2α是一个有吸引力的提案,因为其可能会提高肿瘤的特异性和靶向治疗。
小结与展望
HDAC是重要的表观遗传靶点,在基因调控、转录,细胞增殖,血管生成、迁移、分化和转移等生物学过程中发挥重要作用。HDAC抑制剂在恢复组蛋白和非组蛋白赖氨酸残基乙酰化和去乙酰化平衡中起着至关重要的作用,已成为治疗癌症的重要生物活性化合物。除了癌症治疗外,HDAC抑制剂最近也被认为是治疗其他人类疾病的新策略,如酒精使用障碍、神经障碍、年龄相关疾病等。这些药物通过许多不同的细胞机制发挥作用,抑制不同的HDAC1/2 复合物以及复合物中不同亚基可能导致不同的生物学结果。目前可用的HDAC抑制剂大多是非选择性,存在一些缺陷,如疗效有限、耐药和不良反应。因此,选择性HDAC抑制剂引起了学术界和业界的广泛关注[29-30]。Sin3复合物是被称为HDAC抑制剂抗癌药物的靶点之一[2]。由于并非所有Sin3复合物亚基都能促进癌症发生,一些可抑制癌症发生,如BRMS1、ING1和RBP1等。此外,一些Sin3复合物亚基可能同时显示肿瘤抑制和致癌特性,如ING2、FAM60A。了解这个复合物编码的完整功能,哪些亚基介导这些功能,以及HDAC抑制剂是如何影响这些功能非常重要。随着越来越多研究的进行,已经证实FAM60A在一些肿瘤的发生发展中具有重要作用。已有研究表明,FAM60A在人骨肉瘤细胞、食管癌及胃癌中起致癌基因的作用,而在肺癌和肝癌细胞中起抑癌基因的作用,还可以促进肺癌细胞顺铂耐药,这些结果为肿瘤的研究提供了一个新的方向,为癌症的诊断和治疗提供了新思路。另外,FAM60A同样在早期胚胎发育、缺氧反应等中发挥作用,为研究胚胎发育问题、增加重组细胞的生产稳定性,生产高表达治疗蛋白以及提高肿瘤的特异性和靶向治疗提供了依据和方向。这些研究表明FAM60A在各项细胞功能调控中具有非常重要的作用,但关于FAM60A还有很多其他未知的问题,例如在其他肿瘤发生发展中的作用、在不同肿瘤中调控作用的不一致和在Sin3A-HDAC复合体的具体功能等,需要更多更深入的探究。
