隐丹参酮可能具有诱导人肝癌HepG2细胞铁死亡的作用
2021-07-09刘金丽高月娟
刘金丽,佟 雷,罗 烨,高月娟
牡丹江医学院 1附属红旗医院肝病及感染性疾病科 2药学院 3附属红旗医院临床药学部,黑龙江牡丹江157011
肝细胞癌简称肝癌,是临床常见的恶性肿瘤类型,在全球范围内发病率和死亡率均较高[1-2]。肝癌的临床治疗目前以手术切除为主,化疗和放疗为辅[3]。然而,由于肝癌具有高转移率、高复发率、术后5年生存率普遍较低的特点[4],因此寻找有效的抗肝癌药物具有重要的临床价值和社会意义。
越来越多的研究表明,中医药在肝癌的治疗中取得了良好疗效[5-6]。隐丹参酮是从中药丹参中分离出的一种脂溶性二萜醌类化合物,具抗炎、抗菌、抗氧化、抗肿瘤等药理活性[7],尤其是其抗肿瘤作用得到学者的广泛关注。研究显示,隐丹参酮对多种肿瘤具有较好的抗肿瘤效果,如:乳腺癌[8]、肺癌[9]、肾细胞癌[10]、胃癌[11]、膀胱癌[12]、胆管癌[13]和卵巢癌[14]等。Park等[15]研究发现,隐丹参酮可抑制人肝癌HepG2细胞增殖并诱导其凋亡。
铁死亡是最近发现的一新型细胞死亡方式,与坏死、自噬、凋亡等死亡方式不同,其不消耗能量,不发生细胞内钙超载,没有凋亡标志物[16],仅以细胞内超载的游离铁催化具有高反应破坏性的活性氧(reactive oxygen species,ROS)生成,激活氧化应激反应,引起细胞膜断裂、线粒体嵴减少或消失、溶酶体或DNA等损伤进而诱导细胞发生死亡[17-18]。本研究观察了隐丹参酮在人肝癌HepG2细胞铁死亡中的作用。
材料和方法
材料和试剂人肝癌HepG2细胞株购自上海中科院细胞库,HepG2细胞复苏后,在含有10%胎牛血清、100 U/L青霉素和100 μg/ml链霉素的DMEM培养基中培养。隐丹参酮(纯度>98.0 %)购自中国药品生物制品检定所,DMEM培养基购自美国Life Technology 公司,胎牛血清、青霉素、链霉素购自美国Gibco公司,CCK-8试剂盒、DCFH-DA探针、谷胱甘肽(glutathione,GSH)测定试剂盒、BCA蛋白定量试剂盒购自碧云天生物技术有限公司,铁死亡抑制剂Ferrostain-1(Fer-1)、铁螯合剂去铁胺(deferoxamine,DFO)、ROS清除剂乙酰半胱氨酸(N-acetylcysteine,NAC)购自大连美仑生物技术有限公司,兔抗人胱氨酸谷氨酸逆转运体轻链蛋白(cystine/glutamate antiporter system light chain,xCT)单克隆抗体、兔抗人谷胱甘肽过氧化物酶4(glutathione peroxidase 4,GPX4)单克隆抗体购自英国Abcam 公司,辣根过氧化物酶标记的抗兔IgG购自美国Cell signaling Technology公司。
CCK-8法检测HepG2细胞活力将处于对数生长期的HepG2细胞以0.25% 胰蛋白酶消化,调整至2×104个/ml密度接种于96孔板中,每孔100 μl;置于37℃、5% CO2饱和湿度的培养箱中培养,待细胞贴壁后加入不同浓度隐丹参酮(0、20、40、60、80、100 μmol/L),或以1 μmol/L铁死亡抑制剂Fer-1、5 μmol/L 铁螯合剂DFO或5 μmol/L ROS清除剂NAC预处理12 h,37℃、5% CO2饱和湿度的培养箱中培养24 h;加入10 μl CCK-8 溶液继续孵育4 h,在酶联免疫检测仪波长450 nm 处检测各孔的光密度(optical density,OD)值,同时设置空白培养基作为对照检测细胞活力。细胞活力(%)=(OD实验组-OD空白对照组)/(OD0 μmol/L隐丹参酮-OD空白对照组)×100 %。每组设6个平行孔,取平均值,计算隐丹参酮对HepG2细胞的半数抑制浓度(half inhibitory concentration,IC50)。
倒置相差显微镜观察细胞形态学将处于对数生长期的HepG2细胞以0.25% 胰蛋白酶消化,调整至2×104个/ml密度接种于6孔板,置于37 ℃、5 % CO2饱和湿度的培养箱中培养;待细胞贴壁后加入不同浓度隐丹参酮(0、40、60、80 μmol/L),37 ℃、5 % CO2饱和湿度的培养箱中培养24 h。采用倒置相差显微镜(×400)观察HepG2细胞形态学的变化并拍照,每组设3个平行孔。
DCFH-DA探针检测HepG2细胞ROS水平将处于对数生长期的HepG2细胞以0.25 % 胰蛋白酶消化,调整至2×104个/ml密度接种于6孔板,置于37 ℃、5 % CO2饱和湿度的培养箱中培养;待细胞贴壁后加入不同浓度隐丹参酮(0、40、60、80 μmol/L)或以1 μmol/L Fer-1预处理12 h,37 ℃、5 % CO2饱和湿度的培养箱中培养24 h;加入1 ml 2 μmol/L DCFH-DA继续孵育30 min,上机流式细胞术检测分析荧光强度。结果以相对0 μmol/L 组的倍数表示,每组设3个平行孔,取平均值。
GSH水平检测细胞培养及分组同“DCFH-DA探针检测HepG2细胞ROS水平”。严格参照GSH 测定试剂盒说明书检测GSH 水平,结果以相对0 μmol/L 组的倍数表示,每组设3个平行孔,取平均值。
Western blot法检测xCT和GPX4表达细胞培养及分组同“DCFH-DA探针检测HepG2细胞ROS水平”。收集细胞并用PBS洗涤2 次,以RIPA 细胞裂解液在冰上进行裂解,提取总蛋白,BCA蛋白测定试剂盒测定蛋白浓度。取30 μg蛋白变性,SDS-PAGE 凝胶电泳分离蛋白,电泳转移至PVDF 膜,封闭液室温封闭2 h,TBST 洗膜后,一抗4 ℃孵育过夜。TBST 洗膜后加入二抗,室温孵育2 h。ECL化学发光试剂显色,凝胶成像系统对各组条带进行计值及统计分析。以内参蛋白GAPDH 为参照,计算目的蛋白的相对表达量。每组设3个平行孔,取平均值。
统计学处理采用SPSS 17.0统计软件,符合正态分布的计量资料以均数±标准差表示,两组均数的比较采用t-检验,多组均数比较采用方差分析,多组间差异的两两比较采用Bonferroni校正,检验水准α=0.05。
结 果
隐丹参酮可抑制HepG2细胞活力CCK-8法检测结果显示,隐丹参酮0、40、60、80、100 μmol/L组的HepG2细胞活力分别为(100.00±0.00)%、(93.28±12.01)%、(80.89±10.36)%、(73.26±9.38)%、(54.70±7.00)%、(41.23±5.27)%,其中,40(t=2.112,P=0.048)、60(t=3.209,P=0.006)、80(t=6.414,P=0.003)、100 μmol/L组(t=11.054,P<0.001)的细胞活力均明显低于0 μmol/L组,20 μmol/L组与0 μmol/L组相比差异无统计学意义(t=0.490,P=0.649)。隐丹参酮IC50为93.73 μmol/L。根据本实验结果,选取40、60、80 μmol/L 隐丹参酮进行后续实验。
隐丹参酮对HepG2细胞形态学的影响倒置光学显微镜观察结果显示,隐丹参酮0 μmol/L组细胞形态大小正常,聚集成团样,生长良好;隐丹参酮40、60、80 μmol/L组细胞生长状态差,形态不规则并呈离散状生长,数目减少,细胞变小,细胞挛缩,黏附力差,可见漂浮的细胞或碎片(图1)。
隐丹参酮诱导HepG2细胞ROS水平累积流式细胞术检测结果显示,隐丹参酮0、40、60、80 μmol/L组的HepG2细胞荧光强度分别为1.00±0.00、1.71±0.22、1.98±0.25、2.11±0.27,其中,隐丹参酮40(t=3.279,P=0.031)、60(t=4.195,P=0.004)、80 μmol/L组(t=4.460,P=0.003)的HepG2细胞荧光强度明显高于0 μmol/L组。
隐丹参酮降低HepG2细胞GSH水平GSH检测结果显示,隐丹参酮0、40、60、80 μmol/L组的HepG2细胞相对GSH水平分别为1.00±0.00、0.81±0.10、0.62±0.07、0.43±0.05,其中,隐丹参酮40(t=2.083,P=0.041)、60(t=4.691,P=0.009)、80 μmol/L组(t=10.182,P<0.001)的HepG2细胞相对GSH水平明显低于0 μmol/L组。
隐丹参酮下调HepG2细胞xCT和GPX4表达Western blot检测结果显示,隐丹参酮0、40、60、80 μmol/L组HepG2细胞的相对xCT和GPX4水平分别为1.00±0.00和1.00±0.00、0.71±0.09和0.68±0.08、0.44±0.05和0.22±0.02、0.18±0.02和0.10±0.01,其中,40(t=3.126,P=0.035;t=3.625,P=0.023)、60(t=9.575,P<0.001;t=11.867,P<0.001)、80 μmol/L组(t=14.383,P<0.001;t=16.539,P<0.001)HepG2细胞的相对xCT和GPX4水平明显低于0 μmol/L组(图2)。
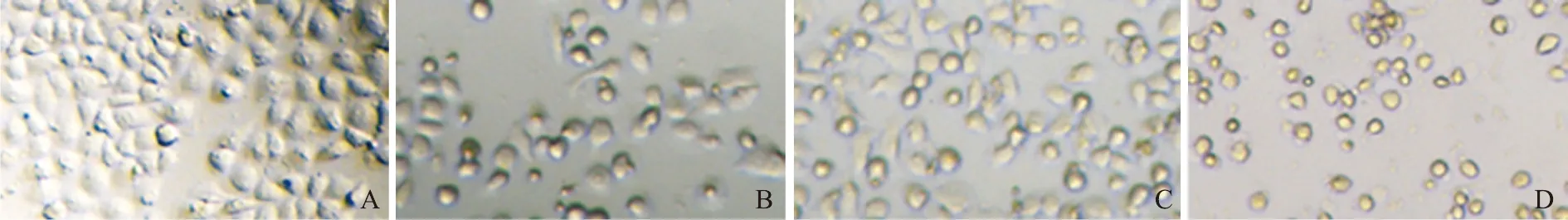
A.0 μmol/L;B.40 μmol/L;C.60 μmol/L;D.80 μmol/L图1 倒置光学显微镜下观察不同浓度隐丹参酮处理对HepG2细胞形态的影响(×400)Fig 1 Morphological changes of HepG2 cells treated with different levels of cryptotanshinone under an inverted optical microscope(×400)
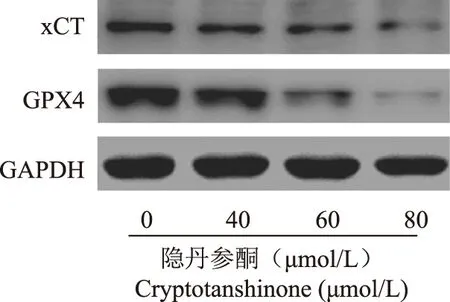
图2 Western blot检测隐丹参酮对HepG2细胞xCT和GPX4表达的影响Fig 2 Western blot for the expression of xCT and GPX4 in HepG2 cells treated with cryptotanshinone
不同抑制剂可恢复HepG2细胞活力分别采用铁死亡抑制剂Fer-1、铁螯合剂DFO、ROS清除剂NAC处理HepG2细胞,观察相同隐丹参酮处理条件下不同抑制剂对隐丹参酮引起的细胞活力下降的恢复作用,结果显示,隐丹参酮+Fer-1组、隐丹参酮+DFO组和隐丹参酮+NAC组的HepG2细胞活力分别为(82.35±10.54)%(t=6.414,P=0.003)、(76.25±9.76)%(t=4.535,P=0.011)和(63.03±8.07)% (t=2.590,P=0.036),均明显高于隐丹参酮80 μmol/L组的(54.70±7.00)%。
铁死亡抑制剂Fer-1可恢复隐丹参酮诱导的HepG2细胞变化基于Fer-1对HepG2细胞活性恢复作用更明显,选取Fer-1进行恢复实验,结果显示,隐丹参酮+Fer-1组的HepG2细胞荧光强度为1.34±0.17,明显低于隐丹参酮80 μmol/L组的2.11±0.27(t=3.244,P=0.014)。隐丹参酮+Fer-1组的相对GSH水平为0.80±0.10,明显高于隐丹参酮80 μmol/L组的0.43±0.05(t=3.169,P=0.033)。Western blot检测结果显示,隐丹参酮+Fer-1组的相对xCT和GPX4水平分别为0.98±0.12和0.91±0.11,明显高于隐丹参酮80 μmol/L组的0.27±0.03(t=5.430,P=0.006)和0.14±0.01(t=6.517,P=0.003)(图3)。
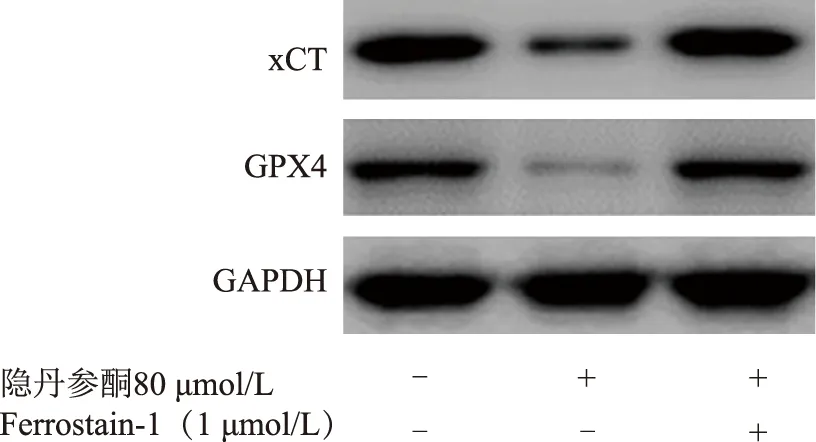
图3 Western blot检测Fer-1对HepG2细胞xCT、GPX4表达的影响Fig 3 Western blot for the expression of xCT and GPX4 in HepG2 cells treated with Fer-1
讨 论
细胞增殖失控为肿瘤细胞重要的生物学特性[19]。本研究结果显示,隐丹参酮作用于HepG2细胞后,可显著抑制细胞活力,在隐丹参酮作用下,HepG2细胞发生挛缩,并出现细胞死亡,与Park等[15]报道结果一致。此外本研究结果发现,隐丹参酮可使HepG2细胞ROS累积增加,提示其可能具有诱导HepG2细胞铁死亡的作用。
GSH是体内重要的抗氧化剂和自由基清除剂。xCT为胱氨酸-谷氨酸反向转运体的轻链亚基,负责将胱氨酸从细胞外运输到细胞内还原为半胱氨酸,参与GSH的合成[20-21]。GPX4是一种硒代半胱氨酸酶,其高表达会导致肿瘤细胞增殖受损,血管生成减少[22]。GSH可在GPX4的作用下还原ROS和活性氮[23]。研究表明,抑制xCT会导致细胞内主要的抗氧化损伤体系中GSH耗竭,进而抑制GPX-4活性,破坏细胞内氧化还原的稳定性及ROS累积,成为铁死亡的标志[24]。本研究结果显示,隐丹参酮可显著下调HepG2细胞xCT表达,降低GSH水平,亦下调GPX4表达,并诱导ROS累积。
铁死亡不能被自噬抑制剂、凋亡抑制剂所抑制,却可以被铁死亡抑制剂、铁螯合剂、ROS清除剂等所抑制,因此铁死亡是铁依赖性的[25-26]。本研究将隐丹参酮与铁死亡抑制剂Fer-1、铁螯合剂DFO、ROS清除剂NAC联合处理HepG2细胞。结果发现,不同铁死亡抑制剂分子对隐丹参酮诱导的HepG2细胞细胞活力下降均有恢复作用,以Fer-1恢复作用最为明显,提示铁死亡在隐丹参酮诱导的死亡方式中占有主要地位。本研究还检测了Fer-1对隐丹参酮诱导的HepG2细胞ROS累积,GSH水平及xCT和GPX4表达的恢复情况。结果显示,Fer-1能够抑制隐丹参酮诱导的HepG2细胞ROS累积,并能够使隐丹参酮导致的GSH水平降低及下调的xCT、GPX4表达得到恢复。以上结果进一步提示了隐丹参酮可能具有诱导HepG2细胞铁死亡的作用。
综上,本研究结果显示,隐丹参酮可能通过抑制GPX4和xCT表达使HepG2细胞中ROS累积,导致细胞发生铁死亡,这可能是隐丹参酮抗肝癌的作用机制之一。
