阿帕替尼调控SOX5/GLUT4信号轴对胃癌细胞糖酵解的影响
2021-07-09吴现磊宋锦添侯鹏飞秦二云孟妍张令巧
吴现磊 ,宋锦添 2,侯鹏飞 ,秦二云 ,孟妍 ,张令巧
(1.濮阳市油田总医院消化内科,河南濮阳 457001;2.福建医科大学附属肿瘤医院/福建省肿瘤医院消化道肿瘤内科,福建 福州 350014)
胃癌是最常见的癌症类型之一,在癌症相关的死亡人数中排名第2[1]。早期胃癌可通过手术切除进行治疗,但大部分患者确诊时已为晚期,靶向药物治疗是常用的治疗方法,对癌症基础的复杂病理生理学的深入了解和对癌症相关的分子生物标志物的识别,推动了靶向抗肿瘤药物的开发[2]。
肿瘤生长和转移过程的一个关键特征是异常的血管生成,因此,抑制肿瘤血管生成或破坏现有肿瘤血管系统的药物受到广泛关注[3]。血管内皮生长因子受体2(VEGFR2)是参与血管生成的两种酪氨酸激酶受体之一,当被其配体VEGF激活时能促进血管形成、肿瘤增殖和迁移[4]。阿帕替尼是一种小分子酪氨酸激酶抑制剂(TKI),它能高度选择性地结合并强烈抑制VEGFR-2从而达到抑制血管生成的作用[5]。一项Ⅱ期研究显示,与安慰剂相比,阿帕替尼改善了化疗难治性晚期或转移性胃癌患者的OS和PFS[6]。随机、安慰剂对照的Ⅲ期试验进一步证实阿帕替尼对至少有2种既往全身化疗失败的晚期或转移性胃癌的患者有疗效[7]。但阿帕替尼在胃癌中的下游调控网络的相关研究还不够充分,有待进一步研究完善。
SRY相关高迁移率族盒蛋白-5(SOX5)是SOX家族蛋白的一员,并作为转录因子参与胚胎的发育[8-9]。SOX5在各种类型的癌症中起重要作用。据报道SOX5可能通过与yes相关蛋白1(YAP1)相互作用而成为致癌因子,从而促进了非小细胞肺癌细胞的迁移和增殖[10]。此外,已发现SOX5可以促进2型糖尿病患者的葡萄糖代谢[11]。而GLUT4是与糖酵解相关的基因[12]。目前,已有研究表明阿帕替尼能通过抑制胃癌细胞的糖酵解调控胃癌的增殖和凋亡。但相关通路研究较少,且没有关于SOX5/GLUT4信号轴在阿帕替尼抑制胃癌糖酵解中的研究。
本研究探讨了阿帕替尼对胃癌细胞的作用,发现阿帕替尼通过SOX5/GLUT4信号轴影响葡萄糖代谢抑制胃癌细胞活力。
1 材料与方法
1.1 主要仪器和试剂
细胞代谢分析仪(美国安捷伦科技有限公司,型号Seahorse XFp);酶标仪(美国BioTek有限公司,型号ELx800);qRT-PCR荧光定量仪(美国Applied Biosystems公司,型号7900HT);乳酸比色测定试剂盒、葡萄糖摄取比色测定试剂盒(北京安诺伦有限公司);CCK-8(日本Dojindo);BCA定量试剂盒、Lipofectamine 2000(赛默飞世尔科技公司);阿帕替尼(美国MedChemExpress公司,批号YN968D1)。
1.2 细胞系来源及培养
本研究中使用的细胞系为胃癌细胞系BGC-823(BNCC337689),购自北纳生物(中国北京)。BGC-823在含谷氨酰胺的RPMI-1640培养基中培养。置于37℃,5%(φ)CO2培养箱内进行培养。阿帕替尼购自MCE(MedChemExpress)。称取50 mg阿帕替尼溶于1 mL DMSO后放入−20℃冰箱保存,使用时用RPMI-1640培养基稀释至所需浓度。
1.3 细胞转染及实验分组
重组质粒pENTER-SOX5(oe-NC)和SOX5的过表达质粒(oe-SOX5)、GLUT4的过表达质粒(oe-GLUT4)均购自Vigene Biosciences(中国济南)。根据生产商的说明通过Lipofectamine 2000(Invitro‐gen,Carlsbad,CA,USA)转染细胞。并根据本课题实验要求,分为:control组、不同浓度(0μmoL/L、10μmoL/L、20μmoL/L、30μmoL/L、40μmoL/L、50μmoL/L)阿帕替尼处理组(oe-NC+apatinib)、过表达SOX5并阿帕替尼处理组(oe-SOX5+apa‐tinib)、过表达GLUT4并阿帕替尼处理组(oe-GLUT4+apatinib)。
1.4 实时荧光定量PCR(qRT-PCR)
使用Trizol(Invitrogen)按照制造商的方案从胃癌细胞中提取总RNA。使用反转录系统试剂盒(Invitrogen)合成cDNA。qRT-PCR在ABI 7900HT仪器上进行。使用miScript SYBR Green PCR Kit(Qiagen,Germany)进行定量PCR。以GAPDH为内参分别归一化处理。所用引物见表1。结果用2−ΔΔCt值来比较对照组和实验组的目的基因相对表达量的差异。
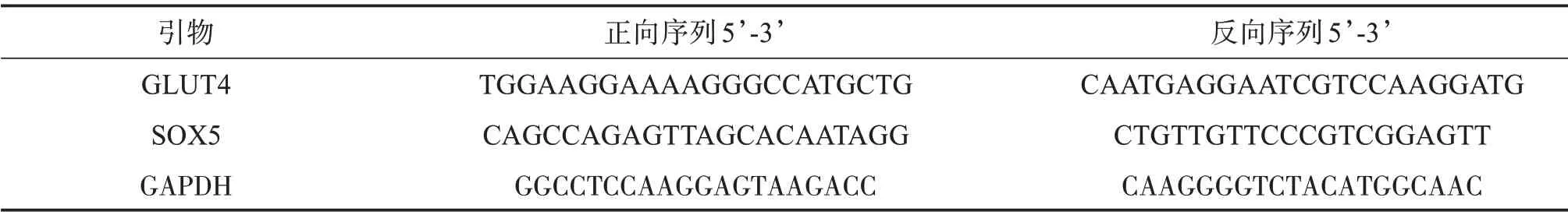
表1 引物序列Table 1 Primer sequences
1.5 Western blot实验
将各组细胞使用冷PBS洗涤3次,加入全蛋白裂解液后冰上裂解10 min,BCA定量试剂盒进行蛋白定量,然后加入10μL上样缓冲液95℃煮10 min后,于100 V进行SDS-PAGE。电泳结束后,将蛋白转移至NC膜,封闭液(5%BSA/TBST)封闭60 min。加入一抗兔抗GLUT4(abcam,USA)、SOX5(abcam,USA)、β-actin(abcam,USA),4℃过夜孵育。一抗孵育完毕后,用1×TBST溶液(Solarbio,Beijing,China)室温下摇床摇动洗膜,5 min×3次,加辣根过氧化酶标记的二抗山羊抗兔IgG(abcam,USA),室温下杂交120 min,TBST洗膜3次,每次20 min后用ECL试剂盒(Solarbio,Beijing,China)进行发光反应,拍照观察蛋白印记。
1.6 细胞增殖能力测定
CCK8法测试细胞增殖能力。将5×103个胃癌细胞接种到具有100μL培养基的96孔板中的每孔中。设置空白孔(有培养基,无细胞)和对照孔(培养基不加药,有细胞)。第2天,用不同浓度的阿帕替尼处理细胞。使用CCK-8溶液继续孵育1 h。监测48 h后的细胞存活率,并通过2次吸收后的吸光度测量评估存活细胞的数量。使用酶标仪测定450 nm各孔的吸光值。将各测试孔的吸光度A减去调零孔吸光度A或对照孔吸光度A。各重复孔的吸光度A取平均数。细胞生存率=(加药细胞吸光度A−空白吸光度A)/(对照细胞吸光度A−空白吸光度A)×100%。
1.7 糖酵解过程分析(葡萄糖摄取、乳酸生成、细胞外酸化速率)
将细胞预处理24 h,接种在96孔板中并保持过夜。去除培养基,将细胞用PBS洗涤3次,然后根据制造商的规程,使用葡萄糖摄取比色测定试剂盒测定葡萄糖摄取。为了测量乳酸,将细胞在不含酚红的DMEM中(Hyclone,USA)培养15 h,然后收集培养基。使用乳酸比色测定试剂盒对乳酸水平进行定量,并使用BCA蛋白测定试剂盒针对相应的总蛋白质水平对浓度进行标准化。为了测量细胞外酸化速率,将糖酵解压力试剂盒中的药物诱导剂分别加入加药板上的各加药孔中,其中葡萄糖、寡霉素及2-脱氧葡萄糖的使用浓度分别为10 mmol/L、1μmol/L及50 mmol/L。随后采用细胞代谢分析仪检测各组细胞的细胞外酸化速率,并计算糖酵解能力值及糖酵解保留值。
1.8 GLUT4启动子活性检测
将长度约500 bp的GLUT4基因启动子区作为pGL3-GLUT4-Promoter插入到pGL3碱性荧光素酶报告载体中。根据制造商的说明,使用QuikChange定点诱变试剂盒(Stratagene)对GLUT4启动子进行定点诱变,通过DNA测序确认突变。将100 ng构建的质粒和7 ng Renilla荧光素酶对照质粒转染到6孔板中SOX5过表达或沉默的细胞中。48 h后,使用双荧光素酶测定试剂盒(Promega,USA)测量萤火虫和海肾荧光素酶活性。利用海肾荧光素将报告荧光素酶活性结果进行标准化。
1.9 统计学分析
所有数据均采用SPSS 22.0统计学软件处理,计量资料用x±s表示,两组间比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 阿帕替尼对胃癌细胞的增殖和糖酵解的影响
检测结果显示,阿帕替尼可浓度依赖性地抑制BGC-823细胞的体外增殖(图1A)。20μmol/L阿帕替尼处理后可显著降低BGC-823细胞内葡萄糖摄取量(图1B)和乳酸生成量(图1C)。为进一步证实阿帕替尼对胃癌细胞有氧糖酵解活性的抑制作用,细胞代谢分析仪检测结果显示:与对照组相比,用阿帕替尼处理后,癌细胞外酸化速率降低。表明阿帕替尼可抑制由寡霉素(oligomycin)激活的BGC-823细胞的有氧糖酵解活性(图1D)。进一步对各糖酵解参数进行计算,发现相较于对照组,阿帕替尼处理组的BGC-823细胞糖酵解能力值及糖酵解储备值均明显下降(图1E)。这些结果表明阿帕替尼能抑制胃癌细胞的增殖和糖酵解。
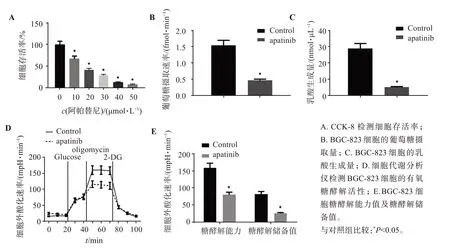
图1 阿帕替尼对胃癌细胞的增殖和糖酵解的影响Figure 1 Effect of apatinib on the proliferation and glycolysis of gastric cancer cells
2.2 阿帕替尼通过SOX5对胃癌细胞中的GLUT4启动子活性的影响
结果显示SOX5和GLUT4的表达量均随着阿帕替尼浓度的升高而下降(图2A~图2B)。20μmol/L阿帕替尼处理后,SOX5和GLUT4的蛋白表达量显著下调;阿帕替尼处理的同时过表达SOX5,SOX5和GLUT4的蛋白表达量相比于仅用阿帕替尼处理显著上调(图2C)。双荧光素酶实验检测各处理组GLUT4启动子活性,发现用阿帕替尼处理后GLUT4启动子活性显著下调;用阿帕替尼处理细胞并过表达SOX5后,GLUT4启动子活性明显高于仅用阿帕替尼处理(图2D)。这些结果表明阿帕替尼能通过SOX5调节胃癌细胞中的GLUT4启动子活性。

图2 阿帕替尼通过SOX5对胃癌细胞中的GLUT4启动子活性的影响Figure 2 Effect of apatinib on the activity of GLUT4 promoter in gastric cancer cells through SOX5
2.3 阿帕替尼通过SOX5/GLUT4信号轴对胃癌细胞的细胞活力和糖酵解的影响
qRT-PCR检测各处理组SOX5和GLUT4的mRNA表达水平,结果显示阿帕替尼处理后SOX5和GLUT4的mRNA表达水平均显著下调;用阿帕替尼处理并同时过表达SOX5后,SOX5和GLUT4的mRNA表达水平相较于仅用阿帕替尼处理均发生显著上调;用阿帕替尼处理并同时过表达GLUT4后SOX5 mRNA表达水平相较于仅用阿帕替尼处理没有显著变化,GLUT4 mRNA表达水平则发生显著上调(图3A)。CCK8检测各处理组细胞存活率,结果显示阿帕替尼处理后细胞生存率显著下调;用阿帕替尼处理并同时过表达SOX5或GLUT4后,细胞生存率相较于仅用阿帕替尼处理均发生显著上调(图3B)。比色法结果显示,阿帕替尼处理后葡萄糖摄取和乳酸生成速率均显著下调;用阿帕替尼处理并同时过表达SOX5或GLUT4后则发生显著上调(图3C~图3D)。细胞代谢分析仪检测结果显示过表达SOX5或GLUT4能逆转阿帕替尼对细胞外酸化速率的抑制作用(图3E)。进一步对各糖酵解参数进行计算,结果表明,过表达SOX5或GLUT4能逆转阿帕替尼对细胞糖酵解能力值及糖酵解储备值的抑制作用(图3F)。阿帕替尼通过SOX5/GLUT4信号轴抑制胃癌细胞的细胞活力和糖酵解。

图3 阿帕替尼通过SOX5/GLUT4信号轴对胃癌细胞的细胞活力和糖酵解的影响Figure 3 Effect of apatinib on the cell viability and glycolysis of gastric cancer cells through the SOX5/GLUT4 axis
3 讨论
胃癌是最常见的恶性肿瘤之一,估计每年全球有超过100万的新病例,同时由于胃癌的诊断往往处于晚期,其死亡率很高[1]。糖酵解是癌症的一个新特征,糖酵解产生能量和营养,并产生乳酸,为癌细胞生长提供了适当的微环境[13]。因此,靶向糖酵解是一种新的治疗策略。本研究发现阿帕替尼通过SOX5/GLUT4信号轴调控胃癌细胞糖酵解并有效抑制细胞活力。
阿帕替尼在晚期胃癌中被证实是一种安全有效的小分子抗血管生成靶向药物,也是晚期胃癌标准化疗失败后,明显延长生存期的单药[14]。已有大量报道阐释关于阿帕替尼对多种癌细胞生物学功能的调节作用。例如Liu等[15]研究发现阿帕替尼通过调节凋亡和自噬来调控胃癌细胞的生长;阿帕替尼通过下调缺氧诱导因子-1α和增加活性氧自由基水平促进胰腺癌细胞凋亡[16];阿帕替尼通过AKTmTOR途径诱导间变性甲状腺癌保护性自噬和凋亡[17]。因此,推测阿帕替尼可能通过抑制特定的细胞功能,包括糖酵解来抑制胃癌细胞的活力。本研究使用不同浓度的阿帕替尼对胃癌细胞进行处理,发现阿帕替尼处理后癌细胞的糖酵解能力和细胞活力下降。
SOX5是SOX家族转录因子中的一员,在多种癌症类型的进展中起着关键作用。据报道,SOX5通过激活twist介导的胃癌上皮-间充质转化促进细胞侵袭和转移[18];SOX5通过转激活EZH2促进乳腺癌的增殖和侵袭[19];SOX5通过STAT3信号通路诱导VEGF表达,诱导肺腺癌血管生成[20]。这表明SOX5在胃癌可能作为一种癌基因发挥作用。此外有文献报道在卵巢癌细胞中,阿帕替尼能够抑制SOX5,进而抑制GLUT4的转录活性[21]。并且GLUT4已被证明与糖酵解有关[22]。本实验数据与文献报道趋势一致,表明在胃癌细胞中阿帕替尼能够降低SOX5的表达,从而抑制GLUT4的启动子活性,来发挥其抑制糖酵解作用。
本研究结果表明,阿帕替尼可能通过抑制SOX5/GLUT4信号轴,抑制胃癌细胞糖酵解和细胞活力,为阿帕替尼调控糖酵解的机制提供了新的见解。
