高乳酸血症对脓毒症小鼠树突状细胞功能的影响及作用机制
2021-07-09赵洪强姚人骐姚咏明李为民
刘 奇,赵洪强,姚人骐,姚咏明,李为民
1 解放军医学院,北京 100853;2 解放军总医院 肝胆胰外科医学部,北京 100853;3 解放军总医院第四医学中心,北京 100048;4 解放军总医院医学创新研究部 创伤研究中心,北京 100853
脓毒症是机体对感染应答紊乱所引起的危及生命的器官功能障碍,是重症监护病房患者的主要死亡原因[1-3]。研究发现单纯的抗炎治疗并不能显著改善脓毒症患者生存及预后,而机体免疫应答障碍甚至麻痹可能是导致脓毒症患者高死亡率的主要原因[4-5]。因此,深入探讨脓毒症患者免疫功能紊乱机制对寻找有效干预靶点具有重要意义。既往研究发现树突状细胞的功能失调在脓毒症免疫抑制状态的产生与持续中起到关键作用[6-8]。树突状细胞是机体重要的抗原提呈细胞,是连接固有免疫和适应性免疫的桥梁[9]。严重脓毒症时脾组织中的树突状细胞(dendritic cell,DC)数量持续减少;同时影响DC的功能,表现为抗原提呈能力和分泌细胞因子的能力显著下降。因此,明确脓毒症暴露下DC功能障碍原因及具体分子机制,深入挖掘基于DC功能稳态的有效治疗靶点可能是逆转脓毒症免疫抑制的重要契机。乳酸作为无氧糖酵解重要中间代谢产物,对多种免疫细胞包括DC具有明显的抑制效应[10-12]。研究提示,脓毒性休克时乳酸酸中毒是组织缺氧的主要标志,其异常产生及聚集是独立于低血压和多器官功能衰竭的对脓毒症患者死亡率有较高预测价值的临床指标[13-16]。目前,乳酸对免疫细胞功能的影响及其机制研究多来自肿瘤领域,关于乳酸在脓毒症中的免疫效应鲜有报道。本研究将重点探讨脓毒症条件下乳酸对DC功能的影响,为深入认识乳酸在脓毒症下对DC的作用及干预策略提供理论依据。
材料与方法
1 实 验 动 物 179只 野 生 型 无 特 定 病 原 体 级C57BL/6小鼠,6~8周龄,体质量(20±2) g,购自北京华阜康生物科技股份有限公司(许可证号:SYXK(军)2012-0014)。小鼠适应性饲养3 d,自由饮食进水,12 h的昼夜节律,50%的环境湿度。
2 仪 器 与 试 剂 MiniMACS磁 化 细 胞 分 选 仪(Militenyi Biotec公司,德国);流式细胞分析仪(BD公司,美国);Spectra MR全功能酶标仪(DYNEX公司,美国);漩涡混合器(Vortex-5,海门市其林贝尔仪器制造有限公司,中国);96微孔板混匀仪(QB-8002,广州永程科学设备有限公司,中国);计数板以及各种规格移液器枪头(BD公司,美国);移液器(Eppendorf公司,德国);激光共聚焦显微镜(TCS SP8 DIVE,Leica公司,德国);黏附型载玻片、盖玻片及保湿暗盒(北京中杉金桥生物技术有限公司,中国);磷酸盐缓冲液(PBS),RPMI 1640培养基(北京索莱宝公司);胎牛血清(FBS,Gibco公司,美国);小鼠脏器淋巴细胞分离液(天津市灏洋生物制品科技有限公司);抗小鼠CD11c+MicroBeads(Militenyi Biotec,德国);抗小鼠CD4+T MicroBeads(Militenyi Biotec,德国);脂多糖(lipopolysaccharide,LPS;Sigma公司,美国);PerCP-Cy5.5标记抗小鼠CD80抗体(eBioscience公司,美国);APC标记抗小鼠CD86抗体(eBioscience公司,美国);FITC标记抗小鼠主要组织相容性复合体-Ⅱ(major histocompatibility complex-Ⅱ,MHC-Ⅱ)抗 体(eBioscience公司,美国);4%多聚甲醛溶液(天津市灏洋生物制品科技有限公司);小鼠白细胞介素-2(interleukin-2,IL-2)检测试剂盒(Mouse IL-2 ELISA kit),小鼠IL-4检测试剂盒(Mouse IL-4 ELISA kit),小鼠IL-12检测试剂盒(Mouse IL-12 ELISA kit),小鼠γ干扰素(interferon-γ,IFN-γ)检测试剂盒(Mouse IFN-γ ELISA kit)(北京安迪华泰科技有限公司);刀豆素A(ConA),羟基荧光素二醋酸盐琥珀酰亚胺脂试剂(CFSE),250 µg/mL 洋地黄皂苷溶液(Digitonin),0.2% 聚乙二醇辛基苯基醚(Triton X-100)(Sigma公司,美国);2%牛血清白蛋白溶液(BSA)(Gibco公司,美国);兔抗小鼠LC3B抗体,FITC标记羊抗兔IgG二抗(Cell Signaling Technology公司,美国);DAPI溶液(Thermo Fisher Scientific公司,美国);香柏油(北京博奥拓达科技有限公司)。
3 脓毒症动物模型建立 采用盲肠结扎穿孔术(cecal ligation and puncture,CLP)构建小鼠脓毒症模型,120只小鼠称重、编号,随机分为假伤组及脓毒症组。5%水合氯醛腹腔注射麻醉小鼠(30 mg/kg),麻醉成功后将小鼠仰卧位固定于手术板上,碘伏棉球消毒腹部皮肤,沿腹中线切开长约1 cm纵行切口,充分暴露盲肠,使用3号线于盲肠1/2处结扎(自盲肠根部到末端为总长度),使用5 mL注射器针头于结扎段中线处自由肠系膜缘向肠系膜对侧缘贯穿盲肠1次,并且挤出少许肠内容物,防止穿孔闭合,将盲肠轻柔的归纳于腹腔中,逐层缝合腹膜和皮肤。术毕颈部皮下予0.9%氯化钠注射液40 mL/kg抗休克治疗,术后自由进食水,保持室温恒定。假伤组小鼠开腹后暴露盲肠,还纳盲肠并逐层缝合腹膜及皮肤。
4 脾单个核细胞的提取 分别于CLP术后12 h、24 h、48 h及72 h脱颈处死小鼠(外周血乳酸检测:8只/组;树突状细胞功能评估:3只/组;激光共聚焦显微镜检测细胞内自噬形成:5只/组),59只正常小鼠用于体外实验。无菌术取出脾,置于加有胶原酶D溶液的培养皿中,剪碎后37℃孵育25 min,加入EDTA再孵育5 min。将脾组织用注射器活塞于400目钢滤网上研磨、过滤,收集滤液,1 200 r/min离心5 min,完全弃上清。用4 mL PBS重悬细胞,并缓慢加至装有等体积小鼠脏器淋巴细胞分离液的离心管中,室温中3 000 r/min离心15 min,吸取中间云雾状细胞层,PBS离心洗涤2遍后获得脾单个核细胞。
5 脾DC的分离、鉴定 采用MiniMACS免疫磁性分选系统分离、纯化DC,按照每107个单个核细胞加入40 µL PBS的比例重悬混匀细胞,以每107个细胞加入10 µL抗小鼠DC微磁珠(CD11c +microbeads)的比例加入微磁珠;充分混匀后4℃避光孵育10 min,加入10倍体积PBS离心洗涤1次,弃上清后用500 µL PBS重悬混匀。将MS分选柱置入MiniMACS磁性分选磁场中,1 mL PBS润洗1次,将500 µL细胞悬液加至MS分选柱中,让阴性细胞随液体缓慢流出,而CD11c+DC则存留于MS柱中;500 µL PBS润洗MS柱3次后,加入1 mL PBS并用活塞将存留在柱中的细胞洗脱,PBS离心洗涤两次后计数得到纯化的DC。
6 DC的分组与处理 每2×106个DC加入1 mL含10% FBS的RPMI 1640 培养基重悬,获得超过57 mL的细胞悬液。每1 mL细胞悬液加入12孔细胞培养板,每3孔为1组,共19组,放入水套式CO2培养箱过夜培养。次日9组细胞混悬液每孔分别给予0 mmol/L 、50 mmol/L、100 mmol/L乳酸刺激后放入水套式CO2培养箱24 h、48 h、72 h,观察不同浓度乳酸对DC功能的抑制效应。另将4组作为乳酸刺激组每孔,给予100 mmol/L乳酸;2组作为LPS刺激组,每孔给予1 000 ng/µL LPS;2组为LPS+乳酸刺激组,每孔给予LPS 1 000 ng/µL及100 mmol乳酸刺激;1组为乳酸+3-MA组,每孔给予100 mmol乳酸及1 mmol 3-MA刺激;1组为乳酸+Bafilomycin组,每孔给予100 mmol乳酸及1 mmol Bafilomycin刺激后放入水套式CO2培养箱48 h。上述分组分别用于观察LPS及乳酸刺激下DC的功能变化、自噬改变以及抑制自噬活性对乳酸介导DC功能障碍的影响。
7 脾CD4+T细胞的分离及纯化 通过MiniMACs免疫磁性分选系统分离CD4+T细胞,按照每107个单个核细胞40 µL PBS缓冲液的比例重悬细胞,每107个细胞加入10 µL 生物素鸡尾酒抗体,4℃避光孵育5 min。按照每107个细胞加入30 µL PBS缓冲液的比例再次重悬细胞后加入抗生物素微磁珠混匀(每107个细胞加入20 µL抗生物素微磁珠),4℃避光孵育10 min。将LS柱至于MiniMACs磁场中,3 mL PBS缓冲液润洗LS柱,加入全部细胞悬液,用PBS润洗LS柱3次,每次1 mL,收集流出液体即为CD4+T细胞。
8 通过流式细胞术检测DC表面分子CD80、CD86及MHC-Ⅱ表达 收集DC细胞,PBS离心洗涤后重悬并调整细胞浓度(5×106/mL)。取100 µL细胞悬液至于流式管中,分别加入抗小鼠CD80、CD86及MHC-Ⅱ抗体各2 µL,4℃避光孵育40~60 min;10倍体积PBS洗涤细胞2次,1 500 r/min离心5 min,弃上清,300 µL PBS重悬细胞,通过流式细胞仪检测DC表面分子CD80、CD86及MHC-Ⅱ表达情况。
9 酶联免疫吸附实验(ELISA)检测培养上清中细胞因子浓度 按照ELISA试剂盒使用说明,分别检测培养上清中IL-12、IL-4、IFN-γ和IL-2水平。酶标仪测定各孔在450 nm处测吸光度值。
10 混合淋巴细胞试验检测DC对T细胞增殖、分泌及分化的影响 将CD4+T细胞按照2×106/mL的细胞浓度用RPMI1640完全培养基重悬(含10%FBS),在刀豆蛋白A(ConA)刺激下培养24 h后,按照DC∶T=1∶100的比例加入DC后继续培养68~72 h。采用CFSE检测T细胞增殖活性;ELISA法检测共培养上清中IL-2、IL-12、IFNγ及IL-4水平,反映T细胞分泌功能,并通过分析IFN-γ与IL-4的比值评估T细胞分化方向。
11 激光共聚焦显微镜观察自噬小体的形成 收集DC,采用激光共聚焦显微镜观察细胞内自噬小体(以荧光抗体结合自噬小体的LC3 puncta成分显示)形成的数量以确定不同组内DC自噬活性的变化。将收集的DC(约2×106个)转移至流式管中。配制破膜剂:0.025% Digitonin(8.117 µL溶 于991.883 µL PBS)。每个流式管中加入200~400 µL破膜剂,冰上破膜2 min。用PBS 1 mL重悬细胞,离心洗涤3次(1 500 r/min × 5 min)后予以4%多聚甲醛室温固定细胞1 h。配制1% BSA封闭液(0.1 g的BSA溶于10 mL双蒸水)。用1%BSA封闭液室温封闭1 h。PBS离心洗涤2次,加入LC3B一抗200~300 µL(1∶200),4℃孵育过夜;PBS离心洗涤2次,避光加荧光二抗300~500 µL(1∶200),室温避光孵育1 h。PBS离心洗涤3次,将细胞混悬液40 µL中加入DAPI 10 µL,滴加于黏附型载玻片上,盖破片封片后于Leica SP8激光共聚焦显微镜下观察细胞中自噬体的形成及数目。
12 统计与分析 采用SPSS22.0统计软件对数据进行统计分析,计量资料以表示,组间比较采用单因素方差分析(ANOVA),两两比较选用Tukey检验。P<0.05为差异有统计学意义。
结 果
1 脓毒症小鼠外周血乳酸值变化规律及与DC功能变化相关性分析 正常组小鼠与假伤组小鼠的外周血乳酸值差异无统计学意义(P>0.05)。建模后12~48 h,脓毒症组小鼠的外周血乳酸值较假伤组小鼠显著增加(P<0.05),且在术后24 h达到最高值。建模后72 h脓毒症组小鼠外周血乳酸值与正常组及假伤组小鼠比较,差异无统计学意义(P>0.05)。见图1。
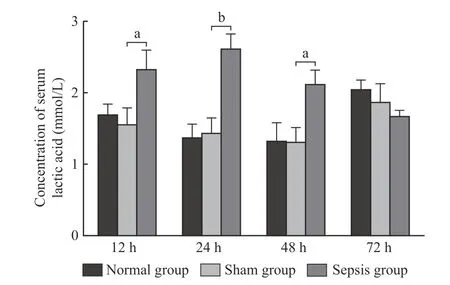
图1 脓毒症小鼠外周血乳酸浓度(aP<0.05,bP<0.01)Fig.1 Concentration of blood lactic acid in septic mice (aP<0.05,bP<0.01)
2 脓毒症小鼠DC表面分子表达及刺激T细胞炎性因子分泌情况分析 进一步分析小鼠脾DC功能发现,与假伤组比较,脓毒症24 h组小鼠脾DC出现明显活化,表现为表面分子CD80、CD86及MHC-Ⅱ的表达明显升高(P<0.05),IL-12表达及与T细胞共培养后刺激T细胞IL-2、IFN-γ及IL-4释放的水平差异无统计学意义(P>0.05)。提示脓毒症暴露24 h小鼠处在代偿阶段。观察发现脓毒症48 h小鼠脾DC功能出现明显抑制,其表面分子CD80、CD86及MHC-Ⅱ的表达明显低于假伤组小鼠(P<0.05)。同时,DC与T细胞共培养后,刺激T细胞IFN-γ的分泌显著下调(P<0.05),而IL-4并未降低甚至出现升高趋势,导致IFN-γ与IL-4的比值显著降低,T细胞向抗炎亚型Th2极化。见图2。
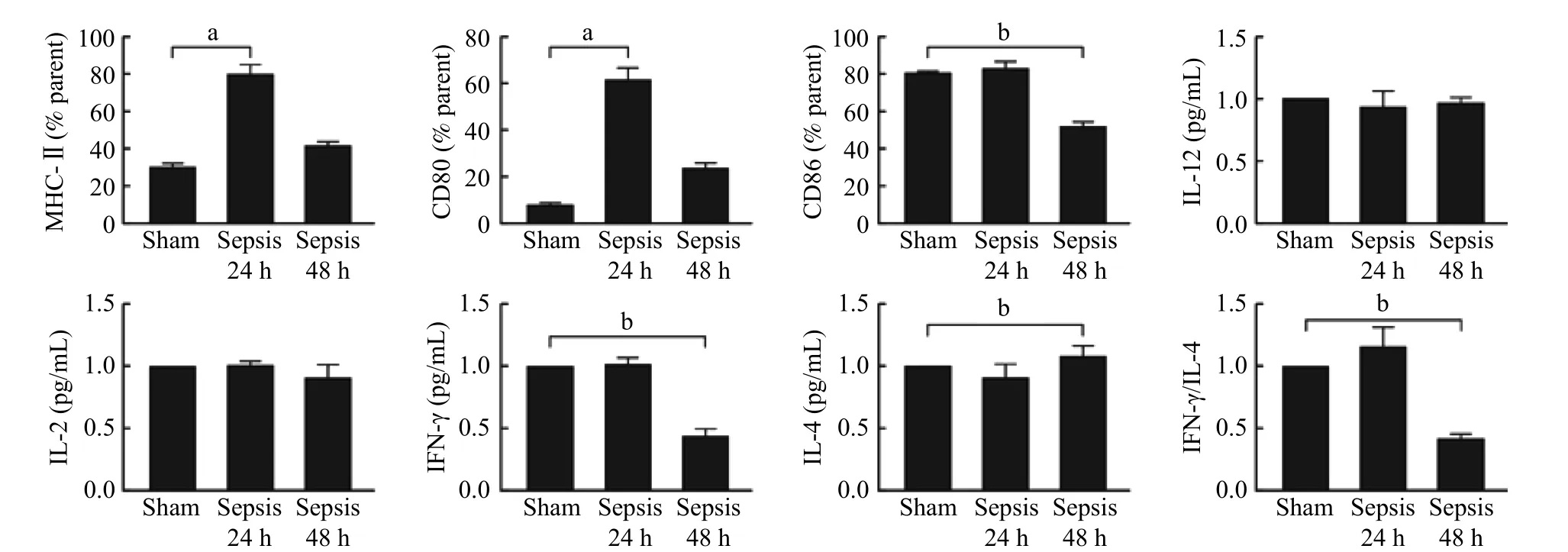
图2 脓毒症小鼠DC表面分子表达及刺激T细胞炎性因子分泌(aP<0.05,bP<0.01)Fig.2 Expression of surface molecules of DCs in septic mice and its priming activity for the cytokine secretion of T cells (aP<0.05, bP<0.01)
3 乳酸对DC功能的抑制效应 为了进一步验证脓毒症中高乳酸血症与DC功能抑制之间的关系。我们体外利用不同浓度乳酸处理DC不同时间,发现乳酸能以浓度依赖性的方式对DC功能发挥抑制效应,特别是CD80及CD86的表达出现明显下调,且100 mmol/L刺激48 h效果最为明显。见图3。

图3 乳酸刺激DC表面分子表达Fig.3 Expression of surface molecules of DC under lactic acid stimuli
4 LPS及乳酸刺激下DC的功能变化 分别采用乳酸、LPS及LPS联合乳酸刺激DC后发现,与对照组比较,LPS能明显诱导DC功能活化,其表面分子CD80、CD86及MHC-Ⅱ的表达和IL-12的释放均显著增加(P<0.05),与T细胞共培养后诱导T细胞IL-2和IFN-γ产生增加(P<0.05),并诱导T细胞向促炎表型Th1极化。然而,乳酸刺激组及LPS联合乳酸刺激组DC与假伤组及LPS组比较,功能出现明显抑制,出现表面分子CD80、CD86及MHC-Ⅱ的表达和IL12的释放显著降低(P<0.05),但两组间无明显差异。我们进一步分析DC与T细胞共培养后发现,与对照组和LPS组比较,乳酸刺激组DC刺激T细胞能力显著下降,IL-2及IFN-γ的分泌水平显著降低(P<0.05),T细胞呈现向Th2极化的现象,而LPS加乳酸刺激组DC对T细胞的抑制效应弱于单纯乳酸刺激组DC。见图4。

图4 LPS及乳酸刺激下DC的功能变化(aP<0.05,bP<0.01)Fig.4 Functional changes of DCs in response to stimuli by LPS and lactic acid (aP<0.05, bP<0.01)
5 外源性乳酸刺激DC自噬过度活化 进一步对脓毒症暴露下及乳酸和LPS刺激下的DC自噬活性进行分析发现,与假伤组比较,脓毒症24 h及48 h DC自噬活性均明显增强。DC在乳酸及LPS联合乳酸刺激下自噬活性较对照组及LPS组明显升高,提示自噬的过度活化可能是乳酸介导脓毒症时DC功能障碍的重要原因。见图5。
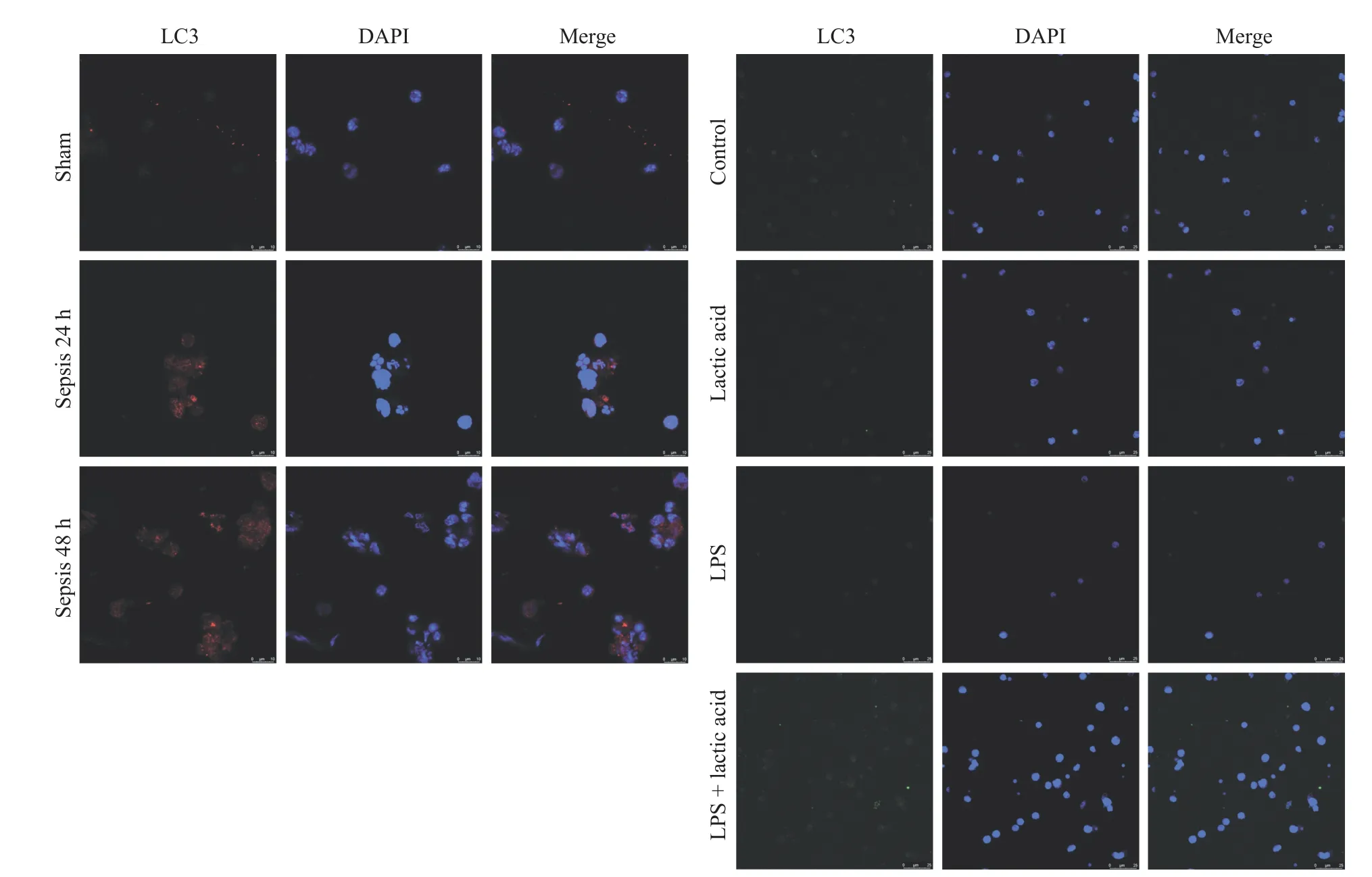
图5 激光共聚焦显微镜观察DC自噬体形成及数目Fig.5 Formation and number of autophagosomes in DC were observed by laser confocal microscope
6 抑制自噬活性对乳酸介导DC功能障碍的影响 采用流式细胞分析术检测结果显示:与乳酸组比较,乳酸加3-MA组DC表面分子CD80、CD86及MHC-Ⅱ稍增加,但无统计学差异。与T细胞共培养后,乳酸加3-MA组DC刺激T细胞IL-2及IFN-γ的分泌明显高于乳酸组DC。见图6。
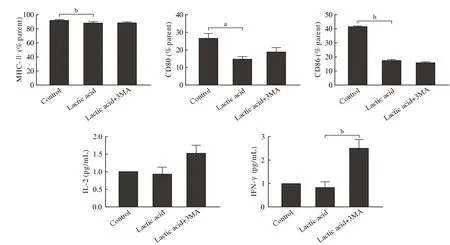
图6 3-MA改善乳酸对DC功能的抑制效应(aP<0.05,bP<0.01)Fig.6 Inhibited function of DC by lactic acid was reversed by 3-MA (aP<0.05, bP<0.01)
7 Bafilomycin改善乳酸对DC功能的抑制效应 予以Bafilomycin干预后,与乳酸组比较,乳酸加Bafilomycin组DC表面分子CD80、CD86及MHC-Ⅱ稍增加,但无统计学差异。DC与T细胞共培养后,T细胞IFN-γ的产生显著增加,而IL-2及IL-4的表达无明显差异,乳酸刺激下DC刺激T向Th2极化现象出现逆转,提示多靶点抑制自噬活性能逆转脓毒症时乳酸对DC的功能抑制效应。见图7。

图7 Bafilomycin改善乳酸对DC功能的抑制效应(aP<0.05,bP<0.01)Fig.7 Inhibited function of DC by lactic acid was reversed by Bafilomycin (aP<0.05, bP<0.01)
讨 论
脓毒症是感染、烧/创伤、休克等急危重患者的严重并发症。随着脓毒症基础实验与临床研究的蓬勃发展,初步明确机体免疫应答紊乱在脓毒症发生发展中的关键作用,维持免疫稳态,对脓毒症患者生存及预后具有重要意义。树突状细胞作为机体重要的抗原提呈细胞,其数量及功能的改变是机体免疫障碍发生的重要机制。脓毒症时DC的抗原提呈能力和分泌细胞因子的能力受到显著影响,导致其不能有效吞噬侵入机体的病原体,且难以将病原体抗原提呈给T淋巴细胞,从而导致免疫麻痹,增加机体二次感染的风险。乳酸是组织灌注障碍和氧供不足早期敏感指标,与常规血流动力学检测指标比较,乳酸水平增高对组织低灌注与缺氧具有较高的敏感度。研究发现乳酸可作为评价脓毒症严重程度及预后的指标之一,具有重要的临床意义。然而,一直以来其在脓毒症发生发展中的作用及意义并不清楚。因此,探讨脓毒症下高乳酸血症对机体免疫应答的影响及机制,不仅有助于我们理解高乳酸血症下患者机体免疫系统的功能变化,从而为临床治疗提供理论基础,而且能为脓毒症免疫障碍的发生机制提供新的研究及防治靶点,具有重要理论意义和临床实用价值。
在本研究中,我们发现脓毒症小鼠模型中外周血乳酸浓度显著增加,且在24 h及48 h最为显著。与此同时,DC表面分子MHC-Ⅱ、CD80、CD86的表达及刺激T细胞分泌在脓毒症术后48 h明显抑制,并诱导T细胞向抗炎表型Th2极化,表明乳酸的持续暴露可能是脓毒症时DC功能障碍的原因之一。我们进一步通过体外培养的方法予以乳酸刺激DC,初步掌握乳酸诱导DC功能障碍的最佳浓度与时间,明确乳酸刺激体外培养DC能显著抑制其功能活化及对适应性免疫的启动效应。业已明确,LPS作为革兰阴性杆菌的主要致病因素,是腹腔感染致脓毒症的主要致病因素。基于脓毒症动物模型及相关致病因素分析,我们进一步探讨LPS及乳酸单独和联合刺激对DC免疫功能的影响。我们发现即使在脓毒症早期LPS能显著刺激DC成熟及活化的条件下,乳酸刺激相同时间能显著抑制DC功能活化,并诱导T细胞分泌功能减弱及向Th2极化。LPS联合乳酸刺激DC表现出与乳酸刺激相同的趋势,但两者并无差异,表明乳酸可能是引起脓毒症时DC应答障碍的主要机制。
自噬对维持细胞功能稳定及生存具有重要意义。细胞自噬功能变化与脓毒症发生发展密切相关,过低或过强的自噬反应均能加剧脓毒症多器官功能障碍及不良预后[17]。我们进一步分析了脓毒症及LPS和乳酸刺激下DC自噬反应,发现脓毒症持续暴露下DC自噬活性明显升高,呈现出过度活化的趋势。体外培养DC经乳酸及LPS和乳酸联合刺激后自噬活性亦呈现过度活化,表明过度的细胞自噬可能是乳酸介导脓毒症时DC功能障碍的主要细胞内机制。我们分别采用自噬抑制剂3-MA及Bafilomycin观察发现,抑制自噬的激活及功能均能有效逆转脓毒症时乳酸对DC功能的抑制效应,进一步明确乳酸能通过诱导细胞内过度自噬介导脓毒症时DC功能障碍,联合调控乳酸及自噬水平可能是改善脓毒症时DC功能紊乱的有效手段。
本研究初步探讨了脓毒症时乳酸产生及其与DC功能障碍的关系,并以过度自噬为切入点,探讨了乳酸介导DC功能障碍的细胞内机制。该研究还存在一些局限性;1)对于脓毒症时乳酸来源并未充分阐明。前期研究表明脓毒症时机体无氧酵解活性增强,组织细胞缺血缺氧是乳酸产生的主要来源,但基于免疫微环境中具体免疫细胞是否能产生乳酸需要进一步明确。2)乳酸诱导过度自噬的具体分子机制需进一步研究。前期研究已经明确,GPR81是乳酸的主要效应受体[18],是其发挥抑炎及免疫调理效应的重要分子基础。βarrestin-2是GPR81免疫调节效应的基础,是其发挥功能的主要依赖性分子。因此,GPR81-βarrestin-2分子通路在乳酸介导细胞过度自噬中的具体作用是未来深入研究的潜在靶点。
