TGF-β信号通路抑制剂治疗OA的研究现状
2021-07-09孙艳方田发明
孙艳方 邢 磊 田发明 张 柳
华北理工大学研究生学院 河北唐山 063210;①华北理工大学附属医院老年病科;②华北理工大学医学实验研究中心;③应急总医院
骨关节炎 (osteoarthritis,OA) 是以关节软骨组织变性、软骨下骨硬化和骨赘形成为特征的一种退化性关节疾病,晚期引起滑膜组织炎及纤维化,加重关节破坏,使患者劳动能力丧失[1]。文献资料提示2020年OA已成为全球第四大致残性疾病[2]。软骨退化、软骨下骨硬化和滑膜纤维化是OA的显著病理特征,各项研究都表明,破坏的关节软骨中具有较高的基质金属蛋白酶-13(MMP-13),MMP-13是靶向软骨降解的主要酶,并在关节软骨退化过程中发挥关键作用[3]。单纯的软骨治疗不能阻止OA的进展,越来越多的研究表明软骨下骨的硬化在OA的发生和发展中也起着关键作用。软骨下骨硬化导致软骨表型改变、基质降解和软骨退变,最终导致OA。成骨细胞产生的高浓度转化生长因子-β1(TGF-β1)可导致OA的发生,下调TGF-β1可减弱OA的进展。因此TGF-β及其信号通路可能在OA发生发展中具有重要作用。OA的治疗方法主要为药物治疗,以缓解疼痛和症状,并试图改善关节组织的结构特征,但目前尚无能够中止或延迟OA的进展以及有效持久缓解症状的疗法。有研究报道抑制OA不同组织中TGF-β信号通路可减缓OA的进展。本文对TGF-β信号通路抑制剂在骨关节炎中的研究进展及应用综述如下。
1 OA中的TGF-β及其信号传导通路
TGF-β是一种多功能的多肽类细胞因子,参与细胞的增殖、生长、分化、凋亡,以及细胞外基质合成、免疫调节和组织修复等过程。TGF-β在哺乳动物体内发现3种,分别为TGF-β1、TGF-β2和TGF-β3[4]。TGF-β受体(TGF-β receptor, TβR)是跨膜复合体,分为I、Ⅱ、Ⅲ型,其中Ⅰ型受体(TβRⅠ)和Ⅱ型受体(TβRⅡ)具有丝氨酸/苏氨酸激酶活性。TGF-β1结合 TβR 的亲和力是TGF-β2的10~80倍,因此哺乳动物体内起主导作用的是TGF-β1[5]。一般情况下组织细胞产生的TGF-β处于无活性状态,但当处于酸性环境下如创伤后和感染时等,TGF-β1在MMP、整合素、纤溶酶等作用下转化为活性状态。
TGF-βRI有7个亚型,称为激活素受体样激酶1-7(ALK1-7)。生理情况下,在大多数细胞类型中,TGF-β通过与TGF-βRII和ALK5结合发出信号而激活整个通路发挥效应。研究发现TGF-β主要通过经典Smads信号通路和非经典 Smads通路如Ras-MAPK、p38蛋白和PI3K/Akt信号通路途径进行信号传导。经典TGF-β1/Smad信号通路途径:激活后的TGF-β与TβRⅡ结合,再招募TβRⅠ形成异聚复合物,然后激活下游Smad 2、3或1、5、8[6-8],磷酸化的R-Smad与Smad 4结合形成Smad复合物转运入细胞核内与 DNA 结合,调节靶基因的转录。ALK1激活Smad 1、5、8的磷酸化,刺激MMP-13的表达而ALK5激活Smad 2、3的磷酸化,刺激基质丝氨酸蛋白酶(HtrA1)的表达[9]。
小鼠膝关节中注射低剂量TGF-β1会增加关节软骨的蛋白聚糖含量,但是, TGF-β1在膝关节中的过表达会导致OA样变化,包括滑膜和骨赘增生[10]。在OA中,一方面TGF-β信号调节细胞外基质蛋白的合成和降解,控制软骨细胞的增殖和分化,抑制其肥大和成熟[11-13]。但同时TGF-β也可诱导滑膜纤维化[14],其下游因子MMP-13和HtrA1是降解细胞外基质蛋白关键降解酶,在关节软骨退变过程中起着关键作用[15]。软骨下骨中成骨细胞产生的高浓度TGF-β1直接导致软骨下间充质干细胞迁移和过度成骨分化,促进软骨下骨重塑和硬化,导致软骨应力分布不均而发生OA;滑膜细胞通过激活TGF-β信号通路发生增殖迁移以及产生细胞外基质。
2 TGF-β信号通路抑制药物对OA软骨保护作用
TGF-β信号与软骨细胞的分化密切相关,TGF-β信号通路对正常软骨细胞稳态有重要作用,但过量的TGF-β会导致OA相关的软骨破坏。抑制软骨细胞中TGF-β信号通路的药物研究包括减少TGF-β产生、阻止TGF-β与受体结合和阻扰受体激酶信号传递几个方面。因此根据影响信号通路的不同层次,TGF-β信号通路抑制药物可分为以下几类。见图1。
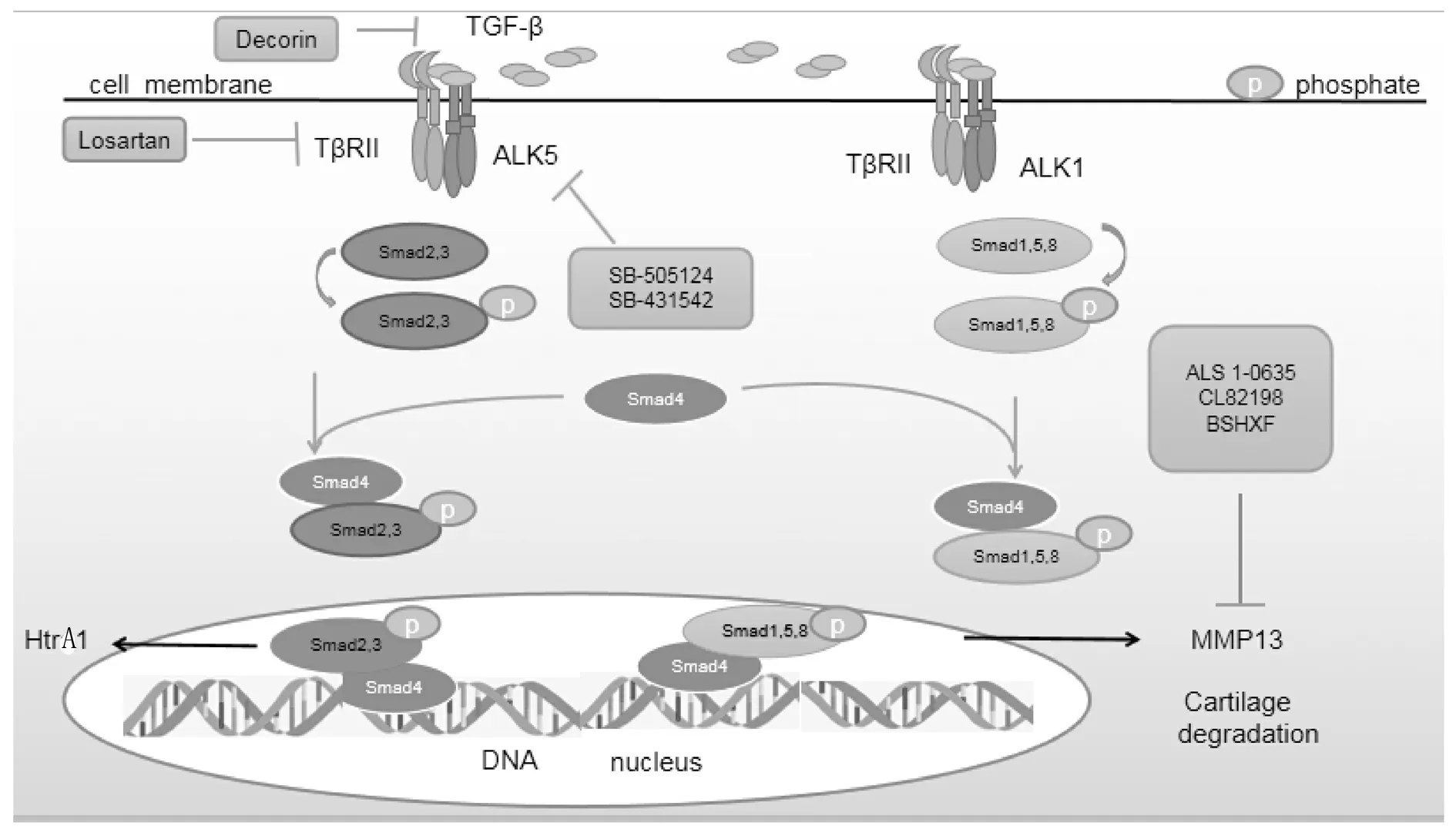
图1 骨关节炎中TGF-β介导的Smad信号路径及抑制剂作用
2.1TGF-β天然抑制剂阻止TGF-β与受体结合 Decorin是一种分布于哺乳动物细胞外基质中的富含亮氨酸的小分子蛋白多糖,也是TGF-β天然抑制剂。研究证明,Decorin的核心蛋白能与TGF-β1、TGF-β2、TGF-β3分别结合形成相应复合物,从而干扰TGF-β与相应受体结合启动TGF-β信号通路达到抗纤维化的作用[16]。在给3个月龄Decorin基因缺失和敲除的小鼠采用内侧半月板失稳(DMM)手术方法诱导PTOA模型实验中,发现Decorin基因敲除小鼠与对照组相比,软骨表面形成胶原纤维和骨赘,并且基质中硫酸化氨基多糖(sGAG)丢失增多[17]。有学者实验研究表明,在肾小球肾炎模型小鼠中注射人重组Decorin和牛血清提取的Decorin可抑制肾小球的纤维化水平,其可能机制是抑制TGF-β过度表达导致的细胞外基质的沉积。并通过体外水貂肺上皮细胞实验,发现重组人Decorin阻断水貂肺上皮细胞中TGF-β 3种亚型的生长抑制作用[18]。因此可见Decorin可延缓软骨表面的胶原和纤维的丢失,从而在软骨退变中起到保护作用;同时,Decorin也可作为抑制生物体内TGF-β过度表达的潜在有效治疗药物。通过以上研究,天然抑制剂Decorin通过阻止TGF-β与受体结合而影响该通路参与OA 的病理生理过程。
2.2阻断受体激酶信号传递的药物 SB-505124是TGF-β受体I的竞争性抑制剂,可抑制ALK5。体内研究发现,给予雄性C57BL/6J小鼠前交叉韧带切断手术(ACLT)以SB-505124干预,通过抑制TGF-β信号传导而减缓OA的进展[19]。有实验研究表明ACLT诱导大鼠OA 后,膝关节中TGF-β1水平升高,术后大鼠关节软骨降解进一步促进OA的进展;SB-505124腹腔注射治疗后,TGF-β1在大鼠膝关节中表达减少,并且关节软骨的降解也明显减少,证实了SB-505124可能通过抑制TGF-β信号通路从而延缓了大鼠骨关节炎进展[20]。同时,在该研究的体外破骨细胞和软骨细胞共培养体系中,使用SB-505124阻断TGF-β1信号转导,使Col-X、MMP-9和MMP-13等软骨退变相关标记物的水平降低、OA样改变减少,从而软骨细胞生长抑制和凋亡诱导得到明显逆转,进一步证实SB-505124通过阻断TGF-β1信号使软骨退变得到缓解。并且有学者实验研究报道,在原代牛软骨细胞培养中,进一步证实了TGF-β可诱导Smad 2、3磷酸化的受体ALK5表达,或诱导Smad 1、5磷酸化受体ALK1、ALK2和ALK3的表达,在分别加入ALK4、5、7激酶抑制剂SB-505124、ALK1、2、3激酶抑制剂LDN-193189后的结果表明,SB-505124可抑制ALK4、5、7激酶并同时降低TGF-β1诱导的Smad 1、5和Smad 2、3磷酸化及下游基因表达,而用LDN-193189抑制ALK1、2、3、6激酶但不影响TGF-β1诱导的Smad 1、5磷酸化或转录活性。更进一步证实TGF-β信号转导的小分子抑制剂SB-505124在动物模型中是通过降低软骨细胞Smad 1、5和Smad 2、3磷酸化及下游基因表达而起到软骨保护作用,可作为治疗OA的潜能药物[20]。
SB-431542是ALK5的抑制剂,同时也可抑制ALK4和ALK7,研究结果证明SB-431542是内源性激活素和TGF-β信号传导的选择性抑制剂。抑制ALK4或ALK5激酶活性可阻断TGF-β激活Smad 2和Smad 3[21]。有学者通过体外和离体实验,用重组人TGF-β1处理小鼠股骨髁关节软骨和人原代软骨细胞后,p-Smad 2、3和HtrA1表达均增加。在加入SB-431542后,TGF-β1诱导的人和小鼠关节软骨细胞HtrA1表达减少,并减少了细胞周围基质的破坏和软骨细胞代谢的改变,从而减缓OA发展[22-23]。证实SB-431542也可作为治疗OA的药物。
氯沙坦(Losartan)是血管紧张素-II受体拮抗剂,是一种治疗高血压的常见药,也可以阻断TGF-β1信号通路。M.Thomas 等实验证实,在C57BL小鼠株的cho突变诱发膝关节和颞下颌关节骨关节炎中,关节软骨组织中TGF-β1和HtrA1会升高,从而继发HtrA1降解周围基质并引起II型胶原和含有盘状结构域的受体暴露和激活,同时MMP-13释放,破坏细胞外基质蛋白,导致软骨组织的破坏。氯沙坦治疗小鼠后,软骨细胞中HtrA1的表达和骨关节炎的相关病理组织产生显著减少。因此氯沙坦在动物软骨中有保护作用[24]。Rebecca Chen等在给野生型小鼠跑台运动和DMM后,用TGF-βR2抑制剂氯沙坦治疗也表现出小鼠关节软骨组织退化减少,对小鼠的膝关节起到保护作用[25]。证实氯沙坦也可作为治疗OA的药物。
综上所述,ALK抑制剂SB-505124、SB-431542和氯沙坦在动物模型中通过阻断激酶活性而表现出保护关节软骨的作用,可作为减缓OA机制的候选治疗药物。
3 TGF-β信号通路抑制药物对OA软骨下骨的保护作用
关节软骨与软骨下骨是一个整体功能单元,关节软骨可减缓超重负荷引起的生物力学损伤,而其稳态和完整性与软骨下骨的生化和生物力学相关。在OA发生和发展中,软骨下骨起着关键作用,且软骨下骨的变化比软骨出现更早[26]。生理状态下,TGF-β1是骨吸收和形成的重要耦合因子,破骨细胞骨吸收反应释放的活性TGF-β1通过SMAD信号诱导人和小鼠成骨细胞从血管周围龛位迁移到骨表面,进行成骨细胞分化。在OA发生发展中,活性破骨细胞通过分泌盐酸和蛋白酶(主要是H+,Cl-和半胱氨酸蛋白酶、组织蛋白酶K)在软骨下骨中发挥分解代谢作用,对于TGF-β从骨基质中释放至关重要。当机械负荷改变时,TGF-β1被过度激活,过度表达的TGF-β1会招募骨髓间充质干细胞(Bone marrow mesenchymal stem cells,BMSCs)在骨髓中形成异常的骨样胰岛[27-28],并且软骨下骨会出现异常血管充血。研究发现骨样胰岛内血管系统是H型血管,可以通过药物预防病理性H型血管生成来延缓OA的进展。表明在OA早期靶向软骨下骨改变可能是减缓关节软骨退行性病变的一种有效预防策略。
CD4+T辅助细胞亚群Th17可产生白细胞介素17(IL-17)。IL-17诱导滑膜成纤维细胞表达RANKL,与破骨细胞前体细胞表面RANKL结合后导致破骨细胞分化, 从而开始骨破坏过程。
小分子氟哌酮(Droperidone,HF)是从治疗疟疾的中草药中分离出来的一种药物[29-30],是退热药的衍生物,被批准为治疗硬皮病和杜氏肌营养不良症(Duchenne muscular dystrophy,DMD)。HF通过靶向早期OA的软骨下骨病理特征可减弱OA的进展。HF阻止软骨下骨的变化,通过减少Th17诱导的破骨细胞骨吸收、减少骨基质中TGF-β释放并抑制其信号传导来减少异常骨形成、减少H型血管的形成三种途径。实验研究表明HF通过激活氨基酸饥饿反应可抑制Th17细胞分化[31],从而阻断Th17诱导的破骨细胞骨吸收。有学者实验研究发现,给予小鼠口服灌胃HF可恢复骨重建,可减少TGF-β从骨矿物基质中的释放和活化并抑制早期OA软骨下骨的异常血管生成,减少骨吸收,从而进一步抑制骨样胰岛的形成。并且有学者在体内和体外研究中发现,HF通过抑制血管生成级联过程(如MMP-2表达、基底膜侵袭、毛细血管形成和内皮下细胞外基质沉积)可减少H型血管生成[32]。Cui等在啮齿动物OA模型中,腹腔注射HF后,也证实通过靶向降低软骨下骨TGF-β1活性可减弱OA进展[33]。
SB-505124是TGF-β受体I的竞争性抑制剂(TβRI抑制剂),破骨细胞骨吸收过程中释放的活性TGF-β1诱导BMSCs迁移。研究发现SB-505124以浓度依赖性的方式阻断BRCM诱导的BMSCs迁移,表明TGF-β1通过与TβRI结合后激活SMAD信号通路诱导BMSCs迁移。TGF-β1浓度减少可降低BMSCs对骨重构表面的招募。TβRI抑制剂抑制成骨细胞簇的形成可使BMSCs分布更加均匀,使其能够对破骨细胞骨吸收做出反应,从而促进骨形成和吸收的耦合[34-35]。减缓软骨下骨的破坏。
异甘草酸生成素(Isoglycyrrhizin ,ISL)是一种从甘草中提取的天然类黄酮。一方面,ISL抑制OA早期软骨下骨的异常重塑,包括可通过靶向成骨前体RANKL-RANK-TRAF6信号通路抑制破骨细胞生成,从而抑制骨髓中TGF-β的过度释放来延缓OA发展。另一方面,ISL通过直接抑制MMP-2,间接抑制TGF-β信号传导,减少软骨下骨的异常微血管形成。这些结果表明,ISL早期靶向治疗ACLT OA小鼠模型中的软骨下骨,OA有较好的治疗效果,提示这可能是一种潜在的OA治疗药物[36]。
青蒿琥酯(Artesunate ,ART)是一种抗疟疾药物,是青蒿素的衍生物,具有多种生物活性,用于治疗从疟疾到类风湿性关节炎的各种疾病。当机械负荷改变时,TGF-β1被过度激活,过度表达的TGF-β1会招募BMSCs在骨髓中形成异常的骨样胰岛,并且软骨下骨会出现异常血管充血。ART通过减少TGF-β释放、恢复耦合的骨重塑来抑制骨吸收。实验表明激活内皮祖细胞中的TGF-β信号可诱导血管生成,降低TGF-β1活性可减少OA小鼠软骨下骨的血管生成。因此,ART可通过阻断TGF-β信号传导来抑制异位骨形成以及消除早期OA软骨下骨中异常血管的形成,减轻软骨下骨的退化[37]。
综上所述,HF、SB-505124、ISL、ART通过抑制TGF-β1的产生以及其信号通路而表现出保护关节软骨下骨的作用,可作为减缓OA机制的候选治疗药物。
4 TGF-β信号通路抑制药物对OA滑膜的保护作用
OA滑膜的特征是滑膜出现炎症和纤维化。滑膜细胞通过激活TGF-β信号通路发生增殖迁移以及产生细胞外基质。滑膜细胞产生的透明质酸(Hyaluronic acid,HA)是一种由膜结合的透明质酸合成酶(Hyaluronic acid synthase,HAS)合成的糖胺聚糖,而产生的蛋白多糖-4(Proteoglycan-4,PRG4)是一种高度糖基化的黏液糖蛋白。HA和PRG4在关节润滑中起重要作用,也可能在关节纤维化中发挥作用。在滑膜细胞中,TGF-β1诱导细胞增殖和I型胶原积聚为特征的纤维化改变。TGF-β1也会刺激滑膜细胞中胶原蛋白I(Collagen I,COL1A1),α-平滑肌肌动蛋白(alpha-smooth muscle actin,α-SMA),金属蛋白酶组织抑制剂(Tissue inhibitor of metalloproteinases,TIMP)-1和胶原蛋白赖氨酸,2-氧戊二酸5-双加氧酶2(2-oxoglutarate 5-dioxygenase 2,PLOD2)的表达。此外,TGF-β1促进OA滑膜细胞分化以α-SMA为特征的肌成纤维细胞样表型。肌成纤维细胞具有增强产生胶原、增殖和迁移的能力。
腺苷-3′,5′-环磷酸腺苷(Adenosine-3′,5′-cyclic adenosine phosphate ,cAMP)是腺苷酸环化酶(Adenylate cyclase,AC)在激活后产生的多效性细胞内第二信使[38]。AC激活剂Forskolin对TGF-β1刺激的OA滑膜细胞模型中α-SMA和I型胶原、TIMP-1、PLOD2、HAS亚型的表达以及HA和PRG4的表达产生影响。Forskolin直接与AC结合并由ATP生成cAMP,cAMP的增加导致蛋白激酶A(PKA)依赖性和非依赖性途径的激活。在生长因子的存在下,Forskolin激活cAMP依赖性PKA,PKA激活的CREB与TGF-β1刺激的SMAD介导的转录辅因子竞争,阻断TGF-β1诱导的下游信号通路。研究结果证实Forskolin可增加细胞内cAMP,细胞渗透cAMP类似物处理后可降低TGF-β1刺激的OA滑膜细胞ACTA2和COL1A1的表达,并且增强HA和PRG4的分泌。因此Forskolin可降低TGF-β1诱导的OA滑膜细胞增殖和迁移以及OA滑膜细胞肌成纤维细胞样表型[38]。但目前cAMP和TGF-β1之间机制尚不清楚。
一型胶原是纤维化的主要成分,在TGF-β诱导的纤维化和胶原酶诱导的OA相关纤维化中,赖氨酰羟化酶2b(Lysyl hydroxylase 2b, LH2b)基因表达和LH2蛋白均被诱导,LH2b是OA纤维化持续的原因。研究发现,一些纤维化疾病的成纤维细胞中Plod2/LH2b mRNA表达水平增加。LH2b使胶原蛋白不易被酶降解。在OA的早期选择性阻断LH2b可以防止吡啶交联的形成,从而阻止滑膜细胞持续性纤维化。在OA滑膜细胞中,TGF-β通过ALK5-Smad 2、3诱导PLOD2/LH2,导致滑膜出现纤维化。SB-505124可抑制TGF-β诱导的PLOD2和COL1A1,阻断TGF-β诱导的滑膜的纤维化作用。
综上所述Forskolin、SB-505124通过抑制TGF-β1产生以及其信号通路而表现出保护关节滑膜的作用,可作为减缓OA机制的候选治疗药物。
5 结论
OA作为第四大慢性致残性疾病,目前针对OA发病机制的药物比较少。由于TGF-β信号通路在早期软骨、软骨下骨以及滑膜发育和维持稳态中起着关键作用,且TGF-β信号通路在OA进展中起到重要作用,表明TGF-β信号通路抑制剂是治疗OA的合适分子靶点。因此减少TGF-β产生和阻断TGF-β信号通路药物可阻断OA的进展,使OA从根本上得到改善。然而,具有抑制OA潜能的各项抑制剂,大多证明可以减轻OA进展,但目前各药物的副作用及生物利用度是否适用于人类还未知,缺乏临床试验,需要进一步探索。
