HCBP6模拟磷酸化对肝细胞内三酰甘油合成的调控作用
2021-07-09杨雪亮刘小静刘顺爱蔺淑梅
杨雪亮,刘小静,韩 铭,刘顺爱,成 军,蔺淑梅
(1. 西安交通大学第一附属医院营养科,陕西西安 710061;2. 西安交通大学第一附属医院感染科,陕西西安 710061;3. 首都医科大学附属北京地坛医院传染病研究所,北京 100020)
随着经济水平的提高,人们的饮食结构、生活方式及生活习惯均发生明显的改变, 脂肪性肝病的发病率在我国逐年上升,严重威胁人民的健康。代谢相关脂肪性肝病(metabolism-associated fatty liver disease, MAFLD)是最常见的一种脂肪性肝病,普通成人MAFLD患病率高达15%~30%,现在MAFLD已取代乙型肝炎,成为我国的第一大慢性肝病[1]。目前由于MAFLD的发病机制尚不清楚,故尚无特异性治疗MAFLD的药物。因此,深入探讨MAFLD发生的分子机制,尤其肝细胞中三酰甘油合成的分子机制,对治疗MAFLD具有重要意义。
三酰甘油的摄入、生成、分解的异常均能引起MAFLD。胆固醇调节元件结合蛋白(sterol-regulatory-element-binding protein, SREBP)是一种结合在内质网膜上的转录因子,能够激活胆固醇和三酰甘油生物合成相关酶的表达[2]。SREBP有3种异构体:SREBP1c、SREBP1a、SREBP2[3],其中SREBP1c促进肝内三酰甘油生成[4]。脂肪酸合成酶(fatty acid synthase, FASN)与乙酰辅酶A羧化酶(acetyl-CoA carboxylase, ACC1)是促进脂肪酸合成的关键酶,是三酰甘油生成中不可缺少的酶。SREBP1c通过上调FASN、ACC1表达,促进三酰甘油生成[5]。HCV结合蛋白6(hepatitis C binding protein 6, HCBP6)是本课题组通过酵母双杂交技术发现的一种HCV核心蛋白结合蛋白[6]。前期研究发现,HCBP6能够结合在SREBP1c启动子区域,通过促进SREBP1c基因转录,增强SREBP1c-FASN 信号通路表达,促进三酰甘油生成[7]。
通过改变代谢酶的表达水平、控制底物的反应动力学或产物的浓度、进行蛋白质翻译后修饰均能促进机体的代谢,其中蛋白磷酸化是一种重要的蛋白质翻译后修饰手段[8]。蛋白磷酸化位点通常在丝氨酸和苏氨酸。HCBP6是一种富含丝氨酸的蛋白。UniProt数据库预测HCBP6的第10位、第151位丝氨酸(Ser-10、Ser-151)可能存在磷酸化。本研究利用定点突变技术,模拟Ser-10、Ser-151磷酸化与去磷酸化,探讨HCBP6模拟磷酸化对肝细胞内三酰甘油的调控作用。
1 材料与方法
1.1 主要试剂及引物HepG2细胞、pcDNA3.1/myc-his(-)质粒、pGL4.10-basic质粒、pcDNA3.1-HCBP6质粒为北京地坛医院传染病研究所保存。快速定点突变试剂盒购自北京全式金公司。总RNA提取试剂盒购自美国Omega公司,逆转录试剂盒购自美国Promega公司,SYBR Green qPCR Master Mix购自美国ABI公司。SDS-PAGE 凝胶制备试剂盒购自北京康为世纪生物科技有限公司,M-PERTM Mammalian Protein Extraction Reagent购自美国Thermo公司,Cocktail of Protease Inhibitors购自美国Roche公司,BCA蛋白浓度测定试剂盒购自美国Thermo公司,Pierce©ECL显色试剂盒购自美国Thermo公司,PVDF膜购自美国Millipore公司,HCBP6兔多克隆抗体购自英国Abcam公司,SREBP1c兔单克隆抗体购自中国台湾Abnova公司,FASN兔单克隆抗体购自英国Abcam公司,ACC1兔单克隆抗体购自英国Abcam公司,Phospho-ACC1兔单克隆抗体购自美国Cell Signaling Technology公司,GAPDH兔单克隆抗体购自英国Abcam公司,HRP 标记的羊抗兔抗体购自北京中杉金桥公司,双萤光素酶报告基因试剂盒购自美国Promega公司,三酰甘油检测试剂盒购自美国Sigma公司,油红O购自美国Sigma公司,jetPRIME转染试剂购自法国Polyplus公司。
实验中所有引物均由苏州泓迅公司(北京)合成,所有的引物序列见表1所示,其中以β-actin作为qRT-PCR的内参,qRT-PCR的产物的计算采用相对定量法,即2-ΔΔCT法。qRT-PCR反应条件:预变性95 ℃ 10 min;95 ℃ 15 s;60 ℃ 1 min,40个循环。

表1 qRT-PCR引物序列
1.2 HCBP6第10位与第151位丝氨酸模拟磷酸化与去磷酸化HCBP6第10位、第151位是丝氨酸,采用UniProt数据库预测这两个位点可能存在磷酸化,通过点突变,将丝氨酸突变为丙氨酸,使得HCBP6持续去磷酸化;将丝氨酸突变为天冬氨酸,使得HCBP6持续磷酸化。其中HCBP6不同类型质粒如下所述:HCBP6野生型质粒p-HCBP6;HCBP6第10位氨基酸去磷酸化质粒p-HCBP6 10Ala(p-10Ala);HCBP6第10位氨基酸磷酸化质粒p-HCBP6 10Asp(p-10Asp);HCBP6第151位氨基酸去磷酸化质粒p-HCBP6 151Ala(p-151Ala);HCBP6第151位氨基酸磷酸化质粒p-HCBP6 151Asp(p-151Asp)。以野生型pcDNA3.1-HCBP6质粒为模板,采用Primer X数据库进行点突变引物设计,利用快速点突变试剂盒,通过PCR反应、PCR产物消化、转化及转染级质粒提取,成功构建HCBP6不同位点磷酸化质粒。
1.3 细胞内三酰甘油含量的测定复苏的肝癌细胞系HepG2细胞,采用100 mL/L胎牛血清的DMEM培养基,50 mL/L CO2的37 ℃培养箱培养,待细胞传至3~4代,细胞轮廓清楚,细胞饱满时,将HepG2细胞铺在6孔板,进行质粒转染。采用三酰甘油检测试剂盒测定三酰甘油含量。
1.4 油红O染色取6孔板,每孔放1块爬片,将培养好的HepG2细胞铺板并进行质粒转染。40 g/L的多聚甲醛室温固定细胞30 min,配好的油红工作液室温染色30 min,600 mL/L的异丙醇快速清洗细胞,用PBS轻轻清洗细胞2次,显微镜下观察染色的情况。再用配好的苏木素染液进行细胞核染色5 min,用PBS反复清洗细胞,至显微镜下观察细胞内脂滴,其中三酰甘油染成红色。
1.5 qRT-PCR及Western blotting检测将HepG2细胞铺在12孔板或者6孔板,采用jetPRIME转染试剂进行质粒转染,转染24 h,收获12孔板的细胞,qRT-PCR检测SREBP1c、ACC1及FASN mRNA的表达情况;转染48 h,收获6孔板的细胞,提取细胞总蛋白,采用BCA法检测蛋白浓度,然后蛋白变性后进行凝胶电泳、电转印、抗体孵育并曝光,检测SREBP1c、ACC1及FASN蛋白的表达情况。
1.6 启动子活性检测将HepG2细胞铺在48孔板,将成功构建的SREBP1c核心启动子P2萤光素酶报告基因载体及HCBP6不同类型质粒共同转染24 h后,采用双萤光素酶报告基因试剂盒进行报告基因的活性检测。

2 结 果
2.1 HCBP6 Ser-10磷酸化促进三酰甘油生成图1显示,转染p-10Asp的HepG2细胞内三酰甘油水平高于转染p-10Ala(P=0.001)或p-HCBP6(P=0.005),而转染p-151Asp与转染p-151Ala的HepG2细胞内的三酰甘油水平无明显区别(P=0.062),且二者均低于转染p-HCBP6;图2显示,转染p-10Asp的HepG2 细胞内脂滴多于转染p-10Ala或p-HCBP6,而转染p-151Asp与转染p-151Ala的HepG2细胞内脂滴低于转染p-HCBP6,且二者细胞内蓄积的脂质无明显区别,说明HCBP6 Ser-10磷酸化促进三酰甘油生成。

图1 HCBP6不同位点磷酸化对细胞内三酰甘油水平的影响
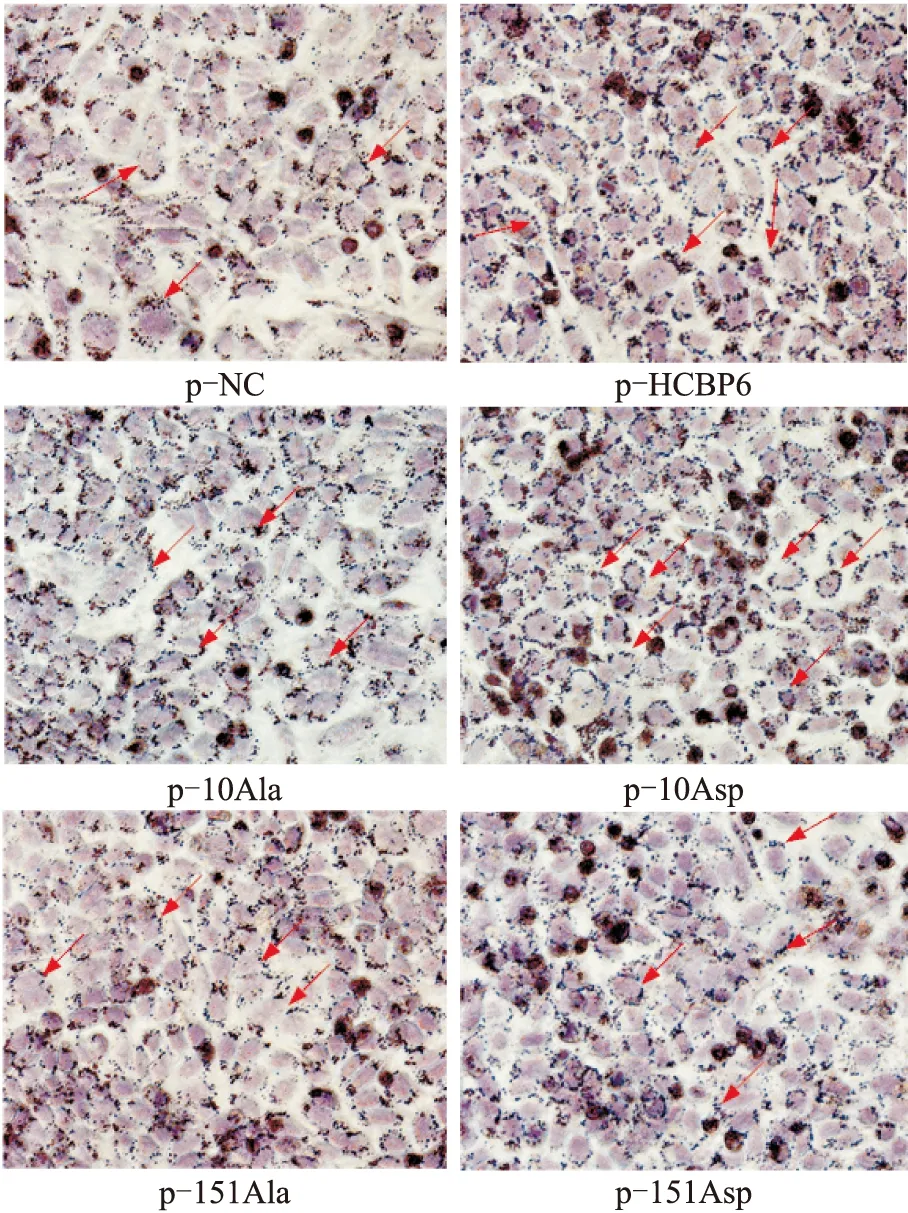
图2 HCBP6不同位点磷酸化对细胞内脂质生成的影响
2.2 HCBP6 Ser-10磷酸化能增强SREBP1c-FASN信号通路表达图3A显示,在p-10Asp转染24 h后,HepG2细胞SREBP1c的mRNA表达水平较p-10Ala上升约46%(P<0.001),较p-HCBP6组表达水平上升约96%(P<0.001),而转染p-151Asp与转染p-151Ala的HepG2细胞的SREBP1c的mRNA表达水平无明显变化(P=0.675),且二者均低于转染p-HCBP6;图3B结果显示,在p-10Asp转染24 h后,HepG2细胞的FASN的mRNA表达水平较p-10Ala仅上升11%,但较p-HCBP6组表达水平上升69%(P=0.01),而转染p-151Asp较转染p-151Ala的HepG2细胞的FASN的mRNA表达水平上升约3倍(P=0.002),但是较p-HCBP6表达水平无明显上升(P=0.428);图3C结果显示,在p-10Asp转染24 h后,HepG2细胞的ACC1的mRNA表达水平较p-10Ala与p-HCBP6组均未见明显增加(P=0.947,P=0.108),且转染p-151Asp与转染p-151Ala的HepG2细胞的ACC1的mRNA表达水平无明显变化(P=0.213),且二者均低于转染p-HCBP6。综上所述,HCBP6 Ser-10磷酸化,促进SREBP1c、FASN的mRNA表达,而HCBP6 Ser-151磷酸化对SREBP1c、FASN的mRNA表达无明显影响。

图3 HCBP6不同位点磷酸化对SREBP1c-FASN-ACC1 mRNA的影响
如图4所示,转染p-10Asp的SREBP1c、p-ACC1、FASN的蛋白表达均较转染p-10Ala显著上调,而转染p-151Asp的SREBP1c的蛋白表达较转染p-151Ala减少,转染p-151Asp的FASN的蛋白表达较转染p-151Ala增加,转染p-151Asp与p-151Ala的p-ACC1的蛋白表达无明显区别。综上所述,HCBP6 Ser-10磷酸化,促进SREBP1c、ACC1、FASN的蛋白表达,而HCBP6 Ser-151磷酸化对SREBP1c、ACC1、FASN的蛋白表达无明显影响。
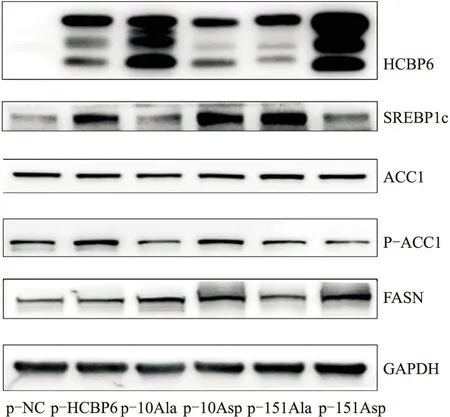
图4 HCBP6不同位点磷酸化对SREBP1c-FASN-ACC1的蛋白的影响
2.3 HCBP6 Ser-10磷酸化后可能富集于SREBP1c启动子区域,促进SREBP1c转录翻译图5结果显示,在p-10Asp转染24 h后,HepG2细胞的SREBP1c核心启动子P2相对活性较p-10Ala上升约57%(P=0.003),较p-HCBP6组上升约44%(P=0.004),而转染p-151Asp较转染p-151Ala的HepG2细胞的启动子P2相对活性无明显变化(P=0.104)。综上所述,HCBP6 Ser-10磷酸化,增强SREBP1c核心启动子P2活性,而HCBP6 Ser-151磷酸化对SREBP1c核心启动子P2活性无明显影响。
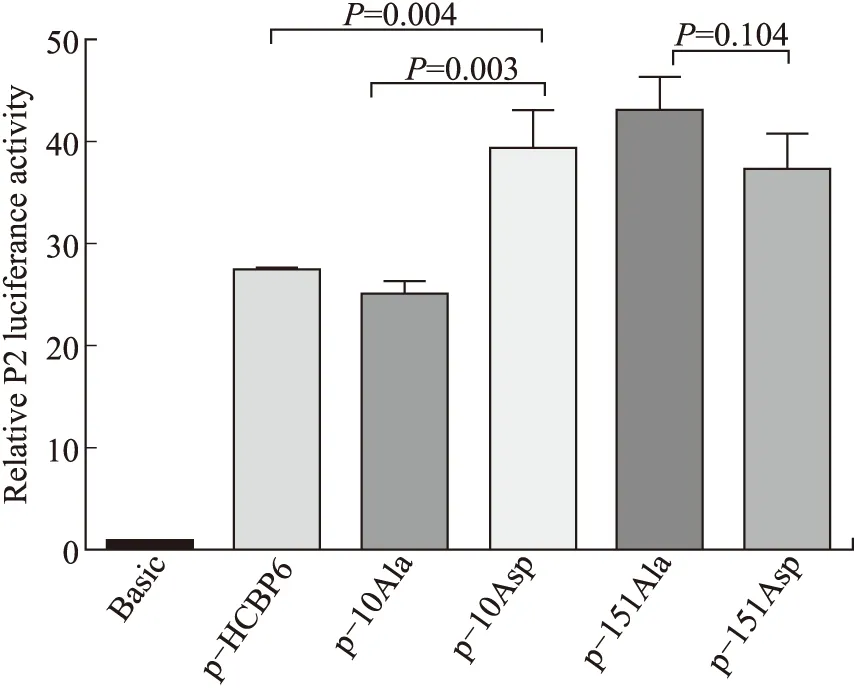
图5 HCBP6不同位点磷酸化对SREBP1c核心启动子P2活性的影响
p-ACC1是磷酸化的ACC1,GAPDH作为分子内参。p-NC为空质粒;p-HCBP6为野生型HCBP6质粒;p-10Ala为 HCBP6第10位去磷酸化质粒;p-10Asp为HCBP6第10位磷酸化质粒;p-151Ala为HCBP6第151位去磷酸化质粒;p-151Asp为HCBP6第151位磷酸化质粒。
3 讨 论
HCBP6是本课题组通过酵母双杂交技术筛选到的与丙型肝炎病毒(HCV)核心蛋白结合的一种新蛋白[9]。早期将众多的可以与HCV核心蛋白结合的蛋白进行生物信息学分析,发现很多的已知蛋白基因,如载脂蛋白A1(APO-A1)、载脂蛋白A2(APO-A2)等[10]。根据以上研究结果,HCV感染与肝脏脂肪变的研究开始受到重视,为HCV感染引起肝脏脂肪变性提供许多证据,发现慢性丙型肝炎与肝脏脂肪变密切相关[11-12]。研究证实,HCV 核心蛋白在丙型肝炎病毒引起的脂肪性肝病发病机制中起重要作用[13-14]。HCBP6作为其中的一种HCV核心蛋白结合的蛋白,生物信息学预测HCBP6可能调控与肝细胞信号转导、增生、分化及生长调节等密切相关的基因[15]。这高度提示HCBP6作为HCV核心蛋白的结合蛋白可能在脂肪性肝病的发病机制或脂质代谢中起重要作用。通过分子、细胞及动物水平研究发现,HCBP6对肝细胞内胆固醇和三酰甘油代谢均具有调节作用[7,16-17]。
蛋白磷酸化是最常见、最重要的一种翻译后修饰,参与并调节机体的多种生命活动。既往研究发现,参与三酰甘油合成与代谢的蛋白通过不同位点磷酸化发挥调控作用。如早期研究发现,脂肪三酰甘油脂酶(adipose triglyceride lipase, ATCL)是一种磷酸化的蛋白酶,分别在Ser-406与Ser-430存在磷酸化位点[18],其中AMPK促使Ser-406磷酸化,从而激活ATGL酶,促进三酰甘油水解[19]。ACC1是脂肪酸合成与代谢中重要的中间产物,其中Ser-66、Ser-79、Ser-117分别存在磷酸化。研究发现,胰岛素与酪氨酸激酶共同作用,促进脂肪细胞的ACC1 Ser-66磷酸化[20],AMPK促进ACC1 Ser-79磷酸化[21],而PKA促进Ser-117磷酸化[22],降低ACC1活性。UniProt数据库预测HCBP6可能也是一种磷酸化蛋白,其中的Ser10、Ser151可能存在磷酸化。
蛋白磷酸化位点通常在丝氨酸和苏氨酸,将这些氨基酸利用定点诱变的方式突变为丙氨酸后持续去磷酸化,这是因为丙氨酸是非极性氨基酸,永远都不会发生磷酸化,而将丝氨酸或者苏氨酸突变为谷氨酸或者天冬氨酸后将持续磷酸化,这是因为谷氨酸与天冬氨酸是带有羧基侧链,本身具有负电荷的极性氨基酸,这与蛋白磷酸化非常类似,因此一定程度上模拟了磷酸化所产生的物理化学效应,一定程度上激活底物,是一种模拟磷酸化状态的技术手段。早在1993年,MORRISON等[23]将表皮生长因子受体EGFR的Thr-654与Thr-669定点突变为Glu-654与Glu-669模拟EGFR磷酸化,研究EGFR的Thr-654与Thr-66磷酸化受到PKC与MAPK调控。2005年YANAGAWA等[24]将磷酸葡萄糖异构酶PGI的Ser-185定点突变为Glu-185、Asp-185、Ala-185,证实PGI通过磷酸化调节酶活性。2018年JOOS等[25]发现组蛋白H3 Ser28定点突变为Ala-28模拟H3去磷酸化,显示H3去磷酸化后能延长寿命、提高抗饥饿能力、减少氧化应激反应。说明利用定点突变技术,模拟蛋白磷酸化是一项得到长久和广泛应用的技术,是一种被认可的蛋白修饰技术。
本研究通过该手段模拟HCBP6的Ser-10、Ser-151磷酸化与去磷酸化,发现当HCBP6 Ser-10磷酸化后增强SREBP1c-FASN信号通路表达,促进细胞内三酰甘油生成;抑制HCBP6磷酸化,减少肝细胞内三酰甘油生成。这可能是未来治疗MAFLD的分子靶点。
