晚期NSCLC患者血清8-OHdG与放化疗联合治疗近期疗效相关性分析
2021-07-08刘晓霞郭旭丽苏镇军贾金海段晓辉贺晓磊吕林林李卫霞李志加王云晓
刘晓霞,郭旭丽,苏镇军,贾金海,段晓辉,贺晓磊,吕林林,王 平,李卫霞,李志加,王云晓
(1.河北工程大学医学院,河北 邯郸 056038;2.河北工程大学附属医院,河北 邯郸 056002;3.河北医科大学,河北 石家庄 050017)
晚期非小细胞肺癌(non-small cell lung cancer, NSCLC)确诊时往往失去最佳手术时机,主要以放化疗联合的综合方案进行治疗,但大多数患者疗效不佳,预后较差,及早预测疗效有助于指导临床制定合理的治疗方案。8-羟基脱氧鸟苷(8-hydroxy-2 deoxyguanine, 8-OHdG)被认为是DNA损伤的可靠标记物,在组织、尿液、血液中均可被检测到[1]。其表达水平的升高与慢性阻塞性肺疾病[2]、糖尿病肾病[3]、帕金森病[4]、肿瘤[5-7]等疾病的病理过程有关;与疾病的诊断、预测有一定的相关性,有学者认为其可作为相应疾病辅助诊断的标志物[8-10];一些相关治疗措施可以改变其表达水平,减少不良反应[11-12]。8-OHdG的作用愈来愈受关注,但关于8-OHdG与近期疗效的研究报道较少。本研究以血清8-OHdG为检测指标,探讨了其与晚期NSCLC患者放化疗联合治疗近期疗效的相关性,现将研究结果报道如下。
1 资料与方法
1.1一般资料 选择2018年1—12月于河北工程大学附属医院肿瘤科就诊的晚期NSCLC患者87例作为患者组,均经病理学初次确诊,首次抗癌治疗,KPS评分≥60分,未合并高血压、糖尿病、其他系统肿瘤及危及生命的疾病;其中男60例,女27例;年龄48~80(64.9±9.6)岁;有吸烟史52例,无吸烟史35例;TNM分期:ⅢB期39例,Ⅳ期48例。病理类型:腺癌41例,鳞癌46例;病理分级:高、中分化癌各23例,低分化癌41例。选取同期健康体检者80例作为对照组,男57例,女23例;年龄48~75(62.7±7.4)岁。2组基本资料均衡(P均>0.05),有可比性。本研究2组研究对象均知情并签署知情同意书,且研究经河北工程大学附属医院伦理委员会审核批准。
1.2仪器与试剂 美国Varian(瓦里安)ClinicIX直线加速器;美国Bio-Rad imark 酶标仪;德国eppendorf恒温混匀器;武汉华美8-OHdG试剂盒(CBS-E10140h);河北兰海紫杉醇针(30 mg/支);江苏豪森培美曲塞二钠针(0.2 g/支)、顺铂针(30 mg/支)。
1.3治疗方案 所有晚期NSCLC患者均采用同步放化疗联合方案进行治疗。放疗方案:采用IMRT,在Varian Eclipse DX计划系统勾画靶区及危及器官;放疗剂量为60 Gy,2 Gy/次,每天1次,每周5次,共30次。化疗方案:肺鳞癌采用TP方案,即紫杉醇175 mg/m2静滴第1天+顺铂75 mg/m2静滴第1天,肺腺癌采用PP方案,即培美曲塞二钠500 mg/m2,静滴第1天+顺铂75 mg/m2,静滴第1天。放疗开始第6天进行第1次化疗,21 d为1个周期。采集标本周期内,共化疗2次。
1.4研究方法 患者组于放疗前、放疗15次、放疗30次、放疗结束后第4周各采集空腹静脉血5 mL,对照组采集空腹静脉血5 mL,室温2 000 r/min离心20 min,分离血清。ELISA法检测8-OHdG水平,严格按说明书进行操作。比较患者组不同时间点8-OHdG水平与对照组的差异,放化疗联合治疗对血清8-OHdG水平的影响,放疗后第4周对入组患者进行疗效评价,并分析血清8-OHdG与近期疗效的关系。
1.5近期疗效评价 放疗结束后第4周,根据实体瘤疗效评价标准1.1版(response ebaluation criteria in solid tumors,RECIST)进行疗效评价,分为完全缓解(CR):病灶完全消失;部分缓解(PR):患者病灶最大径之和减少≥30%;疾病稳定(SD):患者病灶最大径之和缩小≤30%,增加≤20%;疾病进展(PD):患者病灶最大径之和增加≥20%。CR、PR和SD之和为有效。
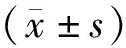
2 结 果
2.1晚期不同病理类型NSCLC患者和对照组血清8-OHdG水平比较 放疗前肺鳞癌患者血清8-OHdG水平为(45.98±8.74)mg/mL,肺腺癌患者为(47.89±9.25)ng/mL,对照组为(40.84±7.25)ng/mL,不同病理类型患者血清8-OHdG水平比较差异无统计学意义(P>0.05),但均显著高于对照组(P均<0.05)。
2.2放化疗联合治疗对患者血清8-OHdG水平的影响 放疗15次和放疗30次患者血清8-OHdG水平[(61.17±10.30)ng/mL,(58.21±10.08)ng/mL]比较差异无统计学意义(P>0.05),但均高于放疗前[(46.88±8.02)ng/mL](P<0.05);放疗后第4周患者血清8-OHdG水平[(47.05±9.77)ng/mL]显著低于放疗15次和放疗30次(P均<0.05),与放疗前比较差异无统计学意义(P>0.05),但仍显著高于对照组(P<0.05)。
2.3患者血清8-OHdG水平与近期疗效的关系 PD患者放疗前及放疗后不同时间点血清8-OHdG水平显著高于PR和SD患者(P均<0.05),而后两者比较差异均无统计学意义(P均>0.05),见表1。Kendall’s tau-b 相关分析显示,放疗前血清8-OHdG水平与晚期NSCLC患者近期疗效呈负相关(r=-0.465,P<0.05)。
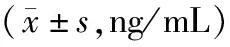
表1 晚期NSCLC患者血清8-OHdG水平与近期疗效的关系
2.4影响晚期NSCLC近期疗效的单因素分析 经卡方检验/t检验分析发现,晚期NSCLC患者近期疗效与年龄、性别、吸烟史、病理类型无关(P均>0.05),与KPS评分、肿瘤大小、病理分级、TNM分期和血清8-OHdG水平有关(P均<0.05)。见表2。
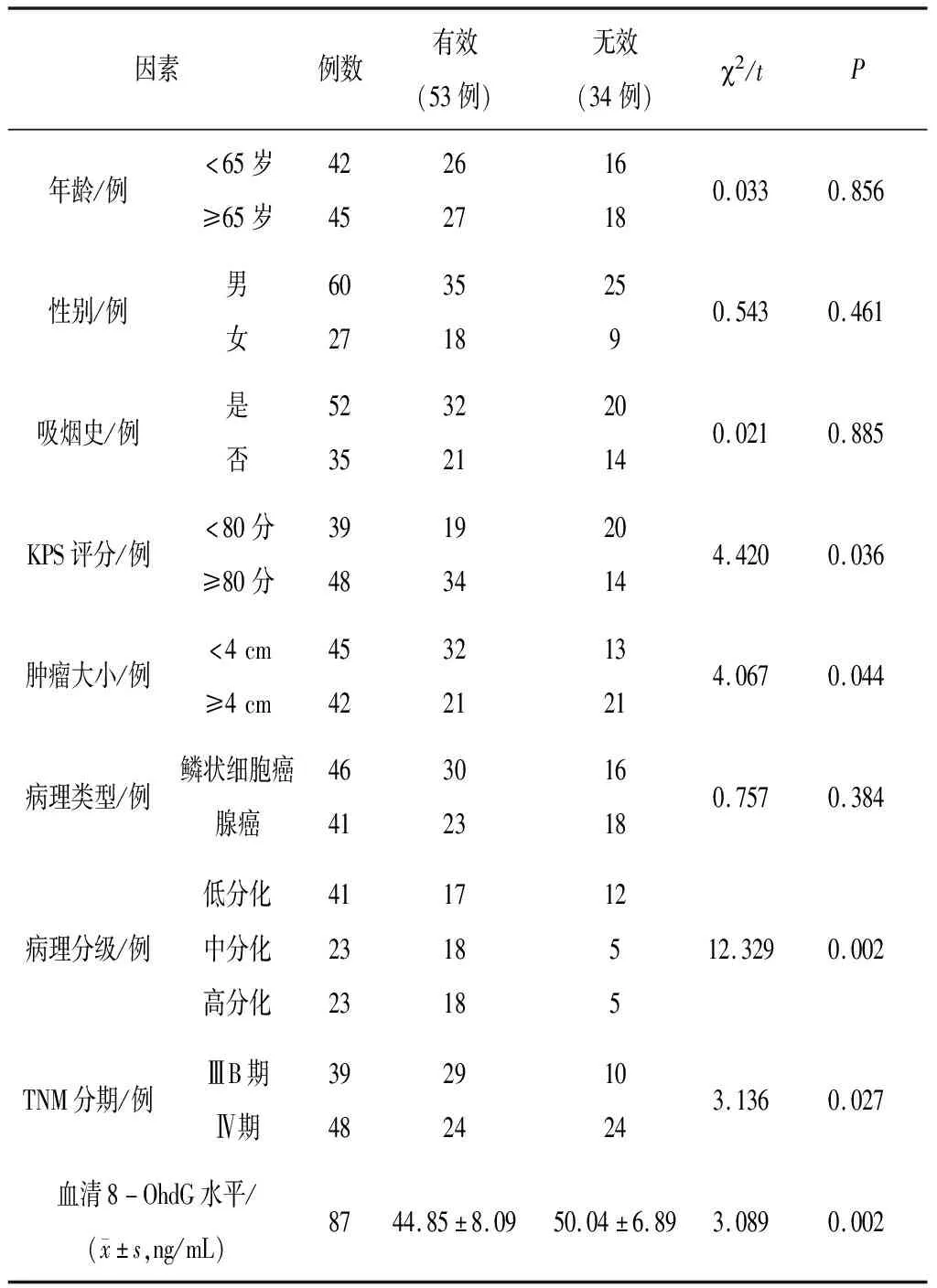
表2 影响晚期NSCLC患者近期疗效的单因素分析
2.5影响晚期NSCLC患者近期疗效的多因素分析将单因素分析中P<0.1的因素纳入多因素分析,采用二分类Logistic 回归模型分析数据显示,血清8-OHdG水平为影响近期疗效的危险因素,其水平高的患者较水平低的患者疗效差,差异有统计学意义[HR=1.053,95%CI(1.007,1.101),P<0.05]。见表3。
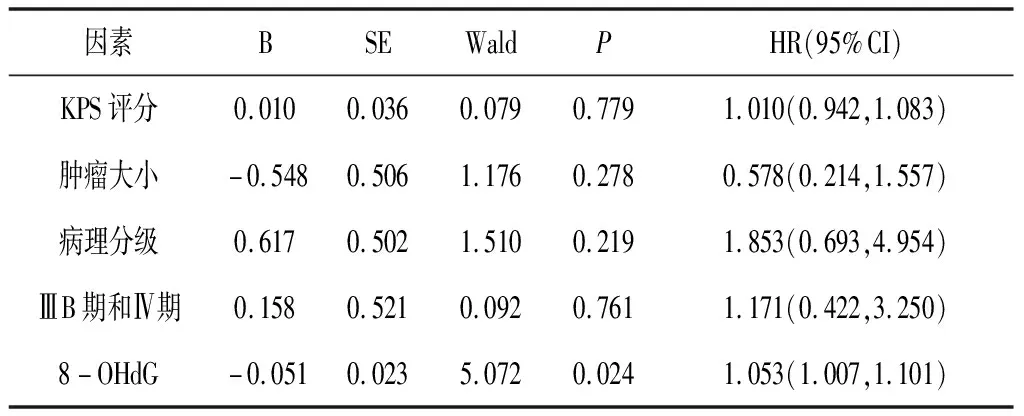
表3 影响晚期NSCLC组患者近期疗效的多因素分析
3 讨 论
机体氧化系统与抗氧化系统失衡,使机体处于氧化应激状态,导致活性氧自由基水平升高,进而攻击细胞DNA,产生大量8-OHdG。因8-OHdG结构稳定,不易被降解,故被认为是衡量DNA损伤和氧化应激的有效指标[13]。8-OHdG在体内集聚,成为病理损伤的诱发因子,其水平升高与多种疾病相关,其中包括恶性肿瘤。王宏英等[14]研究发现8-OHdG在肾癌组织表达水平高于肾正常组织,马玲娜等[15]发现结直肠癌患者尿8-OHdG水平高于健康人,Suzan等[6]研究发现甲状腺乳头状癌患者血清8-OHdG水平高于健康人。本研究结果同样显示晚期NSCLC患者血清8-OHdG水平显著高于对照组,提示8-OHdG与NSCLC的发生发展有关。
本研究还显示,放疗15次和放疗30次时,患者血清8-OHdG水平显著升高,表明放化疗联合治疗在杀伤肿瘤细胞时增加DNA损伤,导致生成更多的8-OHdG,与文献[16]报道相似。放疗后第4周患者血清8-OHdG水平低于放疗15次和30次水平,接近放疗前水平,但仍高于对照组。提示治疗结束后,治疗导致的DNA损伤减少或逐渐修复,8-OHdG生成减少,部分已生成的8-OHdG可经尿液排出,可能是导致这一结果的原因。但郭正勇等[11]发现氯沙坦能降低2型糖尿病患者尿8-OHdG水平,聂晓枫等[12]发现阿托伐他汀可降低缺血性心肌病患者血清8-OHdG水平,且均为高剂量药物作用更显著。与本研究结果存在差异,可能是因为不同的治疗方式作用机制不同,导致不同的结果,但都说明治疗可改变患者的8-OHdG水平,其或可作为治疗疾病的潜在靶点。
Ma-on等[5]研究发现8-OHdG在肝癌组织高表达,与患者生存不良和生存期短有关。He等[17]研究也发现8-OHdG高表达的食管癌患者术后生存期较低表达患者显著缩短,认为其可作为预测食管癌预后的独立预测因子。但关于8-OHdG与肿瘤近期疗效的相关研究尚未见报道。本研究发现KPS评分、肿瘤大小、病理分级、TNM分期和血清8-OHdG水平可影响晚期NSCLC患者近期疗效,但血清8-OHdG是影响晚期NSCLC患者近期疗效的危险因素,与文献[5,17]报道结果相近。
综上所述,NSCLC患者血清8-OHdG水平表达增高,放化疗联合治疗可使其水平进一步升高;其表达水平与近期疗效呈负相关,提示其可作为预测近期疗效的指标,可为临床定制治疗方案提供实验依据。
利益冲突:所有作者均声明不存在利益冲突。
